连续性血液净化治疗脓毒性休克的临床效果及应用价值分析
朱红鹰(云南省楚雄市人民医院,云南 楚雄 675000)
脓毒性休克在临床中又被称为“感染性休克”,是由于脓毒症引发的休克,是临床常见极危重症之一,多见于急性脓性肠梗阻胆道炎、肾盂肾炎、急性胰腺炎,具有起病急骤、病情发展迅速、死亡率高、治愈难度大等特点[1-2]。临床常规治疗以抗感染、机械通气、液体复苏、纠正水电解质失衡等为主,并不能有效抑制炎症因子释放,对患者病情改善效果不理想[3]。CBP(连续性血液净化)是一种外源性清除技术,可减少血液循环中的溶质、水分,清除血液中炎症介质,纠正水电解质紊乱,维持内环境稳定性[4]。基于此,为探究脓毒性休克治疗中CBP的效果,本文选取本院2019年1月-2021年1月住院治疗的98例脓毒性休克患者研究,具体报道如下。
1 资料与方法
1.1 一般资料 选取本院2019年1月-2021年1月住院治疗的98例脓毒性休克患者,已得到医院伦理委员会审批,根据治疗方法的不同分组,试验组(49例):25例男性、24例女性;年龄范围23-76岁,平均(49.52±6.34)岁;病程2-11h,平均(6.52±3.74)h;基础疾病:12例泌尿系统感染、16例中枢神经系统感染、8例腹腔感染、13例肺炎;体重43-96kg,平均(69.82±8.44)kg。参照组(49例):27例男性、22例女性;年龄范围25-74岁,平均(49.65±6.29)岁;病程3-10h,平均(6.55±3.68)h;基础疾病:14例泌尿系统感染、15例中枢神经系统感染、6例腹腔感染、14例肺炎;体重45-95kg,平均(69.76±8.38)kg。两组(性别、基础疾病、病程、体重等)相比,差异不显著(P>0.05),可以比较。
纳入标准:①均满足《中国脓毒症/脓毒性休克急诊治疗指南》[5]中对“脓毒性休克”诊断标准。②年龄在18-80周岁,不限性别。③病历资料无缺失。④意识清醒、对答切题。⑤家属均知情,已同意并自愿参与此研究。
排除标准:①处于哺乳、妊娠期女性。②合并恶性肿瘤者。③入组前1周接受过抗感染治疗者。④中途退出此研究者。⑤合并艾滋病、肺结核、梅毒者。⑥合并心力衰竭、脑卒中者。⑦合并帕金森、狂躁症、痴呆者。⑧过敏体质者。⑨合并凝血功能障碍者。⑩存在酒精依赖、药物滥用者。
1.2 方法 参照组采用临床常规方案治疗。所有患者均予以同步间歇指令性通气模式,吸入氧浓度为50%-60%,根据呼吸频率、自主呼吸潮气量调节呼吸参数,PaCO2(动脉血二氧化碳分压)维持在35-45mmHg。针对性地处理各种原发病,保证营养供给。根据药敏试验结果合理选用抗生素,进行抗感染治疗,所有患者在发病6h内接受液体复苏治疗,及时纠正水电解质平衡,维持各个器官功能。
试验组在参照组基础上采用CBP治疗。CBP治疗:股静脉或颈内静脉插管,留置导管,采用型号为DX-10的血液净化机治疗,选择连续性静脉血液滤过模式,选择合适的聚砜膜、管路,而后进行体外循环管路血浆预冲,以稀释法将置换液输注,置换液为2g葡萄糖酸钙、10mL氯化钾、50mL 5%葡萄糖溶液、500mL注射用水、3000mL等渗盐水混合液,同步输注,输注速率是4000mL/h,稀释注入量占置换液的80%,30-100mL/min的血泵转速,24h更换滤器1次,连续治疗72h。CBP开始后予以低分子肝素钠注射液5000IU,从血管通道动脉端推注,每隔1h追加1250IU。
1.3 观察指标及评价标准 观察指标包括:①临床疗效评价细则:休克等症状消失,实验室、影像学指标复常为显效。休克等症状减轻,实验室、影像学指标接近正常为有效。未达以上标准为无效。总有效率=(显效+有效)/49×100.00%[6]。②血清炎症指标、BNP:抽取患者3mL空腹静脉血,以3200r/min离心速率、10cm离心半径离心处理10min,分离血清并置于-80℃环境保存待检,以ELISA法检测CRP(C反应蛋白)、PCT(降钙素原)、BNP(脑力钠肽),以全自动生化分析仪检测WBC(白细胞计数),试剂均由厦门海菲生物技术股份有限公司提供,一切操作谨遵相关说明书完成,所有的血液样品必须在采集后的2h内完成检测。③LVEF:采用彩色多普勒超声诊断仪测量LVEF(左心室射血分数)。④SOFA(序贯器官衰竭评估)评分:包括肾脏、肝脏、神经、心血管、血液、呼吸六部分,总分为24分,器官衰竭程度越严重,分值越高[7]。Cronbach's α系数为0.816,信效度良好。⑤APACHE II(为急性生理与慢性健康评分)评分:包括慢性健康、年龄、急性生理三部分,总分为71分,身体健康程度越差,分值越高[8]。Cronbach'sα系数为0.827,信效度良好。⑥并发症总发生率:统计代谢性酸中毒、应激性溃疡、急性呼吸窘迫综合征总发生率。⑦28d存活率:统计研究对象28d死亡率,死亡率=死亡例数/每组对应总例数(49)×100.00%。⑧ICU住院时间。
1.4 统计学方法 以SPSS26.0软件检验,正态分布计量资料(血清炎症指标、LVEF、血清BNP、SOFA评分、APACHE II评分、ICU住院时间)组内对比采用配对样本t检验,组间对比采用独立样本t检验,以(±s)表示,计数资料(临床疗效、并发症总发生率、28d存活率)采用χ2检验,以[n(%)]表示,P<0.05表示具统计学意义。检验水准a=0.05。
2 结果
2.1 临床疗效对比 试验组临床总有效率(95.92%)高于参照组(73.47%),P<0.05,见表1。

表1 两组临床疗效对比[n(%)]
2.2 血清炎症指标对比 治疗前试验组血清CRP、PCT、WBC与参照组比较,P>0.05;治疗后试验组血清CRP、PCT、WBC均低于参照组,P<0.05。两组组内相比,治疗后血清CRP、PCT、WBC均比治疗前低,P<0.05,见表2。
表2 两组血清炎症指标对比(±s)

表2 两组血清炎症指标对比(±s)
组别(n=49)CRP(mg/L) t P PCT(ng/mL) t P WBC(×109/L) t P治疗前 治疗后 治疗前 治疗后 治疗前 治疗后参照组 60.52±9.64 46.82±5.16 8.771 0.000 39.82±5.44 34.25±3.16 6.198 0.000 22.64±4.52 16.82±3.52 7.111 0.000试验组 60.61±9.55 30.16±2.05 21.822 0.000 39.91±5.39 26.82±1.34 16.498 0.000 22.69±4.49 9.52±1.27 19.757 0.000 t 0.046 21.004 - - 0.082 15.153 - - 0.055 13.655 - -P 0.963 0.000 - - 0.935 0.000 - - 0.956 0.000 - -
2.3 LVEF、血清BNP对比 治疗前试验组LVEF、血清BNP与参照组比较,P>0.05;治疗后试验组LVEF高于参照组,血清BNP低于参照组,P<0.05。两组组内相比,治疗后LVEF均比治疗前高,血清BNP均比治疗前低,P<0.05,见表3。
表3 两组LVEF、血清BNP对比(±s)
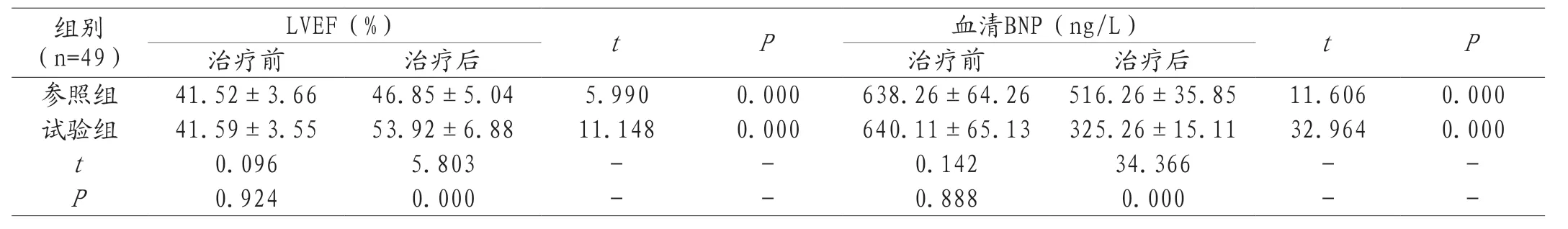
表3 两组LVEF、血清BNP对比(±s)
组别(n=49)LVEF(%) t P 血清BNP(ng/L) t P治疗前 治疗后 治疗前 治疗后参照组 41.52±3.66 46.85±5.04 5.990 0.000 638.26±64.26 516.26±35.85 11.606 0.000试验组 41.59±3.55 53.92±6.88 11.148 0.000 640.11±65.13 325.26±15.11 32.964 0.000 t 0.096 5.803 - - 0.142 34.366 - -P 0.924 0.000 - - 0.888 0.000 - -
2.4 SOFA评分、APACHE II评分对比 治疗前试验组SOFA评分、APACHE II评分与参照组比较,P>0.05;治疗后试验组SOFA评分、APACHE II评分均低于参照组,P<0.05。两组组内相比,治疗后SOFA评分、APACHE II评分均比治疗前低,P<0.05,见表4。
表4 两组SOFA评分、APACHE II评分对比(±s)
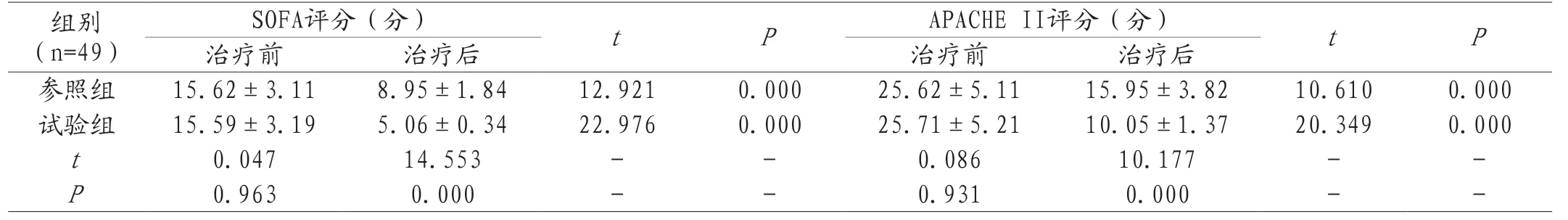
表4 两组SOFA评分、APACHE II评分对比(±s)
组别(n=49)SOFA评分(分) t P APACHE II评分(分) t P治疗前 治疗后 治疗前 治疗后参照组 15.62±3.11 8.95±1.84 12.921 0.000 25.62±5.11 15.95±3.82 10.610 0.000试验组 15.59±3.19 5.06±0.34 22.976 0.000 25.71±5.21 10.05±1.37 20.349 0.000 t 0.047 14.553 - - 0.086 10.177 - -P 0.963 0.000 - - 0.931 0.000 - -
2.5 并发症总发生率对比 试验组并发症总发生率(2.04%)低于参照组(16.33%),P<0.05,见表5。

表5 两组并发症总发生率对比[n(%)]
2.6 28d存活率对比 试验组28d存活率(100.00%)高于参照组(89.80%),P<0.05,见表6。
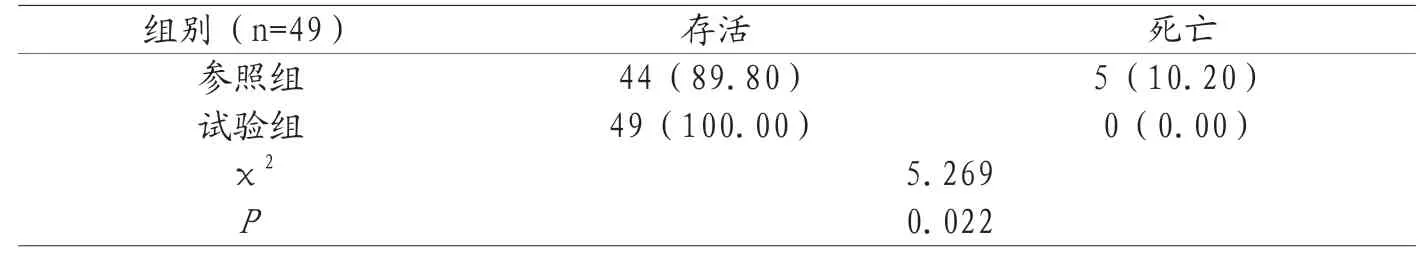
表6 两组28d存活率对比[n(%)]
2.7 ICU住院时间对比 试验组ICU住院时间为(8.06±1.54)d、参照组ICU住院时间为(11.62±3.74)d,试验组比参照组短,P<0.05(t=6.161、P=0.000)。
3 讨论
脓毒症休克是脓毒症患者极为严重的阶段和表现,死亡风险较高,是导致ICU极危重症患者死亡的重要原因之一[9]。据流行病学调查显示:脓毒症休克患者的死亡率高达50%[10]。脓毒症休克患者以血压降低、血管麻痹为突出特征,同时伴有心肌细胞能量代谢障碍,心肌细胞受到不同程度的损伤,伴有心律失常、心力衰竭、低血压等,左心室射血分数、心肌收缩力均降低,出现可逆性的心室扩张,对血管活性药物的敏感性减弱、液体复苏的反应性降低,对临床治疗提出了更高的要求[11-12]。BNP主要存在于右心房中,正常人群心房以及心室合成、分泌少量的BNP,一旦心功能受损,则大量的BNP会释放到血液中,导致血清BNP浓度增高。脓毒症休克患者机体LVEF普遍较低,血清BNP浓度较高。增高LVEF,抑制血清BNP高表达在脓毒症休克治疗中具有积极意义。
有研究表明:脓毒症休克的发生、发展是一个渐进性的级联炎症反应[13]。当机体受到感染时,在感染早期,就会释放大量的炎症因子,例如CRP、PCT、WBC等,加重心肌细胞受损程度[14]。CRP是由肝脏合成,为组织坏死、感染、创伤等急性时相反应的特异性指标,与炎症反应呈正相关性。PCT主要由甲状腺C细胞合成、分泌,正常人群机体血清PCT含量较低,当机体出现创伤、感染时,内分泌细胞、淋巴细胞会释放大量的PCT,导致血液中PCT水平增高[15-16]。WBC具有吞噬功能,被认为是人体防御系统的重要防线,WBC的升高表明机体存在组织损伤、炎症、感染等。故如何抑制炎症因子释放、减轻炎症反应在改善脓毒症休克患者治疗中具有重要意义。本研究显示:试验组临床总有效率(95.92%)高于参照组(73.47%),试验组治疗后血清CRP、PCT、WBC、血清BNP、SOFA评分、APACHE II评分均低于参照组,试验组治疗后LVEF高于参照组,试验组并发症总发生率(2.04%)低于参照组(16.33%),试验组28d存活率(100.00%)高于参照组(89.80%),试验组ICU住院时间短于参照组,P<0.05。表明CBP应用于脓毒症休克治疗中效果显著。原因分析如下:①临床常规治疗以抗感染、抗炎、纠正电解质紊乱等为主,治疗效果不稳定,且治疗期间患者容易出现代谢性酸中毒等并发症,患者死亡率较高,ICU住院时间较长,所承担的治疗成本、心理负担均较重,现已不能满足临床需求。②CBP可以及时清除组织以及血液中的炎症介质,避免机体组织、器官等受到损伤,即便是在炎症反应晚期,接受CBP治疗,仍旧可以对血管内皮细胞起到一定的保护作用,提高机体内环境的稳定性,促进免疫功能恢复。③CBP还可以及时纠正脓毒症休克患者高代谢、肠壁水肿、酸中毒状态,增强肺氧合能力,改善脏器血流灌注,为后期药物以及手术治疗奠定良好的基础。④CBP可以按需提供机体所需的药物,调节水、盐、电解质代谢,提高血流动力学稳定性,改善氧代谢。⑤CBP包括吸附、对流、弥散三种清除溶质方式,可以通过对流的方式及时清除机体CRP、PCT等中分子物质,通过弥散的方式将尿素氮等小分子物质清除。因此CBP在维持有效循环血量的同时,可减轻机体炎症反应,保护重大脏器功能,维持免疫平衡,提高治疗成功率,降低死亡率。在孔霖[17]等人的研究中,对照组(临床常规治疗)治疗后APACHE II评分为(15.46±6.33)分,观察组(在常规治疗基础上予以CBP治疗)治疗后APACHE II评分为(11.65±5.22)分,P<0.05,与本研究结果接近,证实了CBP在脓毒症休克治疗中效果确切。
本研究存在一定不足,例如样本容量较小、病例地域分布局限、研究及随访时限较短,对结果的一般性、普遍性、有效性有所影响,故仍旧需临床进一步扩大样本容量、增加不同地域脓毒症休克病例、延长研究及随访时限,为评估CBP在脓毒症休克治疗中的临床疗效提供更多参考依据。
综上所述,脓毒症休克患者采用CBP治疗,可有效改善患者病情以及心功能,减轻炎症反应,抑制血清BNP高表达,降低并发症发生率,提高生存率,缩短ICU治疗时间,临床疗效确切。

