肝硬化患者中医证型演变过程中肠道菌群结构变化及其临床意义*
郭晓霞 叶永安 李小科 郭琲婷 吕 蕾 秦雪梅
1.山西省中医药研究院 (山西 太原, 030012) 2.北京中医药大学东直门医院 3.山西大学中医药现代研究中心
肝硬化(LC)是一种由多种肝损伤导致高死亡率和高发病率的晚期肝病,其特征是肝纤维化和门静脉高压症。在世界范围内,该病每年可导致103万人死亡[1],在欧洲每年导致17万人死亡[2],被确定为世界上第14大死亡原因,LC的发病率和死亡率在发达国家中继续增加[3]。因此,有效干预LC的进展至关重要。越来越多的研究表明,肠道微生态改变可能会促进LC患者病情进展[4],与肝脏疾病的发生发展密切相关[5]。我们前期研究发现LC以肝郁脾虚证和湿热内蕴证为主要证型[6]。目前分析LC患者中医证型演变规律,并探讨其与肠道菌群水平动态变化的相关报道甚少。本研究观察44例不同中医证型LC患者的临床生化指标及肠道菌群动态变化,报道如下。
1 临床资料
1.1 一般资料 选取2017年8月至2019年8月于山西省中医院肝病科就诊的LC患者44例为研究对象,另选取健康志愿者10例为健康对照组。本研究经山西省中医院伦理委员会审批通过(No.省中医伦字 2016-05006),患者均签署知情同意书。
1.2 纳入及排除标准 纳入标准:①所有患者经临床诊断、形态学诊断及影像学检查确诊均符合LC诊断标准,年龄18~70周岁,根据肝功能ALBI评分标准分级标准分为1、2、3级;②健康对照组人员年龄18~70岁,体格检查、血尿常规、肝功能、肾功能均在正常范围内。
排除标准:①高血压、糖尿病、肥胖、代谢综合征及各种胃肠道疾病者;②受试者入组前2周内系统使用过抗生素、微生态制剂及质子泵抑制剂;③孕期及哺乳期妇女。
44例LC患者中肝郁脾虚证30例,湿热内蕴证14例;3组人群的一般资料见表1。
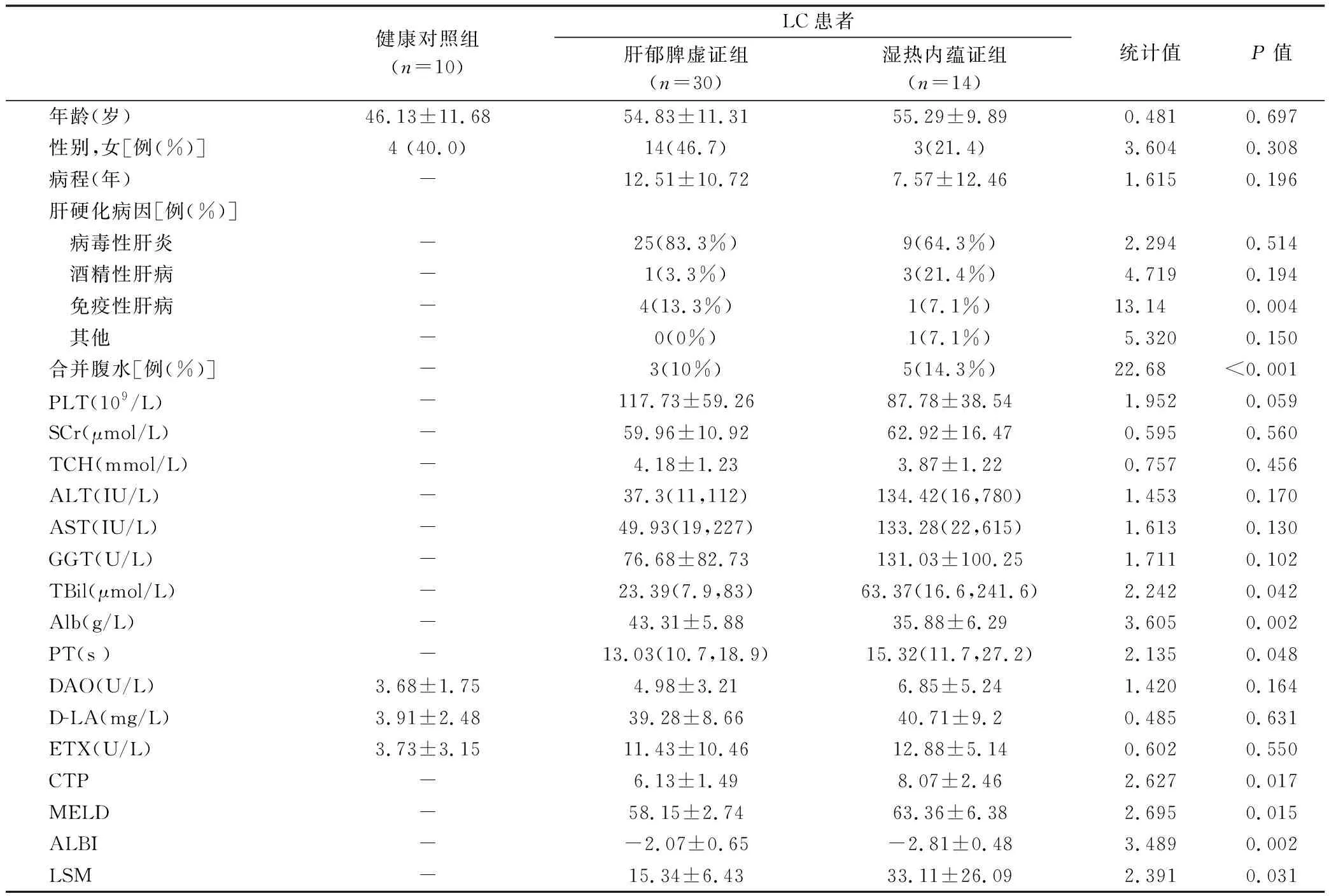
表1 3组人群的一般资料比较
1.3 研究方法
1.3.1 粪便菌群检测 留取受试者粪便标本3~5 g,于排便后2 h内收集在密闭的粪便储存盒内并置于-80℃冰箱冷冻,统一送至上海派森诺生物科技有限公司,提取粪便样本总DNA,根据细菌16S rDNA V3-V5区设计引物进行扩增(引物名称338F/806R,前引物序列ACTCCTACGGGAGGCAGCA,后引物序列GGACTACHVGGGTWTCTAAT),利用Illumina Miseq平台进行高通量测序,测序结果经过Reads拼接,以97%的相似性将序列聚类成为操作分类单元(OTUs)并进行物种注释。
1.3.2 生物信息学分析 应用MicrobiomeAnalyst平台实现Alpha、Beta多样性(采用PCoA方法结合bray-curtis距离)、物种组成、LEfse分析以及随机森林模型预测。利用R语言3.6.1进行UpSet韦恩图分析、Spearman相关性分析。冗余分析(RDA)采用CANOCO5.0软件。
1.3.3 菌群失衡度指标(CDR、HBCDI)的计算 CDR=(毛螺菌科+瘤胃菌科+韦荣氏菌科+梭菌科XIV)相对丰度/(拟杆菌科+肠杆菌科)相对丰度[7];HBCDI=(肠球菌属+链球菌属+乳杆菌属)相对丰度/(瘤胃球菌属+普氏菌属+拟杆菌属)相对丰度[8]。
1.3.4 临床指标检测 受试者血液标本在山西省中医院检验科检测,包括血肌酐(SCr)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、白蛋白(Alb)、总胆红素(TBil)、血小板计数(PLT)、凝血酶原时间(PT)。
1.3.5 肠屏障功能受损评估指标的检测 受试者血液标本采用JY-DLT肠道屏障功能生物化学指标分析系统检测血清二胺氧化酶(DAO)、D-乳酸(D-LA)及内毒素 ETX)水平,按酶联免疫吸附法试剂盒说明书操作,试剂盒均购自上海酶联生物科技有限公司。
1.3.6 LC预后指标计算 MELD=9.6×ln[Crc mg/dl)]+3.8×In[TBil(mg/dl)]+11.2×ln(INR)+6.4×病因(胆汁淤积性和酒精性LC为0,病毒等其他原因LC为1,结果取整数)[9]。CTP将肝储备功能分为A(5~6分)、B(7~10分)、C(11~15分)3级[10]。ALBI=0.66×log10[TBil(μmol/L)]-0.085×[Alb(g/L)][11]。
1.3.7 LSM检测 应用FibroScan 502(购自法国爱科森公司),探头型号为Medium型测量LSM,以kPa表示。
1.4 统计学方法 使用SPSS 22.0软件进行统计分析,正态分布的计量资料组间比较采用单因素方差分析,计数资料组间比较采用χ2检验。非正态分布的计量资料组间比较采用Kruskal-WallisH检验。P<0.05为差异有统计学意义。
2 结果
2.1 不同中医证型LC患者肠道菌群多样性改变 本研究对所有鉴定的细菌OTUs进行序列对比分析,结果显示健康对照组、肝郁脾虚证组和湿热内蕴证组肝硬化患者肠道菌群的OTU数量存在明显差别,3组人群中肠道菌群共有的OTU有1 999个;健康对照组和肝郁脾虚证组人群共有169个OTUs,健康对照组和湿热内蕴证组人群共有29个OTU,肝郁脾虚证组和湿热内蕴证组患者共有404个OTU;各组人群特有的OTUs个数分别为健康对照组27个,肝郁脾虚证组116个,湿热内蕴证组38个。见图1。
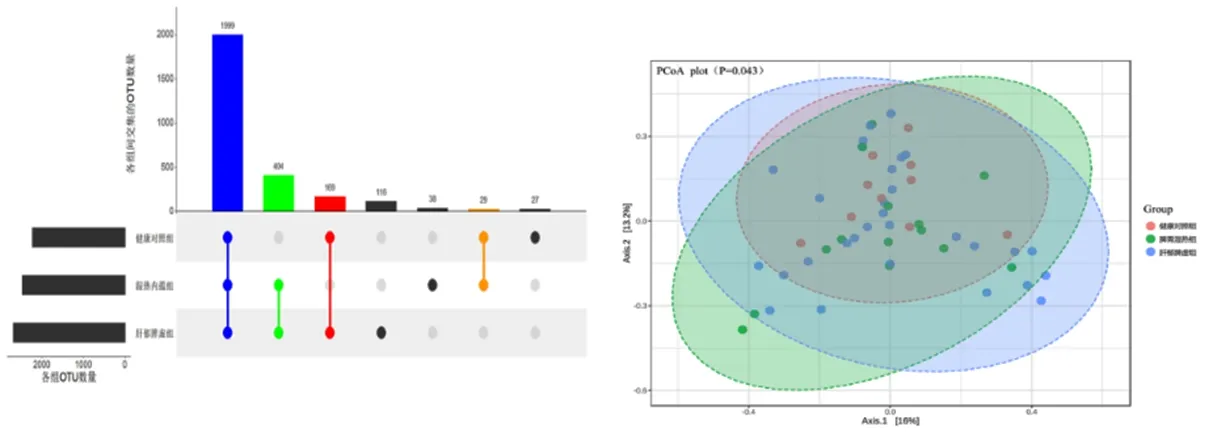
图1 各组间UpSet韦恩图及 PCoA图 (左边水平柱状图表示各分组的OTU统计数值,中间矩阵中的单个点表示某个分组特有的元素,点和点之间的连线表示不同分组特有的交集,竖直柱状图中则分别表示对应的交集元素数值)
结合OTUs所代表的物种,本研究共观察到来自13个已知菌门的458个菌属,3组人群中肠道菌群的菌属数量存在明显的差别,其中156个菌属在3组人群中均出现,健康对照组特有菌属48个,肝郁脾虚证组患者特有菌属79个,湿热内蕴证组患者特有菌属29个。
本研究应用Alpha多样性反应肠道物种的丰富度和均匀度,包括 Chao1、ACE、Shannon和Simpson指数。结果表明,各组间比较均差异无统计学意义(P>0.05)见表2。β多样性是度量不同组间的菌群组成与分布差异。使用Bray-Curtis指数评估健康对照组、肝郁脾虚证组和湿热内蕴证组人群之间的多样性差异,置换多元方差分析(PERMANOVA)表明,3组人群的聚类差异显著(P<0.05)。Bray-Curtis dissimilarity差异检验R2=0.056,提示不同分组因素对肠道菌群差异的解释度是5.6%。见图2。

表2 不同中医证型的肝硬化患者肠道菌群的Alpha多样性指数
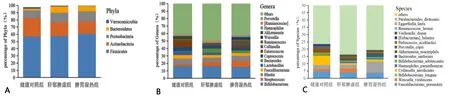
图2 肝硬化不同中医证型与健康人群肠道菌群的构成变化 (A-C:门、属、种水平上物种丰度组成柱状图)
2.2 不同中医证型LC患者与健康人群的肠道菌群结构变化 为了获悉组间不同样本粪便肠道菌群的组成结构,研究以总序列百分比统计。结果见表3。
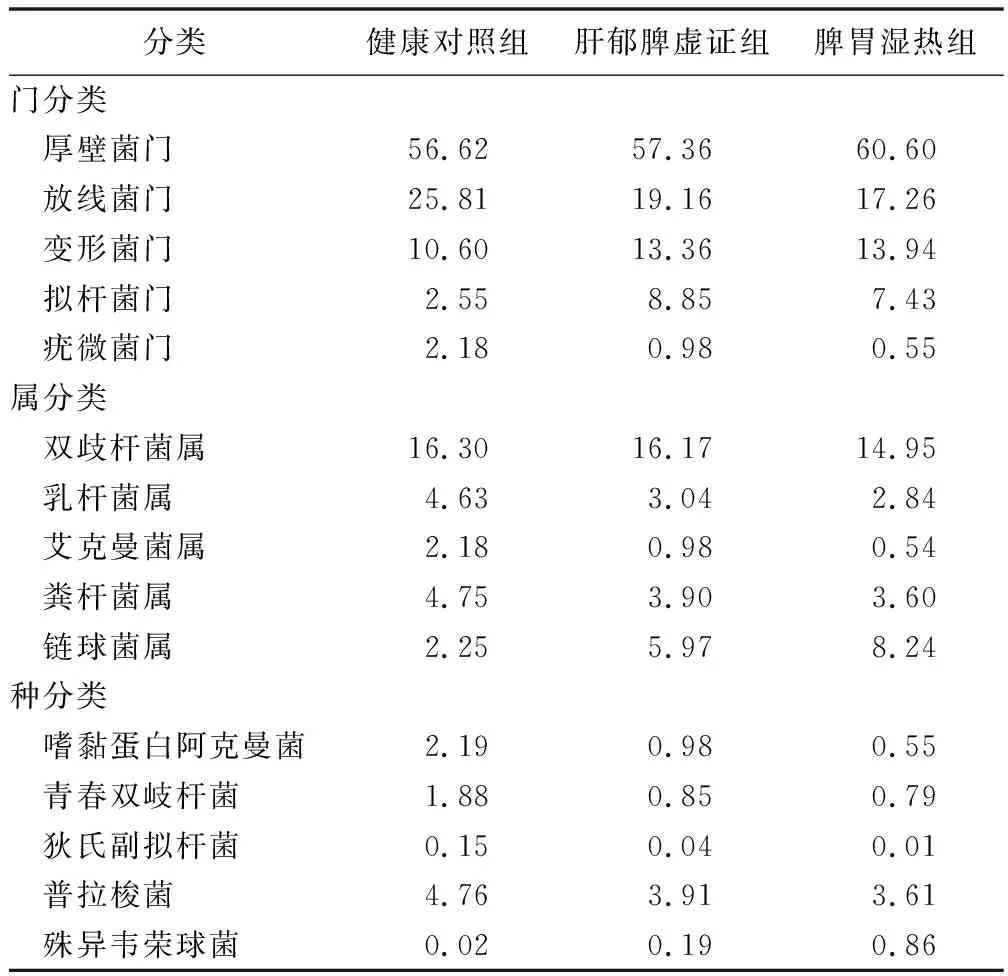
表3 不同中医证型LC患者肠道菌群分类学组成 (%)
2.3 不同中医证型LC患者的肠道菌群失衡度 见表4。
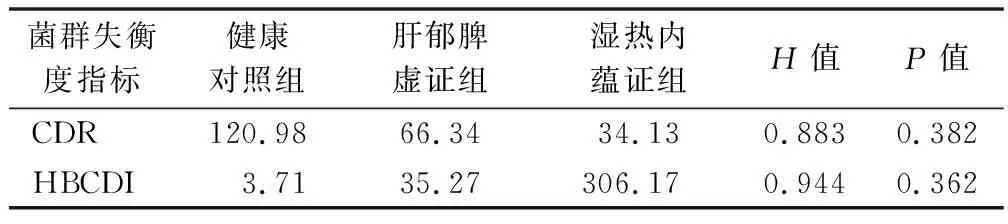
表4 不同中医证型LC患者间肠道菌群失衡度的差异(中位数)
2.4 随机森林预测模型的构建 随机森林模型预测结果显示,门、纲、目、科、属、种和OTUs水平构建的随机森林模型,袋外错误率分别是57.4%、42.6%、40.7%、46.3%、44.4%、37.0%和38.9%,可以看出在种水平上构建的模型显示出63.0%的最佳预测准确度。见图3。
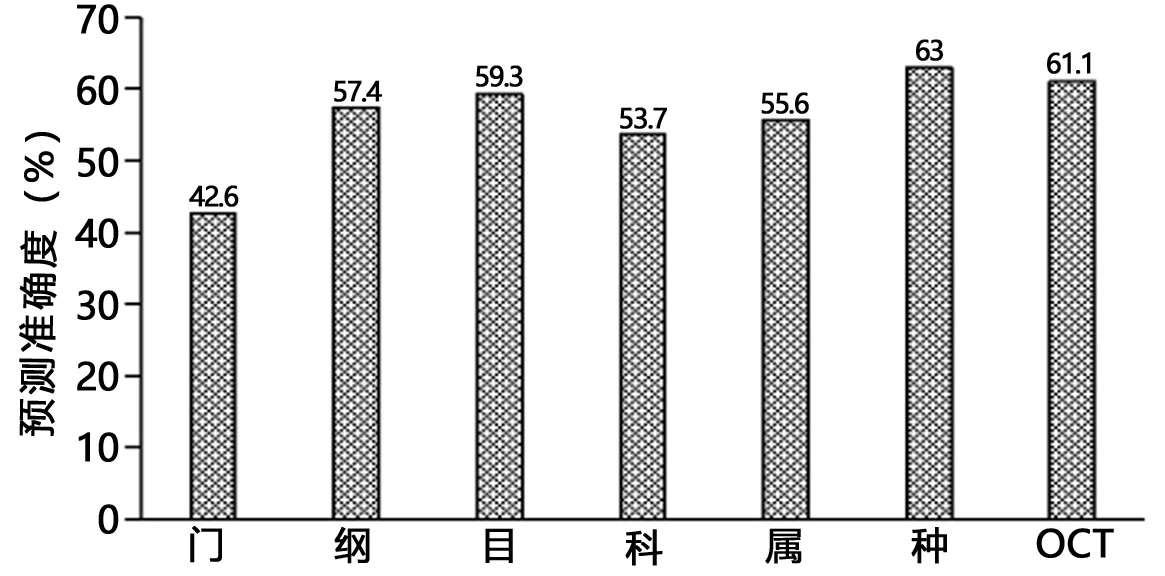
图3 所有肠道菌群物种在不同水平构建的随机森林预测模型的准确度
2.5 不同中医证型LC患者的关键菌属鉴定 根据β多样性结果,3组受试人群的肠道微生物多样性具有一定程度的差异,为了寻找造成肠道微生物多样性差异的关键菌属,本研究进行LEfSe分析。利用线性判别分析(LDA)对数据进行降维处理,并评估差异显著的物种的影响力(即LDA score),Score>2时,差异有显著意义。见图4。通过分析3组受试人群的生物标志物的差异,发现属水平上健康对照组受试者乳杆菌属(Lactobacillus)、阿克曼菌属相对丰度显著增加;肝郁脾虚证患者组链球菌属(Streptococcus)相对丰度显著增加;湿热内蕴证组韦荣氏球菌属(Veillonella)、嗜血杆菌属(Haemophilus)相对丰度显著增加。进一步对种水平的生物标志物进行分析,结果显示健康对照组受试者肠道中青春双歧杆菌、嗜黏蛋白阿克曼菌、普拉梭菌的相对丰度显著增加;肝郁脾虚证组患者肠道中胶黏罗斯菌、黏膜乳杆菌、咽峡炎链球菌的相对丰度显著增加;湿热内蕴证组患者肠道中脆弱拟杆菌、殊异韦荣球菌、副流感嗜血菌的相对丰度显著增加。
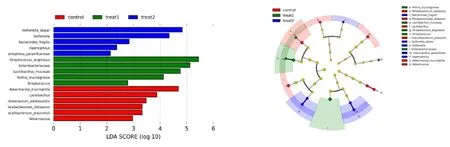
图4 各组间具有显著差异的分类单元展示图 (control为健康对照组,treat1为肝郁脾虚证组,treat2为湿热内蕴证组;图A纵坐标为各组间具有显著差异的物种,横坐标则以条形图展示对应物种的LDA差异分析对数得分值,柱状图的长度代表差异物种的影响大小(即为LDA Score);图B分类等级树展示了样本群落中从门到属(从内圈到外圈依次排列)所有分类单元的等级关系,节点大小对应于该分类单元的平均相对丰度。红色、绿色、蓝色节点分别表示在健康对照组、肝郁脾虚证组、湿热内蕴证组中起到重要作用的微生物类群)
2.6 不同中医证型LC患者的相关菌属与临床指标的相关性 见表5。
2.7 不同中医证型LC患者间肠道群落变异的驱动因子 RDA分析结果显示TBil、PT、ETX是影响肠道细菌群落变异的主要临床指标。根据箭头长度可以看出TBil、PT与肠道菌群分布相关性较大,可以认为TBil、PT是驱动肠道群落变异的主要因子,其中TBil对群落变异的影响最具有显著性(P=0.014)。见图5。
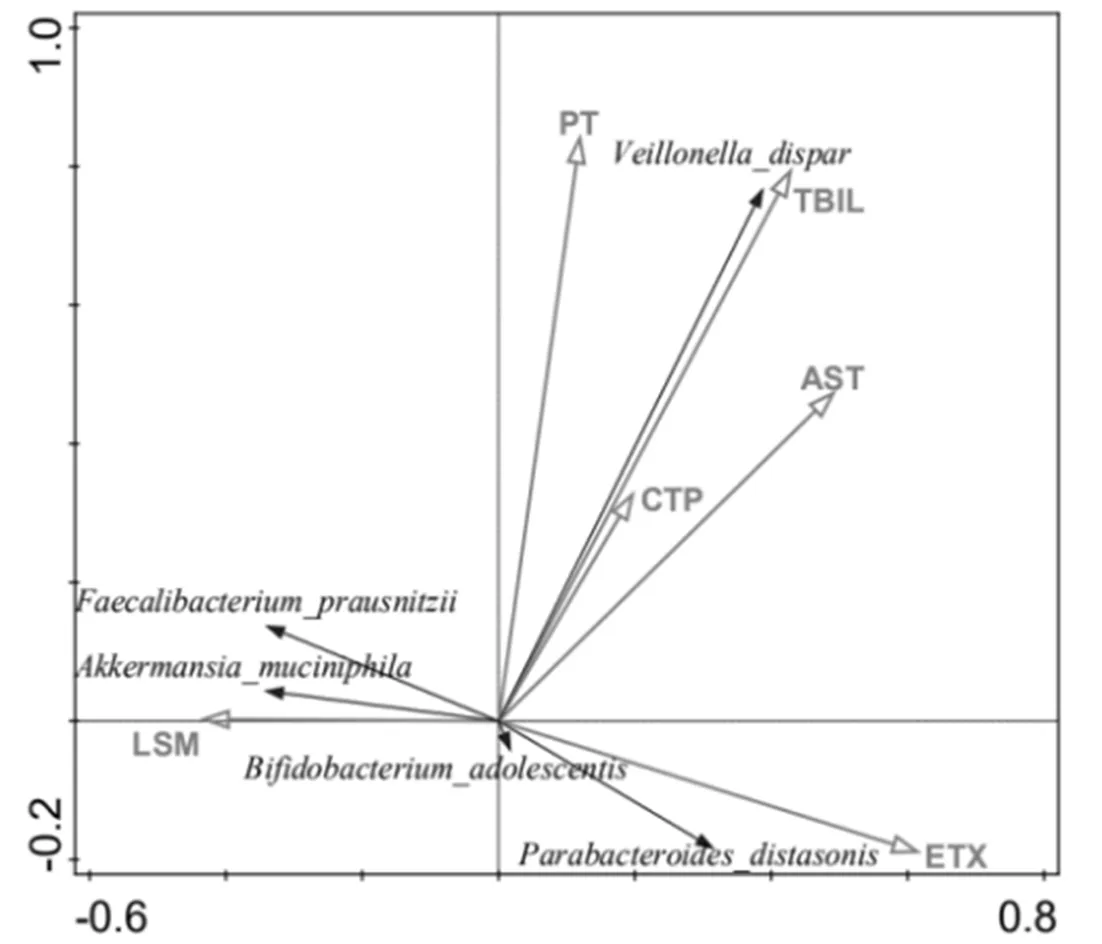
图5 肠道细菌群落及其变异驱动的主要环境因子RDA双向排序图(环境因子一般用箭头表示,箭头连线的长度代表某个环境因子与群落分布和种类分布间相关程度的大小,连线越长,说明相关性越大,反之越小)
3 讨论
肠道菌群作为人体免疫和代谢的重要组成部分,对于中医证型的形成有不容忽视的影响。目前已有不少学者探索了菌群与中医证候之间的关系。本研究以44例LC患者及10例健康者为研究对象,首先对受试人群的生化指标进行分析。目前LC进展及预后的主要评估指标有LSM、ALBI、CTP及MELD等。MELD评分可对终末期肝病短期、中期死亡率进行有效的预测,还可用于评估移植前患者等侯供肝期间的死亡率及肝移植术后的死亡率[9]。CTP是LC死亡最“稳健”和敏感的预测因子,已被广泛应用于评估预后、指导治疗、判断药物疗效和疾病预后[10]。LSM在慢性肝病患者中具有诊断和评估肝脏坏死性炎症最严重程度的潜力[12],ALBI指数可用于肝癌及慢性肝病患者的进展及预后评估[13,14]。研究结果显示随着中医证型从肝郁脾虚证到湿热内蕴证的转化,LC患者TBil逐渐升高,PT延长,Alb逐渐降低,LSM、CTP、MELD数值增加,ALBI指数降低,提示随着病情的进展,患者经历了从肝郁脾虚证到湿热内蕴证的演变,且4种预后指标在LC预后方面具有高度一致性。
肠道菌群具有促进肠黏膜免疫系统生长与发育和调控肠黏膜屏障与免疫功能的双重作用。本研究选取DAO、D-LA及ETX作为肠屏障功能受损的评估指标。DAO是肠黏膜上皮受损指标,存在于小肠黏膜上皮细胞上且具有高度活性的酶,是反映肠道黏膜通透性和肠黏膜屏障功能状态的敏感性指标[15]。D-LA是肠黏膜通透性变化指标,它是胃肠道多种细菌的代谢产物,当肠黏膜通透性增加时,肠道细菌产生的大量D-LA通过黏膜屏障进入血液,D-LA水平随之升高[16],因此可作为细菌感染和肠通透性增加的可靠指标。ETX由肠道革兰氏阴性菌产生,是肠道菌群移位指标,LC患者肠黏膜通透性增高,ETX通过受损的肠黏膜进入血液,到达肝脏并激活库普弗细胞,库普弗细胞激活后产生大量炎性介质进一步加重肝脏损伤[17]。ETX检测可判断肠屏障功能受损导致的内毒素移位,ETX水平升高的程度 可反映出肠黏膜屏障损伤的程度[18]。研究结果发现与健康人群相比,LC患者DAO、D-LA及ETX水平升高,提示患者肠屏障功能受损。随着LC肝郁脾虚证向湿热内蕴证转化,DAO、D-LA及ETX持续上升,提示LC疾病发展过程中肠屏障功能受损逐渐加重。与文献研究结果一致[19,20]。
在此基础上,本研究对所有患者粪便中的微生物进行16S rDNA的高通量测序技术,较系统、全面地分析了肝郁脾虚及湿热内蕴LC患者和健康受试者的肠道菌群结构变化情况。本研究中Alpha多样性结果显示,与健康人群相比,肝郁脾虚证和湿热内蕴证患者多样性有所下降,但差异无统计学意义。β多样性结果提示,3组受试人群间具有显著的微生物群落差异,其中有5.6%的原因是由不同分组因素导致的。
应用OTU在门、属和种分类水平上对3组受试者肠道菌群进行分析,结果显示3组受试者肠道菌群共有的OTU有1 999个,分属于放线菌门、拟杆菌门、厚壁菌门、梭杆菌门、变形菌门、蓝藻门、互养菌门、软皮菌门、疣微菌门、栖热菌门、浮霉菌门、酸杆菌门和TM7等13个菌门,其中以厚壁菌门和放线菌门为肠道绝对优势菌门。厚壁菌门、变形菌门和拟杆菌门含量从健康对照组、肝郁脾虚证组到湿热内蕴证组呈逐渐升高的趋势,而放线菌门和疣微菌门呈逐渐下降的趋势。本研究在属分类上共鉴定出458个菌属,各受试者组菌属表现较大的差异性,健康对照组受试者特有菌属48个,受试者肝郁脾虚证组患者特有菌属79个,湿热内蕴证组患者特有菌属29个。双歧杆菌为3组受试人群肠道菌群的优势菌属。这与之前文献报道的拟杆菌属是健康人和肝硬化患者中最丰富的细菌有所不同[10]。其中双歧杆菌属、乳杆菌属、艾克曼菌属、粪杆菌属丰度从健康对照组、肝郁脾虚证组到湿热内蕴证组呈现逐渐下降的趋势,链球菌属呈现逐渐上升的趋势。种水平上,嗜黏蛋白阿克曼菌、青春双岐杆菌、狄氏副拟杆菌、普拉梭菌丰度从健康对照组、肝郁脾虚证组到湿热内蕴证组呈现逐渐下降的趋势,殊异韦荣球菌呈现逐渐上升的趋势。这些结果提示LC病情的进展是因为致病菌的过度增长协同有益菌的缺乏,与我们前期研究结果一致[21]。因此定量评价各中医证型LC患者间肠道菌群失调的程度是我们重点关注的问题。既往研究中定量评价肠道菌群失衡程度的指标如CDR和HBCDI在本研究中的健康对照组、LC肝郁脾虚证组及湿热内蕴证组间虽然逐渐加重,但差异均无统计学意义,提示CDR和HBCDI在LC中医证型中评价肠道菌群失衡的效能不佳。考虑CDR和HBCDI系科和属层面的失衡度指标,具有一定的片面性和局限性,因此本研究在门、钢、目、科、属、种和OTU水平构建随机森林模型进行预测,结果显示在种水平上构建的模型显示出63.0%的最佳预测准确度。因此建立种水平上的菌群失衡指标是下一步研究的重点。
本研究通过LEfSe判别分析分别筛选了肝郁脾虚证组和湿热内蕴证组患者区别于健康对照组人群的重要特征性菌群。属水平上健康对照组受试者的特征性菌群为乳杆菌属、艾克曼菌属;肝郁脾虚证组患者的特征性菌群为链球菌属,湿热内蕴证组患者的特征性菌群为韦荣氏球菌属、嗜血杆菌属。种水平上健康对照组受试者的特征性菌群为青春双歧杆菌、嗜黏蛋白阿克曼菌、普拉梭菌;肝郁脾虚证组患者的特征性菌群为胶黏罗斯菌、黏膜乳杆菌、咽峡炎链球菌;湿热内蕴证组患者的特征性菌群为脆弱拟杆菌、殊异韦荣球菌、副流感嗜血菌。从以上结果可以看出LC患者肠道菌群的种类发生了特异性变化,且LC不同中医证型的核心微生物具有明显差别和联系。进一步的相关性分析结果发现殊异韦荣球菌与ALT、AST、TBil、PT及LC预后指标MELD、CTP呈显著正相关,与青春双岐杆菌呈显著负相关。殊异韦荣氏球菌寄生在人和动物的口腔、肠道和呼吸道中,有研究发现在炎症比较重的患者其表达明显上调[22]。青春双岐杆菌具有显著的抗炎特性,可改变肠道微生物群落[23]。因此殊异韦荣球菌可能在LC中医证型演变及病情发展中扮演了重要的角色,而调节青春双歧杆菌的含量可有效控制疾病的进展。本研究发现嗜粘蛋白阿克曼菌与LC预后指标LSM、MELD呈负相关。普拉梭菌与狄氏副拟杆菌呈显著正相关,与ETX呈负相关。肠道中嗜粘蛋白阿克曼菌的定植情况是机体健康水平的标志之一,其依附肠道黏膜而生,可调节肠道内黏液厚度和维持肠道屏障完整性[24]。因此肠道屏障的完整性在LC的发生发展中极其关键。普拉梭菌是存在于健康人群肠道中最丰富的的肠道微生物之一,具有抗炎及抑制致病菌的作用[25]。狄氏副拟杆菌具有广泛的胆酸转化功能,在糖脂代谢方面发挥正向调节作用[26]。因此狄氏副拟杆菌协助普拉梭菌对于抑制LC患者的肠道菌群移位具有重要的调节作用。
为了明确导致肝郁脾虚证和湿热内蕴证患者间肠道群落变异的主要影响因子,本研究对两种中医证型间的环境因子做了RDA分析,结果发现TBil对两种证型间群落变异的影响最具有显著性。血清胆红素数值与LC的预后独立相关[27],与LSM指数及患者肝损伤程度具有较大的相关性[28,29]。有研究发现TBil可改变肠道内环境,使机体原籍优势菌的种类减少,诱发菌群失调[30]。《金匮要略》曰:“然黄家所得,从湿得之”,表明湿邪内蕴为黄疸发病的关键。现代医家多认为黄疸以湿热多见,其发病规律为肝木湿陷,遏生发而克脾土,脾虚基础上的湿热壅盛合而致疸[31,32]。肝是黄疸之关键病位,热为黄疸主要病性证素[33]。因此从肝郁脾虚证到湿热内蕴证的转化过程中,TBil是肝硬化疾病进展的主要因素,也是肠道群落变异的主要驱动因子。
综上所述,LC患者从肝郁脾虚证到湿热内蕴证的演变过程中,病情持续发展,肠屏障功能受损趋于严重,殊异韦荣球菌可能在中医证型演变及病情发展中扮演了重要的角色,而调节青春双歧杆菌的含量可有效控制疾病的进展,狄氏副拟杆菌协助普拉梭菌对于抑制肠道菌群移位具有重要的调节作用。TBil是两种中医证型患者间肠道群落变异的主要驱动因子。但由于本研究存在样本量较小、分组不均衡等问题,后续研究需要进一步完善。

