金银花绿原酸提取方法研究
李 辉 ,逯桃桃 ,陈 佳 ,赵 亮 ,邱洪灯
(1. 中国科学院 兰州化学物理研究所,甘肃 兰州 730000;2. 兰州城市学院,甘肃 兰州 730070;3. 中国科学院大学,北京 100049)
金银花(别名:子风藤),忍冬科忍冬属多年生半常绿缠绕灌木,味甘、性寒,广泛分布于山东、陕西、河南、湖北及江西等地,具有清热解毒、疏风散热之功效[1]. 研究发现金银花的活性成分主要为有机酸、黄酮、三萜及挥发油等[2-4],其中绿原酸、木犀草苷生物活性显著[5],对金黄葡萄球菌及上呼吸道感染致病病毒等有较强的抑制力[6-7]. 因此,为了开发利用金银花,其有机酸类活性成分的分离纯化一直是金银花高值化利用的重要依据[8].
绿原酸是由咖啡酸与奎尼酸生成的缩酚酸[9-10],含有一定量R-OH基,能形成具有抗氧化作用的氢自由基,以消除羟基自由基和超氧阴离子等自由基的活性,从而保护组织免受氧化作用的损害,同时有消炎、降血脂及增强免疫调节等多药理作用[11-12],且绿原酸在医药保健、日用化工及食品等行业应用广泛[13-14]. 目前绿原酸提取方法众多,与其他方法相比,热回流法因提取高效、操作简单、设备要求低且提取率高于煎煮法等优势而广泛应用[15-16].鉴于此,本文优化了热回流法提取金银花绿原酸,考察乙醇体积分数、料液比、温度及提取时间等对提取率的影响,采用正交试验分析最优提取参数.
1 试验部分
1. 1 仪器与试剂
液相色谱仪为Waters 2487(双波长紫外检测器+waters1525泵),N-3000色谱工作站(浙江大学),DF-101S搅拌器(郑州长城科工贸有限公司),MH-5000调温电热套(西安常仪仪器设备有限公司),R-1001VN旋转蒸发仪(郑州长城科工贸有限公司),TG16-WS型高速离心机(湖南湘仪实验室仪器开发有限公司),FA1004电子秤(上海良平仪器仪表有限公司).
金银花为市售,甲醇(迈瑞达,色谱纯),磷酸(科密欧,≥85.0%),绿原酸(麦克林,纯度99.6%),无水乙醇(天津大茂,99.7%),去离子水(摩尔1010a 30L/H型).
1. 2 试验方法
1. 2. 1 液相色谱条件
色谱柱:Hibar ® C18 (250 mm×4.6 mm, 5 µm),流动相条件为0.4%磷酸溶液∶乙腈(体积比为87∶13),流速1.0 mL/min,检测波长为327 nm,进样体积10 mL,柱温为25 ℃.
1. 2. 2 绿原酸标准曲线制备
准确称取0.10 g绿原酸标准品,采用80%乙醇溶液溶解后移至100 mL容量瓶中摇匀、定容,制得1.0 mg/mL绿原酸标准对照品溶液. 吸取不同体积标准溶液配制一定浓度绿原酸标准液,采用“1. 2. 1”条件测定吸光度峰面积,绘制标准曲线.
1. 2. 3 提取率计算公式
绿原酸检测波长依据《中华人民共和国药典》(2005版第一部),“金银花”项下绿原酸检测波长为327 nm. 因此在327 nm测定绿原酸吸光度,以吸光度作纵坐标,质量浓度为横坐标绘制标准曲线.其中金银花中绿原酸提取率公式为:
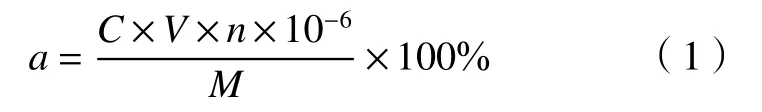
式中,a为金银花绿原酸提取率,C为绿原酸提取液稀释后浓度,V为提取液的体积(mL),n为稀释倍数,M为金银花质量(g)[17-20].
1. 2. 4 提取条件
本方法采用热回流法提取,提取流程为:金银花→干燥→粉碎处理→过178 µm筛→热回流法提取→过滤→8 000 r/min离心5 min→绿原酸提液合并定容→稀释→测定. 依照此步骤对金银花中绿原酸进行热回流提取,并对绿原酸标准品和金银花提取液进行高效液相色谱法测定(如图1所示).
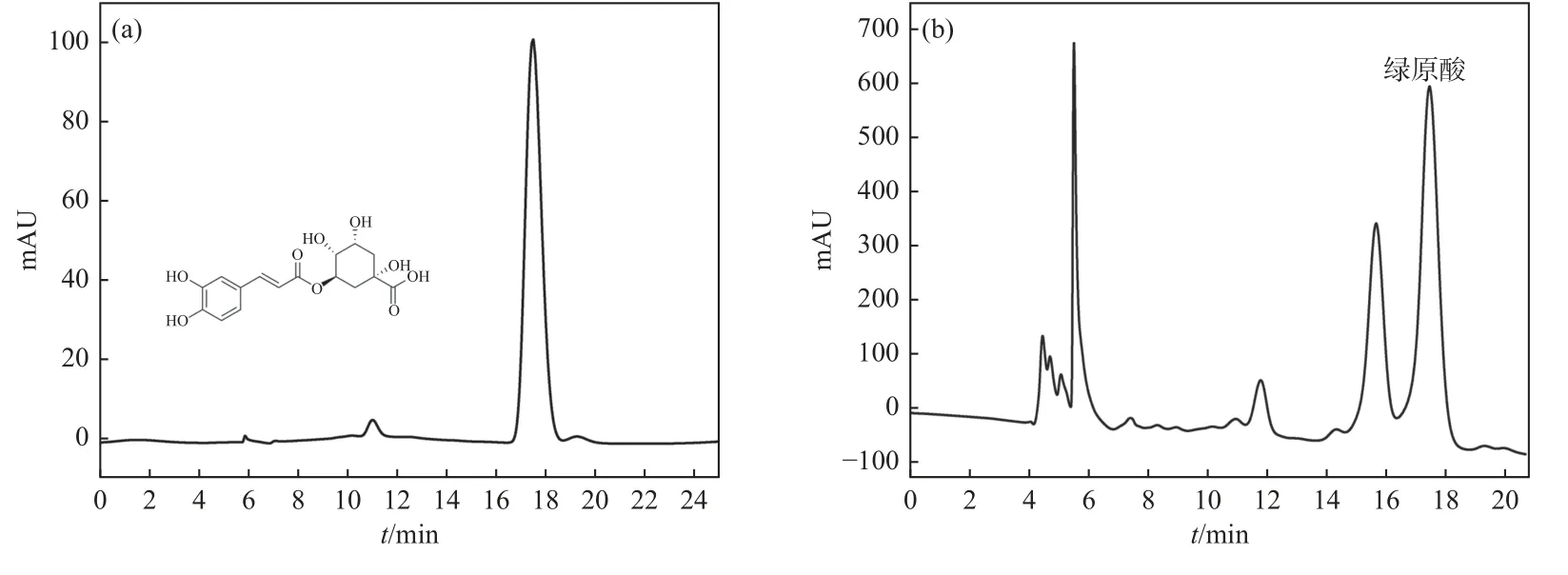
图1 (a)绿原酸和(b)金银花提取液HPLC色谱图Fig. 1 HPLC chromatograms of (a) chlorogenic acid and (b) honeysuckle extract
1. 2. 5 单因素试验
采用热回流法提取金银花绿原酸,考察乙醇体积分数(0、20%、40%、60%、80%、100%)、料液比(1∶5、1∶10、1∶15、1∶20、1∶25,g/mL)、提取时间(0.5、1.0、1.5、2.0、2.5 h)、提取温度(25、40、60、80、100 ℃)等因素对绿原酸提取率的影响.
1. 2. 6 正交试验
在单因素试验的基础上,设计L9(34)正交试验,以金银花绿原酸的提取率为检测指标,正交试验因素与水平如表1所列.

表1 正交试验因素与水平Table 1 Orthogonal test factors and levels
2 结果与讨论
2. 1 绿原酸标准曲线
准确量取标准品溶液1.0~9.0 mL转移至10.0 mL容量瓶中摇匀、定容,配制0.1~1.0 mg/mL的标准溶液,备用待测. 分别吸取上述不同浓度对照品溶液10 µL测样,以吸光度值为纵坐标,质量浓度为横坐标. 试验结果表明:绿原酸吸光度值与质量浓度满足Y=1.83×107C+495 058,r为0.999,R2为0.998,说明在0.1~1.0 mg/mL范围内线性关系良好(如图2所示).
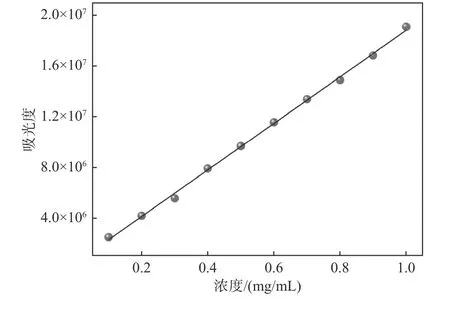
图2 绿原酸标准曲线Fig. 2 Standard curve of chlorogenic acid
2. 2 单因素考察
2. 2. 1 不同乙醇体积分数对绿原酸提取率影响
设定提取温度100 ℃,提取时间2 h,料液比1∶20,考察纯水和乙醇体积分数分别为20%、40%、60%、80%和100%时对金银花绿原酸提取率的影响(如图3所示). 试验发现乙醇体积分数在0~80%范围内,绿原酸提取率随乙醇体积分数增加而增大.当乙醇溶液体积分数为80%时,绿原酸的提取率最高,进一步增加乙醇体积分数,提取率反而降低,可能是金银花中的一些脂溶性成分溶出,导致提取率下降. 故选乙醇体积分数60%、80%、100%进行正交试验.

图3 不同乙醇体积分数对提取率影响Fig. 3 Effect of ethanol volume fraction on extraction yield
2. 2. 2 提取温度对绿原酸提取率影响
设定乙醇体积分数80%,提取时间2 h,料液比1∶20,考察提取温度25、40、60、80、100 ℃对金银花绿原酸提取率的影响(如图4所示). 试验发现在25~100 ℃范围内,绿原酸提取率随温度升高而增大,可能因温度升高,细胞壁破裂加快,绿原酸溶解或扩散到溶剂中的速度加快,提取率增大. 当温度升高至100 ℃时,绿原酸的提取率最高,故选60、80、100 ℃进行正交试验.

图4 提取温度对提取率影响Fig. 4 Effect of extraction temperature on extraction yield
2. 2. 3 提取时间对绿原酸提取率影响
设定乙醇体积分数80%,提取温度100 ℃,料液比1∶20,考察提取时间0.5、1.0、1.5、2.0、2.5 h对金银花绿原酸提取率的影响(如图5所示). 试验发现在0.5~1.5 h提取时间内,绿原酸提取率随时间增加而增大,当提取时间为2 h时,提取率达到最大,进一步增加时间提取率反而下降,可能长时间使得细胞壁中杂质溶出而提取率降低,故选择1.5、2.0、2.5 h进行正交试验.

图5 提取时间对提取率影响Fig. 5 Effect of extraction time on extraction yield
2. 2. 4 料液比对绿原酸提取率影响
设定乙醇体积分数80%,提取温度100 ℃,提取时间2 h,考察料液比1∶5、1∶10、1∶15、1∶20、1∶25对金银花绿原酸提取率的影响(如图6所示).试验发现绿原酸提取率随料液比增加而增大. 当料液比1∶20时提取率达到最大,进一步增加料液比提取率反而下降,可能由于糖类物质溶出而下降,故选择1∶5、1∶20及1∶25进行正交试验.

图6 料液比对提取率影响Fig. 6 Effect of solid-liquid ratio on extraction yield
2. 3 正交试验
在上述单因素考察基础上,设计L9(34)正交试验,以绿原酸提取率为检测指标,正交试验结果如表2所列. 由试验数据可知,金银花中绿原酸最佳提取条件为A2B3C2D2,其中ki为i水平数据的综合平均,R为极差. 由极差分析可知,4种因素对提取率影响强度依次为提取温度、乙醇体积分数、料液比、提取时间. 根据正交试验结果,最佳提取条件为乙醇体积分数80%、提取温度100℃、提取溶剂pH为6,提取时间2 h,料液比为1∶20.

表2 正交试验结果Table 2 Results of orthogonal test
3 结论
本文提供的热回流法提取具有操作方法简便、设备要求低、效率高等优势,可为富含绿原酸的植物高值化利用提供有效手段. 本研究以乙醇-水溶液为提取试剂考察绿原酸最佳提取条件,结合单因素考察和正交试验结果,优化金银花绿原酸提取最佳条件,并确定其提取参数,提高了绿原酸的收率,可为规模化生产及综合利用提供理论依据.

