运用PCR定量分析植物蛋白饮料中杏仁源性成分的研究
庞 婕,胥小荣,孔庆岩,刘 杰
(承德市食品药品检验检测中心,河北承德 067000)
承德处在燕山山脉,盛产杏仁,承德杏仁颗粒饱满,肉厚而细,以此杏仁为原料,加入水、白糖等以特有工艺制作承德杏仁露,不仅香味独特,功效也较多。杏仁里含有黄酮及多酚类物质,该物质能够降低人体内胆固醇的含量[1],因此杏仁露深受中老年人的喜爱。杏仁露中蛋白质、多种维生素及微量元素等含量比较高,具有一定的保健功能[2]。随着人们生活水平的提高,杏仁露也受到越来越多人的喜爱和关注,然而部分不法商贩为了牟取暴利在食品中掺杂掺假,因此建立准确、有效的杏仁源性成分的定量检测方法意义重大。
目前,PCR 定量方法是根据样品最终扩增产物进行定量分析,通常用凝胶电泳法进行分离,并用荧光染色来检测。但在PCR 反应中,由于反应体系和反应条件等因素会影响PCR 反应效率,甚至出现一些非特异性扩增产物,用终点法来衡量源性成分含量不够精确。实时荧光定量PCR 是指在PCR 反应体系中加入荧光基团,利用荧光信号的积累对整个PCR 进程进行实时检测,在PCR 反应过程中,随着循环数的增加,PCR 产物量增加[3]。相应的荧光信号强度也跟着增强,同时不断地收集荧光信号。随着反应的进行,根据检测到的荧光信号可以得到一条以循环数(Cycle Threshold,Ct)为横坐标和荧光强度(△Rn)变化为纵坐标的“S”形荧光扩增曲线[4]。
1 材料与方法
1.1 材料与试剂
1.1.1 样品来源
纯杏仁,购自承德市宽广超市;10 个不同品牌的杏仁露,分别购自承德市八县三区,每个品牌购买一个批次。
1.1.2 试剂
植物基因组DNA 提取试剂盒,广州双螺旋基因技术有限公司;杏仁原性成分核酸检测试剂盒(PCR荧光探针法),广州双螺旋基因技术有限公司。
1.2 仪器与设备
实时荧光定量PCR 仪-CFX96,美国伯乐;离心机- FC5714,德国OHAUS;涡旋混匀仪-HY-2,上海仪电科学仪器股份有限公司;荣冠(HH)数显恒温水浴锅,常州赛普实验仪器厂;Eppendorf(D30)核酸蛋白测定仪,艾本德。
1.3 试验方法
1.3.1 样品制备
将杏仁置于干燥箱中80 ℃,4 h 烘干后,用液氮或研磨仪匀浆后制成细小的粉末状。加水制成杏仁溶液。进行稀释,得到10 mg·L-1、20 mg·L-1、30 mg·L-1、40 mg·L-1、50 mg·L-1、60 mg·L-1、70 mg·L-1、80 mg·L-1、90 mg·L-1及100 mg·L-1的溶液。此样品用作后续实验的标准品;杏仁露进行均质后分装于玻璃容器内。
1.3.2 DNA 提取
①转移100 µL 样品至2.0 mL 离心管中,加入1 200 μL Buffer ATL 和5 μL RNase A,涡旋使样品充分分散。65 ℃处理10 min,期间涡旋混匀1 次。②加入420 μL Buffer PS 至样品中,涡旋20 s 混匀。冰上放置10 min。10 000 r·min-1离心5 min。③小心转移600 μL 上清液至新的离心管中,加入900 μL Buffer PBD(已加乙醇)至样品中,涡旋混匀20 s。④把DNA 结合柱装于2 mL 收集管中。转移混合液至柱子中,10 000 r·min-1离心30~60 s。⑤倒弃滤液把柱子装回收集管,将剩余液体转移至柱子中,10 000 r·min-1离心30~60 s。⑥倒弃滤液把柱子装回收集管。加入600 μL Buffer GW2(已用乙醇稀释)至柱子中,10 000 r·min-1离心60 s。⑦倒弃滤液把柱子装回收集管。10 000 r·min-1离心2 min 去除柱子中残留的乙醇。⑧将柱子转移至新的1.5 mL 离心管中。加入30~50 μL 预热到65 ℃的Buffer AE 至柱子的膜中央,65 ℃静置2 min。10 000 r·min-1离心2 min。⑨重复步骤8 的洗脱操作。丢弃DNA 结合柱,DNA 保存于-20 ℃或-80 ℃[5]。
1.3.3 特异性引物和探针
参照国家市场监督管理总局发布的“食品补充检验方法”,杏仁源和真核生物18sRNA 内参照检测用引物和探针如表1所示[6]。

表1 引物和探针序列
1.3.4 反应程序
将购买的商品化试剂盒放置在室温待解冻后,1 000 r·min-1离心30 s 后揭开封口膜,向每管反应液中分别加入4 µL 模板,顺序为空白、阴性对照、待测样品模板、阳性对照。盖好配套的PCR 管盖后,涡旋混匀30 s,离心1 min,立即进行PCR 扩增反应。扩增反应条件为①去污染:37 ℃,10 min,一个循环。②预变性:95 ℃,5 min,一个循环。③扩增:95 ℃,15 s;60 ℃,60 s。40个循环。在60 ℃时收集荧光信号,荧光基团选择FAM,淬灭基团选择NONE。扩增曲线如图1所示。

图1 扩增曲线图
1.4 Ct 值与DNA 浓度的关系
利用已知质量浓度的标准品可作出标准曲线,因此只要获得未知样品的Ct 值,即可从标准曲线上计算出该样品的DNA 浓度。对标准品进行稀释,选择10 个稀释度为模板进行实时荧光PCR 扩增,制作Ct 值与标准品浓度的标准曲线。
1.5 杏仁质量浓度与DNA 浓度的关系
对10 个稀释度的标准品分别进行DNA 提取,之后用核酸蛋白测定仪对所提取的DNA 进行测定,记录每个稀释度测定的DNA 浓度。每个梯度实验进行3 次重复。
1.6 样品检验
待测样品进行DNA 提取后,进行PCR 扩增,得到扩增的Ct值,通过Ct值与DNA浓度的线性关系,求出样品的DNA 浓度,再根据样品的DNA 浓度求出样品质量浓度。
2 结果与分析
2.1 Ct 值与DNA 浓度的实验结果
Ct 与DNA 浓度呈线性关系,DNA 浓度越高,只需要比较少的循环数就可以使扩增产物达到阈值,这样Ct 值就比较小。相反,DNA 浓度越小,就需要较多的循环数才能使扩增产物达到阈值,这样Ct 值就较大。根据实验测得的10 个稀释度的标准品的Ct值和DNA 浓度关系如图2所示。
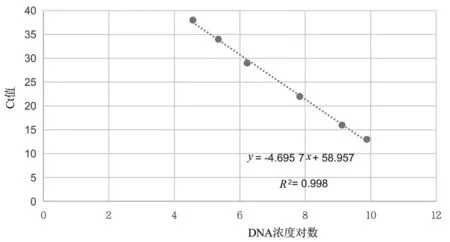
图2 Ct 与DNA 浓度呈线性关系
2.2 杏仁质量浓度与DNA 浓度的实验结果
对样品制备中10 个稀释度的标准模板按照1.3.2的方法进行DNA 提取,之后用核酸蛋白测定仪对所提取的DNA 进行测定,记录每个样品的DNA 浓度。每个浓度实验进行3 次重复实验,并对实验结果进行线性拟合,根据实验结果生成相关系数曲线,见图3,杏仁的相关性系数R2为0.997。
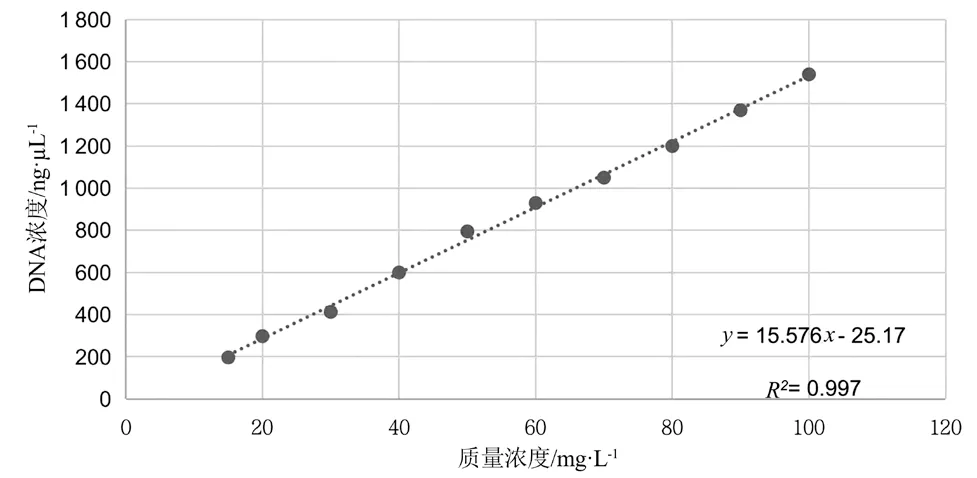
图3 杏仁质量浓度与DNA 浓度关系
2.3 方法验证实验结果
取3 个已知质量浓度的样品,提取DNA 后,取4 µL 进行荧光定量PCR 反应,进行重复测定,将实验结果带入本研究建立的计算公式中进行计算。结果显示,测得值与标准值的相对误差较小,在方法学范围内,最大相对误差为9.12,见表2。通过对已知DNA 浓度样品的检测,说明该方法可以用于杏仁制品的检测。

表2 已知样品检测结果
2.4 方法与实际应用
利用所建立的方法对所采购的10 个不同品牌的杏仁露进行检测分析,样品进行平行实验,实验结果取平均值。测得10 个样品中有2 个样品杏仁质量浓度低于5%,1 个样品杏仁质量浓度为0,其余均为20%以上。结果说明目前市面上销售的杏仁露确实存在掺假售假的情况。
2.5 注意事项
由于实时荧光检验过程中灵敏度较高,实验操作过程要求很高,且实验花费也高,为了得到更加准确的结果,严格按照相应标准要求进行,注重实验细节。①荧光定量PCR 检测灵敏度高,为了防止交叉污染,实验操作场地要进行合理分区,一般分为第一区:试剂准备区;第二区:样本制备区;第三区:扩增及产物分析区,并按要求设置正负压。②在实验过程中,不同的实验分区要穿戴好专用的无菌服和一次性乳胶手套,不同的分区要使用专用的移液器等实验仪器和设备。③实验过程中,试剂要放置于冰盒上,避免强光照射,防止荧光淬灭。④所有试剂要加到反应管底部,尽量不要沾到管壁上,反应体系配制完毕后要低速离心数秒,避免产生气泡。⑤在操作过程中,尽量不要在PCR 反应管上做任何标记,不要用手碰到PCR 反应管上部的采光部分,以免影响实验结果。⑥结束实验后,实验中用到的相应设备,只要不怕水和腐蚀的,都用有效氯消毒液进行浸泡或擦拭,最后用清水洗净或擦净的方法来清洁,操作台要进行紫外线照射。
3 结论
本研究采用实时荧光定量PCR 方法探索杏仁露中杏仁的定量方法,通过建立DNA 浓度和Ct 值、杏仁质量浓度和DNA 浓度之间的线性关系,就可以根据未知样品的Ct 值计算出未知样品中杏仁的质量浓度,建立杏仁源性成分的定量方法。该方法能检测杏仁露中的微量带入或故意掺假问题,为常规化源性成分检测提供新的思路。同时,其他源性成分的检测也可以参照此方法,为其他植物蛋白饮料的日常检验提供了有利的科学依据。实时荧光定量PCR 具有特异性强,灵敏度高的优点。其相对于传统PCR 来说更无需进行后续的凝胶电泳实验,缩短实验时间,提高实验效率。但荧光定量PCR 也存在很多不足之处。①用来定量的标准曲线,需要自己制备,各个实验室所用的标准品没有统一的标准,所以每个实验室制作的标准曲线区别较大,缺少可比较性。②由于实验操作的要求,对实验场地要求很高,同时实验过程中需要消耗大量一次性耗材,这就导致了实时荧光定量PCR 实验成本的提高。

