线粒体自噬与神经退行性疾病的关系及针灸调控机制探讨*
张 利,袁懿芸,吴长乐,王 强,王 渊,邢文文,乔海法,杨晓航,刘 奇**
(1.陕西中医药大学针灸推拿学院 西安 712046;2.陕西中医药大学基础医学院 西安 712046)
线粒体作为能量代谢的核心功能器,是细胞进行有氧呼吸、氧化磷酸化等过程的重要场所,细胞的分化、增殖、自噬、凋亡等生理过程都离不开线粒体的参与。线粒体自噬[1]是细胞通过自噬机制选择性包裹和降解细胞内受损的线粒体从而将其清除的过程,是调节线粒体质量和数量稳态,维持线粒体正常功能的重要环节。线粒体异常与多种神经退行性疾病[2]的发生密切相关。大量研究表明,多种自噬相关基因突变、相关蛋白表达异常导致的线粒体自噬功能异常可能会引发阿尔兹海默病、帕金森病等神经退行性疾病并参与其病程发展[3-4]。长久以来针灸在临床各科治疗中疗效显著,在国内外获得广泛应用,神经退行性疾病[5]、镇痛[6]以及脑血管疾病[7]的针灸防治机制,一直都是中医针灸领域关注的热点,也是国家自然科学基金在针灸领域资助的高频研究方向,同时也是我们团队近20年聚焦的主要研究方向之一[8-12]。随着针灸基础研究的不断深入,对线粒体的调控(保护)已成为针灸防治神经退行性疾病的重要机制之一[13],鉴于此,笔者围绕“自噬”这一影响线粒体功能的重要生理过程,试图探讨针灸调控线粒体自噬防治神经退行性疾病的可能机制,以丰富针灸调控能量代谢防治神经退行性疾病机制的内涵。
1 线粒体自噬
线粒体自噬是一种选择线粒体作为降解底物的自噬,属于巨自噬范畴。线粒体损伤后发生去极化,线粒体自噬相关蛋白被激活,损伤或多余的线粒体被自噬小体特异性的包裹,随后与溶酶体融合,最终在溶酶体酶的作用下被降解,以维持细胞内线粒体数量和质量的稳定,保持细胞内环境稳定。目前哺乳动物中线粒体自噬的经典通路主要为PTEN诱导激酶1(PTEN-induced kinase 1,PINK1)/E3泛 素 连 接 酶Parkin途径和受体介导途径。
1.1 PINK1/Parkin途径
线粒体损伤,其跨膜电位不能保持,导致线粒体外膜转运酶及内膜转运酶不能正常将PINK1转运至线粒体内膜,造成线粒体外膜上PINK1堆积。PINK1主要通过介导Parkin的抑制成分REP和N端泛素样结构域的构象变化或通过介导泛素磷酸化,然后与Parkin结合改变Parkin的构象两种途径激活Parkin[14]。被PINK1激活后的Parkin可将被活化的泛素转移至线粒体外膜,泛素链在线粒体外膜表面聚集,与膜表面蛋白结合,包围线粒体,使线粒体泛素化,同时自噬受体被泛素链募集至线粒体外膜,形成自噬小体,自噬小体与溶酶体融合,在溶酶体酶的作用下被降解[15]。
1.2 受体介导途径
类NIP3蛋白X(NIP3-like protein X,Nix)/BNIP3是定位于线粒体外膜的两种具有促凋亡活性的腺病毒相互作用蛋白[16],主要介导缺氧损伤条件下的线粒体自噬,缺氧条件下可以通过抑制NIX有效保存线粒体完整,抑制线粒体自噬[17]。缺氧时,细胞内活性氧生成增多,低氧诱导因子1(hypoxia-inducible factor 1,HIF-1)与NIX/BNIP3结合,提高其表达水平,促进线粒体自噬。FUNDC1(FUN14 domain containing 1,FUNDC1)是一种在缺氧和饥饿条件下诱导哺乳动物细胞线粒体自噬的线粒体外膜蛋白,生理状态下以磷酸化的形式存在,在缺氧条件下或线粒体解偶联时,FUNDC1与微管相关蛋白1轻链3(microtubuleassociated protein 1 light chain 3,LC3)相互作用区LIR序列中的Tyr18磷酸化水平较常氧条件下降低,FUNDC1发生去磷酸化,增强了其与LC3的相互作用,激活线粒体自噬[18]。
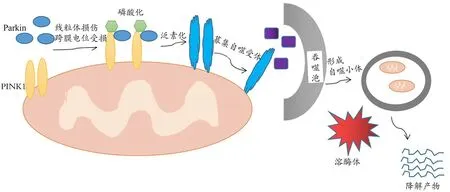
图1 PINK1/parkin途径
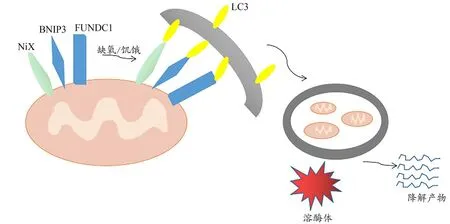
图2 受体介导途径
1.3 线粒体自噬形态学分型
学者将线粒体自噬分为3种亚型,通过对诱导发生自噬的哺乳动物细胞标本进行观察分析[19],从形态学上对这3种亚型进行了阐述:Ⅰ型线粒体自噬,其自噬小体是吞噬泡从内质网-线粒体接触位点开始逐渐包裹线粒体即由内质网包裹线粒体形成的;Ⅱ型线粒体自噬是通过损伤线粒体周围的游离膜逐渐融合包被线粒体形成自噬小体结构;Ⅲ型线粒体自噬是损伤线粒体内部出现的膜包裹线粒体部分组件形成线粒体小囊泡,然后线粒体小囊泡以出芽的方式排出线粒体。线粒体通过自噬的方式针对性的将细胞内受损或多余的线粒体清除,是维持线粒体和细胞正常功能、保持细胞内环境稳定的重要途经。线粒体自噬障碍和过度自噬都会破坏线粒体和细胞功能的正常运行,从而引发包括神经退行性疾病在内的多种疾病。
2 线粒体自噬与神经退行性疾病
神经退行性疾病是神经元结构和功能的逐渐丧失、错误折叠蛋白聚集从而导致功能障碍的一类疾病,存在于神经元胞质中的线粒体是神经元的氧化供能中心,为细胞活动提供能量,线粒体自噬对于清除聚集的蛋白和功能障碍的细胞器至关重要,自噬和自噬通路的良好调节对中枢神经系统的发育、健康和功能至关重要。越来越多的证据表明,线粒体自噬异常会导致阿尔兹海默病(Alzheimer's disease,AD)、帕金森 氏 病(Parkinson's disease,PD)、亨 廷 顿 氏 病(Huntington's disease,HD)、肌萎缩性侧索硬化症(Amyotrophic Lateral Sclerosis,ALS)等神经退行性疾病[20-22]。在AD、PD、HD、ALS中也都检测到线粒体自噬障碍[23]。
2.1 线粒体自噬与AD
AD是一种以缓慢进行性记忆力衰退、认知能力障碍及行为异常为主要临床表现的神经系统退行性病变。AD的发生与基因、代谢、年龄、环境等多种因素相关[24],但发病机制尚未完全明确,诸多研究表明,β淀粉样蛋白(β-amyloid protein,Aβ)沉积、线粒体异常与Tau蛋白过度磷酸化是AD的主要病理特征。此前多项研究发现了AD的线粒体自噬障碍[25-26]。低氧状态下,呼吸链末端的电子受体氧分子供应不足,从而生成过多的活性氧(reactive oxygen species,ROS),使细胞内多种成分发生氧化损伤,出现氧化应激反应,诱导线粒体自噬水平增高,调节抗氧化能力,可见线粒体自噬能够与氧化应激反应相互作用,以维持细胞内氧化还原的稳态[27]。线粒体功能出现障碍会引起细胞内ATP供应不足和ROS释放增多,从而造成神经元损伤。这些功能出现障碍的线粒体通过线粒体自噬得以降解,维持了线粒体质量和数量的相对稳定[28]。在AD发生过程中,沉积的Aβ可通过损伤电子传递链、与线粒体动力相关蛋白相互作用、促使ROS过度生成、影响线粒自噬等途径造成线粒体损伤,加剧AD的发生发展[29]。病理性的Tau蛋白可损伤线粒体引起线粒体功能障碍,抑制线粒体自噬[30]。AD患者脑细胞中,线粒体自噬过程受损,加速了疾病进程。PINK1是细胞内一种主要存在于线粒体的外膜上的蛋白激酶,线粒体膜电位受损后,被PINK1识别并在其表面聚集,与Parkin以及泛素协同作用促进线粒体的泛素化以触发线粒体自噬。Parkin是一种主要存在于细胞质中的E3泛素连接酶,当线粒体受损功能异常时,Parkin从胞质中转移到线粒体内,促进线粒体蛋白底物泛素化,增强线粒体自噬信号,诱发线粒体自噬[31]。AD细胞模型的线粒体相关研究发现[32],模型细胞的线粒体形态明显改变,线粒体自噬增加,PINK1、Parkin表达增加,但在经过PINK1 siRNA处理后自噬较前减弱,结果表明AD细胞模型的这些改变可能通过PINK1、Parkin途径引起线粒体自噬增加。也有学者发现Parkin介导的线粒体自噬途径的活性在AD模型小鼠的突触线粒体中明显增强,线粒体自噬小体聚集增多[33]。由此可见PINK/Parkin途径介导的线粒体自噬在AD进程发挥着调节作用。此外,郑璐[34]发现AD转基因小鼠海马中,线粒体自噬增强。可见,AD的发生与线粒体自噬密切相关,线粒体自噬在一定程度上参与了AD病程发展,这也为AD的治疗提供了新的切入点。
2.2 线粒体自噬与PD
PD是一种常见的以中脑黑质致密部多巴胺能神经元选择性死亡为病理改变的神经退行性疾病,是中老年人群的多发病,其发病率仅次于AD。近年研究表明,PD的发生常与损伤线粒体未及时清除有关[35]。遗传因素也是PD发生的原因之一,全基因组关联研究的大规模荟萃分析,分析了1.9万多名帕金森病患者和超过10万名对照者的数据,在整个基因组中发现了24个与PD相关的基因位点,其中至少有11个基因参与破坏自噬溶酶体途径[36],阻碍细胞器和细胞内结构的正常更新。此外,PINK1、PARKIN蛋白、SNCA基因和α-突触核蛋白、LRRK2蛋白、GBA蛋白、ATP13A2等PD相关基因也在线粒体自噬的调节中起着作用,若这些蛋白的编码基因出现突变,则会致使粒体自噬功能障碍,诱发PD[37],同时,这些相关基因的研究也证实线粒体自噬障碍是PD发病的主要因素[38]。因此,部分调控线粒体自噬的基因或蛋白出现异常,可能会通过影响线粒体自噬而引发PD,维持线粒体自噬功能的正常对防治PD有不可或缺的作用。
2.3 线粒体自噬与其他神经退行性疾病
线粒体自噬在HD、ALS等其他神经退行性疾病的发病机制中同样参与重要环节。HD是一种遗传性的神经退行性疾病,患者染色体上的Huntington基因发生变异,产生的变异Huntington蛋白异常聚集,影响神经元的功能,最终导致神经元死亡。变异Huntington蛋白与自噬相关蛋白的相互作用使自噬途径遭到破坏[39],线粒体自噬受损,线粒体质量控制失衡,功能失调的线粒体无法被清除,神经元受到能量失衡的影响而出现功能障碍[40]。ALS是一种运动神经元损害的神经退行性疾病,其确切的发病机制尚未明确,研究者发现在散发性ALS患者神经元中出现线粒体肿胀和结构异常及神经元细胞内线粒体明显聚集[41]。错误折叠的超氧化物歧化酶1在线粒体膜表面聚集,引起线粒体损伤,出现线粒体肿胀,线粒体自噬障碍无法清除损伤及肿胀的线粒体[42]。
3 针灸调控线粒体自噬的可能机制
针灸对神经退行性疾病的临床防治效果已经得到大量证实,自古以来,阿尔兹海默病就受到各医家的关注,中医学将其称为“痴呆”、“愚痴”、“呆病”等,历代医家将其病机归结为:髓减脑消,神机失用。最新发布的《中国阿尔茨海默病患者诊疗现状调研报告》显示,AD的复诊率低下,虽然需终生用药已经被大部分受访患者认同,但因为药物的价格、疗效及副作用导致坚持服药的患者比率低下。针灸作为一种经济方便、副作用小的中医特色疗法,已经被大量文献[43-45]证明对AD临床疗效显著,且患者依从性较高,针刺可显著改善轻中度AD患者的认知功能障碍和精神行为现象[46],针刺结合药物对AD患者认知功能及日常生活能力的提高优于单纯西药治疗[47-48]。PD属中医“颤证”范畴,通常以药物治疗为首选,但药物治疗时间长,药物的疗效也会随用药时间的延长而逐渐降低。当前,针灸疗法对于帕金森症状的改善已经显露优势,研究显示,针灸疗法在改善帕金森患者的运动功能障碍方面,效果优于单纯药物组[49-50],可辅助改善PD患者的步调[51],肌僵直[52],且对PD伴随的认知功能障 碍[53]、吞 咽 障 碍[54]、焦 虑[55]、抑 郁[56]、睡 眠 障 碍[57]、便秘[58]等非运动症状疗效显著。ALS属中医“痿证”范畴,针药结合治疗ALS的有效率明显高于单纯药物治疗[59]。针刺配合中药也可改善HD患者的临床症状[60]。针灸在防治神经退行性疾病中效果显著,已被临床广泛使用,但其具体机制尚未明晰,当前,其线粒体自噬调控机制备受关注。针灸通过对线粒体自噬通路的调控,既可以上调低下的线粒体自噬水平,也可以抑制过度自噬,通过这种双向的良性调节对线粒体自噬水平进行调控[5],保证线粒体自噬功能的正常与稳定,对防治神经退行性疾病意义重大。
研究证实,针灸可以减少AD模型大鼠病理性Tua蛋白的表达,增加海马区LC3-Ⅱ的表达,降低自噬相关蛋白p62的表达,在一定程度上提高自噬水平,改善模型组大鼠海马区的自噬紊乱状态,减少Aβ42的异常沉积,提高其学习能力和记忆能力,表明针刺能通过调节与线粒体自噬有关的蛋白和AD相关病理蛋白的表达来起到防治AD的作用[61]。此外,针灸可以显著降低AD模型大鼠血清内Aβ水平和海马CA1区APP的表达水平,延缓AD病理进程[62];抑制AD大鼠海马线粒体亲环D蛋白的表达以及提高细胞色素氧化酶C的表达,有效减少线粒体损伤,防治AD的发生发展[63-64]。电针太冲、风府穴还能够上调PD模型大鼠Parkin蛋白和基因的表达水平,改善PD大鼠异常的行为学表现[65]。头穴透刺能明显提高PD模型大鼠线粒体复合物Ⅰ的活性,并使ATP酶的活性呈现升高趋势,升高并恢复膜电位,清除α-突触核蛋白的聚集,同时减少ROS及丙二醛,诱导氧化应激反应,提高抗氧化能力,进一步保护线粒体形态,维持其功能。在对模型组使用自噬诱导剂后PD大鼠的运动障碍得到改善,电针结合自噬诱导剂则改善效果更显著。然而使用自噬抑制剂的PD模型大鼠运动障碍加重,电针结合抑制剂则出现明显好转,表明头针透刺电针法可以调节线粒体自噬相关蛋白及氧化应激反应,保护线粒体形态结构,上调线粒体自噬水平,从而起到治疗PD的作用[66]。所以针灸防治神经退行性疾病效应的产生与调节线粒体自噬水平密切相关,针灸对线粒体自噬的调节机制很可能是通过调节线粒体自噬相关蛋白的表达,减少或清除异常聚集的相关病理蛋白、调控线粒体自噬影响因素,以保护线粒体结构而实现的。
4 小结
线粒体作为细胞内能量代谢的核心功能器,其形态、数量及质量正常是维持细胞正常生理活动的基础,线粒体自噬作为线粒体质量控制的主要机制之一,受到各种因素的影响,在神经退行性疾病的发生和发展过程中起着重要作用。随着对线粒体自噬研究的不断开展,研究线粒体自噬和神经退行性疾病的联系,将有助于为本病的防治提供新的突破口,对线粒体自噬的调控也成为了防治神经退行性疾病的一种新思路。针灸作为一种防治神经退行性疾病的有效手段,在线粒体结构保护、线粒体自噬通路调节等方面具有大量的实验室证据支持,是线粒体调控研究的重要方向之一。虽然当前线粒体自噬研究取得了一些进展,但具体机制仍不完全明确,例如线粒体自噬影响因素的工作机制,针灸调控线粒体自噬的具体通路,针灸保护线粒体调控能量代谢的核心机制等等,还需要进一步系统深入研究。
4刘慧,张自弘,鲍秀琦,等.线粒体动力学和线粒体自噬的分子机制及其在神经退行性疾病中的作用.中国药学杂志,2020,55(5):337-341.
9卢圣锋,邵欣,唐勇,等.电针促进阿尔茨海默病模型小鼠(SAMP8)海马神经元突触可塑性的神经细胞黏附机制.中国康复医学杂志,2008,23(12):1057-1060.

