基于指纹图谱和网络药理学的芍药甘草汤抗肝损伤活性成分及含量测定研究*
王迎春,马永犇,甄亚钦,王 梦,田 伟,王凯歌,吴玲芳**,牛丽颖**
(1.河北中医学院药学院 石家庄 050091;2.河北省中药配方颗粒技术创新中心 石家庄 050091;3.中药材品质评价与标准化河北省工程研究中心 石家庄 050091)
肝脏是人体新陈代谢和解毒的重要器官,容易受各种化学物质影响导致肝损伤。目前全球肝损伤人群数量不断攀升,长期肝损伤会演化成肝硬化、肝癌等疾病,严重威胁着人类的生命。目前市面上抗肝损伤的药物如多烯磷脂酰胆碱、还原型谷胱甘肽、甘草酸二铵、复方甘草酸苷、异甘草酸镁、双环醇和六味五灵片等均存在不同程度的副作用,从传统药物中寻找高效低毒的抗肝损伤药物,已经成为当前中医药工作者的重要任务[1]。
芍药甘草汤是医圣张仲景《伤寒论》中的名方,以芍药合甘草滋养阴血,通行经脉而治疗血虚身痛、脘腹气血不足之疼痛等症,且《伤寒论》中多个方剂均有芍药甘草配伍使用,如桂枝加芍药汤、桂枝新加汤、小建中汤等[2]。《医学正传》记载:“四时腹痛,芍药甘草汤主之。”《医宗必读》有云:“芍药甘草汤,一名戊己汤,治腹痛如神。芍药(四钱),甘草(二钱)。酸以收之,甘以缓之。”
芍药甘草汤中芍药酸寒,养血敛阴,柔肝止痛;甘草甘温,健脾益气,缓急止痛。二药相伍,酸甘化阴,调和肝脾,有柔筋止痛之效,因此芍药甘草汤药理作用研究也多集中在镇痛方面[3-6]。然本课题组前期研究发现芍药甘草汤有明显的保肝作用,芍药甘草汤连续灌胃14天后,给药组大鼠血清丙氨酸氨基转移酶(Alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(Aspartate aminotransferase,AST)、血清碱性磷酸酶(Alkaline phosphatase ALP)、总胆红素(Total bilirubin,TBIL)水平显著低于肝损伤模型组,肝脏组织病理学结构得到显著改善。宋军等[7]也发现芍药甘草汤的提取物芍甘多苷能减轻化学性和免疫性肝损伤,具有明显的保肝作用,可用于治疗慢性乙型肝炎,但芍药甘草汤抗肝损伤活性成分尚不明确,不利于其质量控制指标性成分的确立。
中药指纹图谱结合化学计量学研究,可以在整体观的基础上筛选出最能反映中药质量的标志性成分,已经大量用于中药质量控制指标性成分的确定[8]。网络药理学多基因、多靶点的特点与中医药多成分、多靶点的特点有异曲同工之妙,在中医药现代化研究中具有较高的应用价值[9-10]。本研究采用指纹图谱结合化学计量学,整合网络药理学研究结果,探索芍药甘草汤抗肝损伤活性的主要指标性成分。针对化合物的最大吸收波长,采用多波长切换方法对主要指标性成分进行含量测定,为基于药理活性的中药质控指标成分的选择提供一种新思路。
1 材料与方法
1.1 实验材料
Waters超高效液相色谱仪(美国Waters,ACQUITY H-Class系统,四元溶剂管理器(QSM)、自动进样器(SMFTN)、二极管阵列检测器(PDA)、高温柱温箱(CHA)),Waters ACQUITY UPLC BEH C18色谱柱(2.1 mm×100 mm,1.7µm,美国Waters),电子分析天平(型号:CPA225D、BSA224S-CW,北京赛多利斯)。
对照品:没食子酸(Gallic acid,GA,批号:110831-201605,纯度:91.5%)、甘草苷(Liquiritin,LQ,批号:111610-201607,95.01%)购自中国食品药品检定研究院;甘 草 酸(Glycyrrhizic acid,GCA,批 号:MUST-18060805,纯度≥98.01%)购自成都曼思特生物科技有限公司;甘草素(Liquiritigenin,LQG,批号:DST171014-010,纯度:99.65%)购自成都德思特生物技术有限公司;异甘草苷(Isoliquiritin,ILQ,批号:8101805,纯度度:98.76%)、苯甲酰芍药苷(Benzoylpaeoniflorin,BPA,批号:18020501,纯度≥98.0%)购自成都普菲德生物技术有限公司);芍药苷(Paeoniflorin,PA,批号:PS0220-0025MG,纯度≥98.0%)、芍药内酯苷(Albiflorin,AB,批号:PS1168-0025MG,纯度≥98.0%)、芹糖异甘草苷(Isoliquiritinapioside,ILQA,批号:PS2186-0020MG,纯度≥98.0%)购自成都普思生物科技股份有限公司。乙腈、乙酸为色谱纯(美国默克),水(屈臣氏),其他试剂均为分析纯。
白芍、甘草(炙)饮片由河北省药品检验院的孙宝惠老师鉴定,白芍为毛茛科植物芍药Paeonia lactifloraPall.的干燥根,甘草(炙)为豆科植物甘草Glycyrrhiza uralensisFisch.的干燥根及根茎。样品统一存放于河北中医学院中药配方颗粒工程技术研究中心。15批芍药甘草汤编号为S1~S15,具体药材产地及批号信息见表1。

表1 药材产地信息
1.2 方法
1.2.1色谱条件
二元溶剂洗脱:A:乙腈,B:0.1%乙酸水,梯度洗脱(0-3 min,5-15%A;3-5 min,15-18%A;5~10 min,18-24% A;10~14 min,24-26% A;14-25 min,26-45% A;25-29 min,45-100% A;29-30 min,100-5% A;30-35 min,5%A);体积流量0.3 mL·min-1;柱温35℃;采用切换波长方法对不同化学成分峰面积进行采集,检测波长:237 nm(芍药内酯苷、芍药苷、苯甲酰芍药苷、甘草酸),270 nm(没食子酸、甘草苷、甘草素),370 nm(芹糖异甘草苷、异甘草苷、新异甘草苷);进样量为4.0µL。
1.2.2供试品溶液的制备
《伤寒论》记载:白芍药、甘草各四两(炙)。上二味,以水三升,煮取一升五合,去滓,分温再服。参考古代度量衡描述,按照汉代一两=3 g,一升=200 mL,一合=20 mL计算。取白芍和炙甘草各12 g(四两),加水600 mL(三升):煮至300 mL(一升五合),滤过(去滓),滤液冷却,浓缩至约50 mL(1 g∶2 mL)的浸膏,冷冻干燥,即得芍药甘草汤水煎液冻干粉,冻干粉平均得率为23%。精密称取芍药甘草汤冻干粉适量,50%甲醇溶解,并配制成4.00 mg·mL-1的溶液,摇匀,0.22µm滤膜滤过。
1.2.3对照品溶液的制备
精密称取GA、AB、PA、LQ、ILQA、ILQ、LQG、BPA和GCA对照品适量,用50%甲醇溶解,配制成质量浓度 分 别 为50.0、80.0、439.5、144.5、24.0、24.5、10.0、15.5、303.5 µg·mL-1的混合对照品溶液,置于4℃冰箱内保存,备用。
1.2.4指纹图谱方法学考察(1)精密度试验
精密称取样品(S1)0.1 g制备成供试品溶液,连续进样6次,选择色谱峰面积较大、含量较高且各批次均稳定出现的峰为参照峰,并计算各共有峰的相对保留时间(Rt)和相对峰面积的RSD值。
(2)稳定性试验
精密称取样品(S1)0.1 g制备成供试品溶液,分别于制备后的0、2、8、12、18、24 h进样,记录各峰的峰面积,以6号色谱峰为参照峰,计算各共有峰的Rt及相对峰面积的RSD值。
(3)重复性试验
精密称取样品(S1)6份,每份约0.1 g制备成供试品溶液,进样,记录各峰峰面积,以6号色谱峰为参照峰,计算各共有峰的Rt和相对峰面积的RSD值。
(4)指纹图谱建立及相似度评价
制备S1-S15供试品溶液,进样并记录样品信息。将样品信息导入“中药色谱指纹图谱相似度评价系统2012版”,建立芍药甘草汤指纹图谱并进行相似度评价分析。
(5)聚类分析
以15批样品的共有峰面积为变量,导入SPSS 26.0软件,对15批样品进行系统聚类。(6)主成分分析
以15批样品的共有峰面积为变量,导入SPSS 26.0软件,对15批样品进行主成分分析。
(7)正交偏最小二乘-判别分析
将15批样品的共有峰峰面积导入SIMCA-P 13.0软件,进行偏最小二乘判别分析。
1.2.5网络药理学及分子对接验证
(1)活性成分及靶点的筛选
基于可测性及可溯性的原则筛选活性成分,目前报道的芍药甘草汤活性成分主要为芍药苷、芍药内酯苷、苯甲酰芍药苷、芍药新苷、甘草酸、甘草素、甘草苷、异甘草苷和芹糖异甘草苷等,结合指纹图谱筛选出来的质量标志性成分,再结合化合物在单味药中的含量、研究热度等标准筛选芍药甘草汤中的活性成分。
基于TCMSP(http://lsp.nwu.edu.cn/index.Php)、Swiss Target Prediction(http://www.swisstargetprediction.ch/)、STITCH(http://stitch.embl.de/)数据库获得活性成分的潜在作用靶点。基于Genecards(https://www.genecards.org/)、OMIM(https://omim.org/search/advanced/geneMap)、OncoDB.HCC(http://oncodb.hcc.ibms.sinica.edu.tw/index.htm)和Liverome(http://liverome.kobic.re.kr/)数据库获得肝损伤相关靶点。通过R语言对化学成分的作用靶点与肝损伤相关靶点取交集,得到共有靶点。
(2)成分-靶点网络构建
将活性成分和共有靶点导入Cytoscape软件,构建“活性成分-靶点”可视化网络图。
(3)蛋白质-蛋白质相互作用的网络构建与关键靶点筛选
将共有靶点导入String(https://string-db.org/)数据库,限定物种为“人”,设置最低要求互动分数为0.8,构建蛋白相互作用关系,运用R软件计算排名前10的关键靶点。
(4)GO生物过程富集分析
通过DAVID数据库,以人类基因为背景,对交集靶点基因进行GO生物过程富集分析(P<0.01)。
(5)KEGG信号通路富集分析
通过DAVID数据库,以人类基因为背景,对交集靶点基因进行KEGG生物过程富集分析(P<0.01)。
(6)分子对接验证
使用Autodock Vina软件对代表性成分与关键靶点的相互作用进行分子对接计算,结果通过结合自由能来表示,结合能小于0,表明配体与受体可以自发结合,能量越低表明两者产生作用的可能性越大。一般认为,当结合能小于-5.0 kcal·mol-1时,化合物与靶点结合活性较佳。
1.2.6多成分含量测定
(1)线性关系考察
精密吸取“1.2.2”项下混合对照品溶液1、2、3、5、10 mL至10 mL量瓶中,加甲醇溶解至刻度,按“1.2.1”项下色谱条件进行测定,记录峰面积。以各对照品进样浓度对峰面积作图,进行回归分析。
(2)精密度试验
精密吸取混合对照品溶液,按“1.2.1”项下色谱条件,连续进样6次,测定峰面积并计算RSD值。
(3)稳定性试验
精密称取样品(S1)0.1 g制备成供试品溶液,按“1.2.1”项下色谱条件,分别于0、2、8、12、16、24 h进样分析,测定峰面积并计算RSD值。
(4)重复性试验
精密称取样品(S1)0.1 g,共6份,制备成供试品溶液,再按“1.2.1”项下色谱条件,测定峰面积,计算平均含量的RSD值。
(5)加样回收试验
分别称取已知含量的样品9份,每份约0.05 g,按照样品含量的50%、100%、150%加入各对照品,每个浓度3份,计算各成分的含量和平均加样回收率。
2 结果和分析
2.1 指纹图谱的方法学考察结果
2.1.1精密度试验
根据1.2.4中(1)的条件,仅有6号色谱峰能满足各项要求,因此以6号色谱峰为参照峰,各共有峰的Rt的RSD值在0.07-1.48%,相对峰面积的RSD值在0.89-2.78%,提示仪器精密度良好。
2.1.2稳定性试验
各共有峰的Rt的RSD值在0.07-1.97%,相对峰面积的RSD值在0.46-2.72%,提示样品溶液在24 h内稳定性良好。
2.1.3重复性试验
各共有峰的Rt的RSD值在0.08-1.55%,相对峰面积的RSD值在0.23-2.89%,提示方法重复性良好。
2.1.4指纹图谱建立及相似度评价
共标定17个共有峰,生成对照指纹图谱R,见图1。S1-S15与R相似度均在0.90以上,表明甘草、白芍两味药材虽然产地不同,但所含有的化学成分基本相似,同时表明所建立的指纹图谱质量稳定,可反映其指纹特征。

图1 S1-S15样品UPLC指纹图谱
2.2 聚类分析
采用SPSS 26.0数据分析软件,对15批样品的共有峰面积进行系统聚类,采用组间连接法,测量区间为平方欧氏距离,聚类结果见图2。当聚类距离在10-15之间时候,15批样品可分成3类,其中S1、S3、S9、S10、S12聚为一类,S6、S7、S8、S13聚为一类,S2、S4、S5、S11、S14、S15聚为一类。

图2 芍药甘草汤聚类分析图
2.3 主成分分析
以15批样品的17个共有峰面积为变量,导入SPSS 26.0软件,以特征值>1为提取标准,得到4个主成分,累计方差贡献率为89.421%,说明前4个成分可以反映芍药甘草汤指纹图谱中的大部分化学信息。各色谱峰系数反映了成分贡献率大小,排名前9的成分为别为峰10(ILQ A)、峰8(LQ)、峰11(ILQ)、峰6(PA)、峰14(BPA)、峰5(AB)、峰1(GA)、峰12、峰4。
2.4 正交偏最小二乘-判别分析
将15批样品中17个共有峰峰面积导入SIMCA-P 13.0软件,进行OPLS-DA建模分析,见图3。15批样品分为3组,与聚类分析结果一致,且分离显著,说明不同产地样品在组分上存在一定差异。并结合VIP值筛选差异性标志物,差异性标志物VIP见图4。从图4可以更直观看出各色谱峰的影响程度排序依次为峰10(ILQ A)>峰8(LQ)>峰16(GCA)>峰11(ILQ)>峰17>峰15>峰13(LQG)>峰2>峰7>峰3>峰12>峰14>峰1>峰4>峰5>峰9>峰6。说明这些成分起关键性作用。

图3 OPLS-DA得分图

图4 OPLS-DA VIP值图
综合主成分分析及正交偏最小二乘-判别分析结果,初步筛选出PA、AB、BPA、GA、LQ、ILQ A、ILQ、NILQ、LQG和GCA 10个成分对方剂药效影响较显著。
2.5 网络药理学及分子对接验证
2.5.1活性成分及靶点的筛选
基于可测性及可溯性的原则筛选活性成分,从芍药甘草汤中共筛选出潜在10活性成分作为候选化合物。基于TCMSP、Swiss Target Prediction、STITCH数据库共获得活性成分潜在作用靶点172个。基于Genecards、HPO、OMIM、OncoDB.HCC和Liverome数据库中共找到肝损伤相关靶点1311个。药物的靶点和疾病的靶点取交集,共得到79个共有靶点,见图5。

图5 芍药甘草汤抗肝损伤相关靶点Venn图
2.5.2成分-靶点网络构建
将10个化合物和79个共有靶点导入Cytoscape软件,构建“活性成分-靶点”可视化网络图,如图6所示,该网络由90个节点组成,其中红色节点代表:肝损伤。蓝色节点代表疾病相关靶点。10个紫色节点代表芍药甘草汤抗肝损伤的主要活性成分PA、AB、BPA、GA、LQ、ILQ A、ILQ、NILQ、LQG和GCA。217条边代表化学成分与靶点的相互作用。每个潜在活性成分均能作用于多个靶点,体现了芍药甘草汤的多成分、多靶点作用。

图6 芍药甘草汤化合物-靶点网络图
2.5.3蛋白质-蛋白质相互作用的网络构建与关键靶点筛选
将79个靶点导入String数据库,限定物种为“人”,设置最低要求互动分数为0.8,构建蛋白相互作用关系,见图7。同时保存string_interactions.tsv文件,运用R软件计算排名前30的关键靶点,如图8所示,按度值大小,排名前10的关键靶点:IL-6、VEGFA、CASP3、STAT3、ESR1、PTGS2、HSP90AA1、MMP9、KDR和IL-2,提示这些关键靶点在芍药甘草汤抗肝损伤作用中发挥关键作用。

图7 蛋白互作网络(PPI)分析

图8 蛋白相互作用网络中关键靶点筛选
2.5.4 GO生物过程富集分析
通过DAVID(https://david.ncifcrf.gov/)数据库,以人类基因为背景对79个靶点所对应的基因进行GO生物过程富集分析(P<0.01)。结果显示,生物过程共富集得到122项,主要涉及:核受体活性(GO:0004879),配体激活的转录因子活性(GO:0098531),蛋白质酪氨酸激酶活性(GO:0004713),跨膜受体蛋白酪氨酸激酶活性(GO:0004714),组蛋白脱乙酰基酶活性H3-K14特异性(GO:0031078),NAD依赖性组蛋白脱乙酰基酶活性(GO:0032041),见图9。

图9 生物学过程(GO)富集分析
2.5.5 KEGG信号通路富集分析
通过DAVID数据库,以人类基因为背景,对79个靶点所对应的基因进行KEGG生物过程富集分析(P<0.01),共得到61条生物过程,筛选出前20条信号通路,其中排名靠前的10条信号通路分别为:IL-17信号通路(hsa04657),MAPK信号通路(hsa04010),PI3K-Akt信号通路(hsa04151),癌症相关蛋白聚糖(hsa05205),麻 疹(hsa 05162),EGF信 号 通 路(hsa01521),TNF信号通路(hsa04668),军团菌病(hsa05134),癌症相关的MicroRNAs(hsa05206),前列腺癌(hsa05215),膀胱癌(hsa05219)等信号通路,见图10。

图10 KEGG信号通路富集柱状图和气泡图
2.5.6分子对接验证
研究认为白芍的指标性成分为芍药苷、芍药内酯苷以及苯甲酰芍药苷,甘草的代表性成分为甘草酸、甘草苷和甘草素,结合成分-靶点网络构建筛选出来的主要活性成分,本研究采用Autodock Vina软件对6个代表性成分芍药苷,芍药内酯苷,苯甲酰芍药苷,甘草苷,甘草素,甘草酸与核心靶点的相互作用进行分子对接计算。6个代表性成分与5个核心靶点的对接的结合自由能皆小于-5.0 kcal·mol-1,表明成分与核心靶点均有较好的结合活性,结果见表2。

表2 分子对接结合能
2.6 多成分含量测定
2.6.1线性关系考察
混合对照品溶液色谱图如图11,以各对照品进样浓度对峰面积作图,进行回归分析,得标准曲线方程。结果见表3。

图11 UPLC色谱图
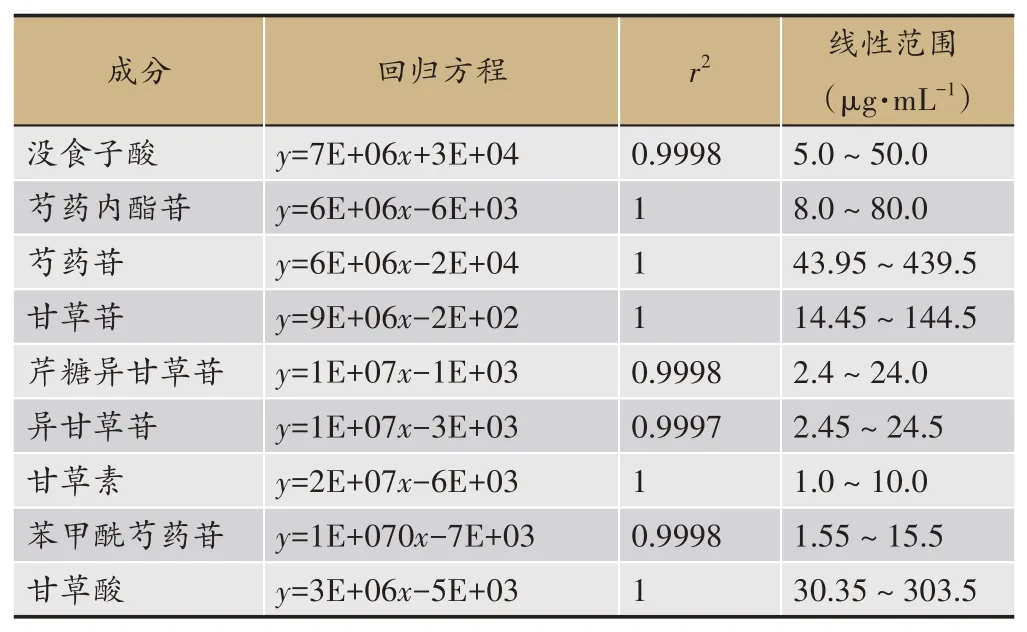
表3 线性关系考察结果
2.6.2精密度试验
精密吸取混合对照品溶液,按“1.2.1”项下色谱条件,连续进样6次,GA、AB、PA、LQ、ILQA、ILQ、LQG、BPA和GCA峰 面 积RSD值 依 次 为0.59%、0.16%、0.13%、0.07%、0.38%、0.66%、0.29%、1.95%、0.18%(n=6),RSD<2%,提示精密度符合要求。
2.6.3稳定性试验
GA、AB、PA、LQ、ILQA、ILQ、LQG、BPA和GCA的峰面积RSD值依次为1.42%、1.05%、0.60%、0.27%、1.93%、1.29%、0.74%、1.18%、0.39%(n=6),RSD<2%,表明样品24 h内稳定性良好。
2.6.4重复性试验
GA、AB、PA、LQ、ILQA、ILQ、LQG、BPA和GCA的平均含量RSD值依次为1.29%、1.09%、0.59%、0.39%、0.86%、1.30%、0.80%、0.28%、0.41%(n=6),RSD<2%,表明方法的重复性良好。
2.6.5加样回收试验
GA、AB、PA、LQ、ILQA、ILQ、LQG、BPA和GCA平均加样回收率分别为102.93%、100.13%、96.54%、101.39%、99.77%、98.83%、104.38%、101.93%、103.72%,表明方法准确度良好。
2.6.6样品含量测定
S1-S15样品中GA、AB、PA、LQ、ILQA、ILQ、LQG、BPA和GCA的含量见表4。其中LQ、GCA成分含量差异较大,表明不同产地及批次间存在差异,主要受甘草原药材质量的影响。

表4 15批芍药甘草汤含量测定结果(mg·g-1)(n=6)
3 讨论
目前芍药甘草汤药理活性研究多集中于镇痛方面,抗肝损伤的文献报道较少,我们前期研究发现芍药甘草汤具有很好的抗肝损伤作用,芍药甘草汤相关制剂如健肝乐颗粒等也已经被运用于临床治疗慢性乙型肝炎等肝脏疾病,但是芍药甘草汤抗肝损伤活性成分和作用机制尚不明确。本研究采用指纹图谱结合化学计量学整合网络药理学研究方法,探索芍药苷甘草汤抗肝损伤活性的主要指标性成分,在此基础上建立指标性成分的含量测定方法,为基于抗肝损伤活性的芍药甘草汤质量标准的建立提供依据。
本研究首先建立了芍药甘草汤UPLC指纹图谱,采用全波长扫描,结果不同类型的成分最大吸收波长差异较大,遂采用多波长切换法,分别在237 nm(4-9 min、20-35 min)、270 nm(0-4 min、9-13 min、15-20 min)、370 nm(13-15 min)下进行检测,可较为全面地反映芍药甘草汤化学成分信息。聚类分析显示第一类中甘草的产地均为甘肃,第二类中甘草的产地均新疆维吾尔自治区,第三类中甘草的产地均为内蒙古自治区,因此推测甘草产地不同,可能会影响样品聚类的结果,进而影响整个方剂的疗效。主成分分析及正交偏最小二乘-判别分析结果,初步筛选出潜在的生物标记物。在此基础上,基于可测性和可追溯性,以网络药理学结合分子对接验证,筛选出芍药甘草汤抗肝损伤的药效物质:芍药苷、芍药内酯苷、苯甲酰芍药苷、没食子酸、甘草苷、芹糖异甘草苷、异甘草苷、新异甘草苷、甘草素、甘草酸等10个化学成分,为芍药甘草汤抗肝损伤主要活性成分。
目前已有文献报道白芍中主要成分芍药苷、芍药内酯苷、苯甲酰芍药苷对四氯化碳致小鼠急性肝损伤有明显保护作用,可以改善肝脏病理变化,降低肝损伤小鼠血清中ALT、AST、TBIL、ALP、γ-谷氨酰转肽酶(γ-Glutamyl transpeptidase,γ-GT)、总胆汁酸(Total bile acids,TBA)水平,升高肝脏组织匀浆上清中超氧化物歧化酶(Superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)水平,降低丙二醛(Malondialdehyde,MDA)水平[11-12]。甘草中主要成分甘草苷、异甘草苷、甘草素、甘草酸等已经部分运用于临床,可以明显降低肝损伤患者的转氨酶,患者血清的ALP、ALT、AST及TBIL水平均低于治疗前,IL-6、IL-1β、TNF-α水平均低于治疗前,差异均有统计学意义(P<0.05)[13-16]。
在芍药甘草汤抗肝损伤的蛋白相互作用网络构建与关键靶点筛选中,共发现79个靶点,按照Degree值从大到小进行排序,Degree值越大,越有可能是关键靶点,排名 前10的关键靶点:IL-6、VEGFA、CASP3、STAT3、ESR1、PTGS2、HSP90AA1、MMP9、KDR和IL-2,也均有文献报道这些靶点与肝损伤的发生发展相关[17-21]。例如肝组织HE染色显示阻断血清IL-6表达后,肝细胞坏死明显减轻,坏死灶数量减少,肝细胞凋亡减少,抑制肝组织IL-6表达可明显减轻刀豆蛋白A(ConA)和油酸引起的急性肝损伤[17-20]。肝细胞通过上调VEGFA促进肝细胞再生[20],CASP3直接与肝细胞凋亡相关,JAK2/STAT3信号通路上的STAT3基因表达下调也可以明显降低ConA所致的肝细胞损伤[17-21]。
目前已有文献报道芍药甘草汤中3-7种化学成分含量测定方法,但是各类成分的最大吸收波长不一致,采用单一波长进行多个成分含量测定不太合理,本研究采用切换波长的方法进行数据采集,这是一种方法上的改进;另外目前已有文献应用网络药理学方法研究芍药甘草汤治疗痛经、胃痛、神经痛等各种疼痛病症的作用机制及活性成分,但并没有文献将指纹图谱与网络药理学结合来研究芍药甘草汤抗肝损伤作用的活性成分,然后对活性成分进行含量测定。因此本研究首次采用指纹图谱结合化学计量学联合网络药理学探索芍药甘草汤抗肝损伤的活性成分,然后采用UPLC切换波长法快速测定主要活性成分的含量,为基于抗肝损伤活性的芍药甘草汤质量控制提供依据,同时也为中药质量控制指标性成分的选择提供了一种新思路。

