德拉马尼血药浓度测定方法的建立及应用Δ
丁巧燕,张欢,马丽华,李思思,张宇,周铭(武汉市肺科医院药学部,武汉 430030)
结核病(tuberculosis,TB)是由单一病原体引发的传染病,是全球患者十大死亡原因之一,严重危害人类健康[1]。据世界卫生组织(WHO)统计,2020年全球新发TB患者达990万例,发病率为127/10万,其中耐多药结核病(multidrug resistant tuberculosis,MDR-TB)和耐利福平TB患者共计13.22万例,但只有1/3的患者接受了适当的治疗;我国新发TB患者占全球新发患者总数的8.5%,位居世界第二[2]。
MDR-TB是由至少对异烟肼和利福平这两种一线用于TB药物耐药的结核分枝杆菌引起的[3]。尽管临床使用各种组合的强效药物来进行治疗,但结核分枝杆菌已经持续表现出抵抗抗结核药的能力,耐药TB菌株在全世界范围内以惊人的速度出现,每年约有50万例感染患者[4]。由于MDR-TB的治疗成功率较低,临床迫切需要新型的抗结核药[5]。在此背景下,德拉马尼(delamanid,DLM)于2014年获得欧洲药品管理局(European Medicines Agency,EMA)批准,并于同年被WHO推荐用于MDR-TB成年患者的治疗[5]。
治疗药物监测(therapeutic drug monitoring,TDM)是用于指导个体化诊疗的手段之一,其旨在通过血药浓度来调整药物剂量以提高治疗效果、降低不良反应发生风险,同时最大限度地减少毒性[6]。DLM是一种双环硝基咪唑类化合物,为新型抗结核药,可通过在细胞内生成一氧化氮来发挥抗结核分枝杆菌的作用[7]。研究指出,DLM的疗效具有浓度依赖性,血药浓度过低可能导致疗效不佳,血药浓度过高则可能引发不良反应[8]。因此,本文从临床实际需求出发,建立了快速、准确的高效液相色谱-串联质谱(LC-MS/MS)法,并将其用于检测TB患者体内DLM的血药浓度,以期为临床用药提供指导。
1 材料
1.1 主要仪器
本研究所用主要仪器包括4500MD型LC-MS/MS系统(美国AB Sciex公司),5810R型台式高速大容量离心机、5424R型微量台式高速冷冻离心机(德国Eppendorf公司),Milli-Q Reference型超纯水系统(美国Millipore公司),XSR105DU型十万分之一分析天平[梅特勒-托利多仪器(上海)有限公司]等。
1.2 主要药品与试剂
DLM片(国药准字J20180086,规格50 mg)购自日本 Otsuka Pharmaceutical Co.,Ltd.;DLM 对照品(批号C08A11L110842,纯度99%)购自上海源叶生物科技有限公司;甲醇、甲酸、二甲基亚砜(DMSO)均为色谱纯,其余试剂均为分析纯,水为超纯水。
1.3 空白血浆
空白血浆采集于武汉市肺科医院进行体检的健康者。
2 方法与结果
2.1 色谱条件
以 Phenomenex SynergiTMFusion-RP(50 mm×32 mm,4 μm)为色谱柱,以甲醇(A)-0.1%甲酸溶液(B)为流动相进行梯度洗脱(0~0.5 min,40%A;0.5~0.6 min,40%A→90%A;0.6~2.9 min,90%A;2.9~3.0 min,90%A→40%A;3.0~4.0 min,40%A);柱温为40 ℃;流速为0.3 mL/min;进样量为1 μL。
2.2 质谱条件
离子源为电喷雾离子源(electrospray ionization,ESI),以多反应监测(multi-reaction monitoring,MRM)模式进行正离子扫描;离子化电压为5 500 V;雾化气温度为600 ℃;气帘气压力为25 psi;碰撞气压力为6 psi;喷雾气压力为45 psi;辅助加热气压力为55 psi;用于定量分析的DLM离子对为m/z535.0→352.0,碰撞能量为38.1 eV;去簇电压为124.6 V;用于定性分析的DLM离子对为m/z535.0→356.9,碰撞能量为26.3 eV,去簇电压为114.0 V。
2.3 对照品溶液和质控样品的制备
精密称取DLM对照品10 mg,溶于DMSO中,配制成质量浓度为1 mg/mL的储备液,置于-20 ℃冰箱中保存。取适量储备液,用DMSO稀释,得质量浓度分别为1、5、10、20、40、80、160 μg/mL的系列标准溶液和1、2、20、120 μg/mL的质控溶液。精密量取空白血浆95 μL,分别加入上述系列标准溶液各5 μL,制成质量浓度分别为0.05、0.25、0.5、1、2、4、8 μg/mL的系列标准曲线血浆样品;同法制备质量浓度分别为0.05、0.1、1、6 μg/mL的质控血浆样品,备用。
2.4 血浆样品的处理
精密吸取待测血浆样品40 μL,置于1.5 mL离心管中,精密加入甲醇360 μL,振荡混匀1 min后,于4 ℃下以12 000 r/min离心10 min,取上清液进行LC-MS/MS分析。
2.5 方法学考察
按照2020年版《中国药典》(四部)通则的相关要求进行方法学考察[9]。
2.5.1 专属性考察 取6份不同来源的空白血浆、空白血浆+DLM对照品(0.5 μg/mL)和服用DLM患者的血浆样品,分别按“2.4”项下方法处理后,再按“2.1”“2.2”项下色谱与质谱条件进样分析,记录色谱图。结果显示,在上述条件下,DLM的保留时间约为1.9 min,血浆中的内源性物质不影响DLM的测定,表明该方法专属性良好,详见图1(空白血浆样品图略)。
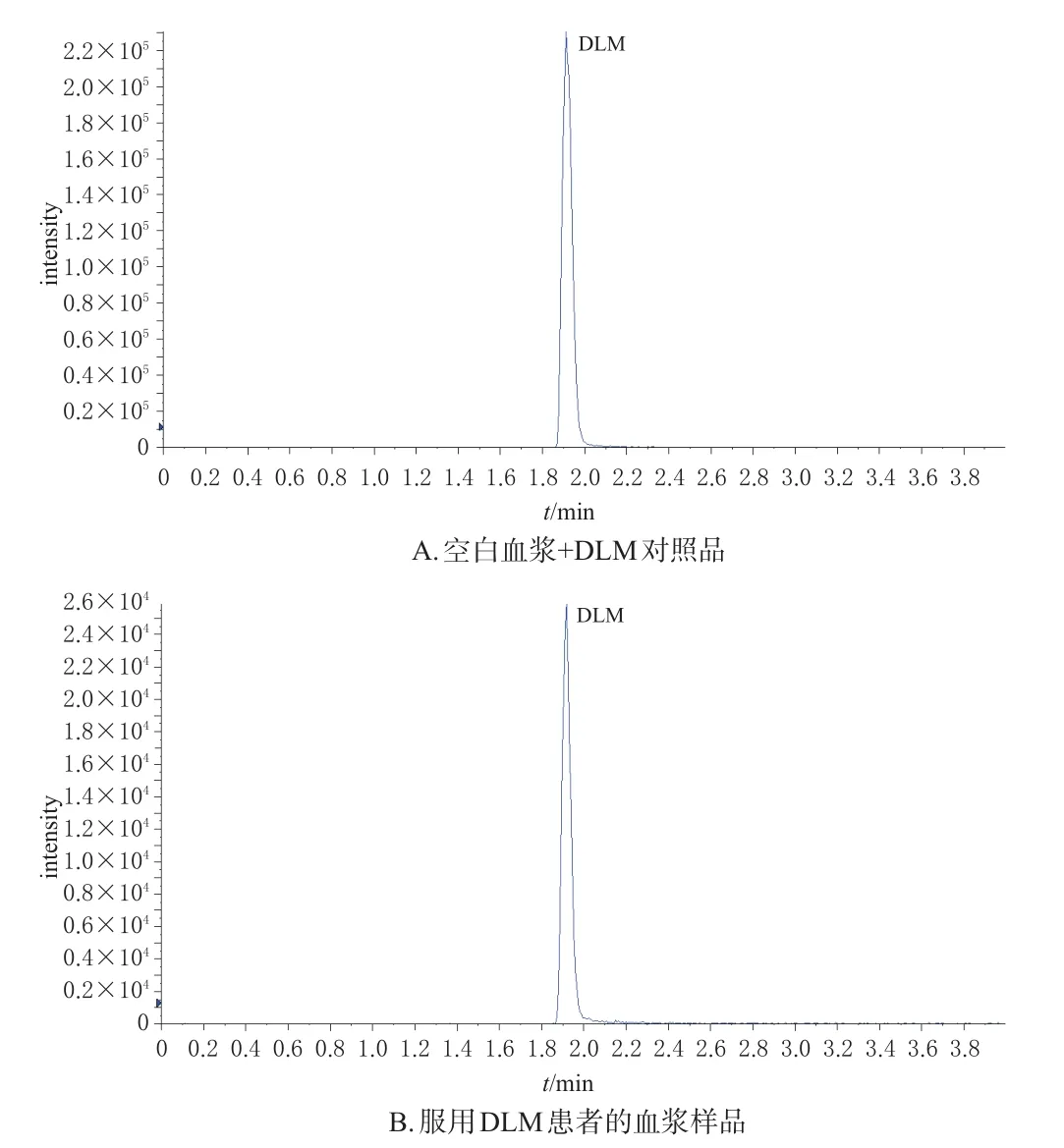
图1 DLM专属性考察的色谱图
2.5.2 线性关系和定量下限的考察 取“2.3”项下系列标准曲线血浆样品,按照“2.4”项下方法处理后,再按照“2.1”“2.2”项下色谱与质谱条件进样分析,记录峰面积。以DLM峰面积为纵坐标(y)、DLM质量浓度为横坐标(x),用最小加权法(加权系数为1/x2)进行线性回归,得DLM的回归方程为y=1.745 45×106x+20 346.322 71(r=0.999 5)。结果表明,DLM检测质量浓度的线性范围为0.05~8 μg/mL,定量下限为0.05 μg/mL。
2.5.3 准确度与精密度试验 取“2.3”项下定量下限质量浓度(0.05 μg/mL)和低、中、高质量浓度(0.1、1、6 μg/mL)的质控血浆样品,按照“2.4”项下方法处理后,再按照“2.1”“2.2”项下色谱与质谱条件连续进样5次,考察日内精密度;连续测定3 d,考察日间精密度;以实测质量浓度与理论质量浓度进行比较,考察准确度。结果显示,该方法日内和日间精密度的RSD均小于10%,准确度为92.7%~104.9%,详见表1。

表1 精密度与准确度试验结果
2.5.4 基质效应与萃取回收率试验 分别用3种方法制备低、中、高质量浓度(0.1、1、6 μg/mL)的待测样品——第1组:取DLM对照品适量,用50%甲醇稀释,制成低、中、高质量浓度的DLM溶液,按照“2.1”“2.2”项下色谱与质谱条件进样分析,得峰面积A;第2组:取空白血浆,加9倍体积的甲醇以沉淀蛋白,离心后取上清液(具体操作同“2.4”项),以此上清液作为基质,制备低、中、高质量浓度的DLM样品溶液,按照“2.1”“2.2”项下色谱与质谱条件进样分析,得峰面积B;第3组:取DLM对照品适量,用空白血浆稀释,制成低、中、高质量浓度的DLM血浆样品,按照“2.4”项下方法处理后,再按照“2.1”“2.2”项下色谱与质谱条件进样分析,得峰面积C。按下式分别计算基质效应和萃取回收率:基质效应=B/A×100%,萃取回收率=C/B×100%。各质量浓度样品平行操作5份。结果显示,各样品的平均基质效应为94.3%~107.5%,平均萃取回收率为93.2%~98.1%,详见表2。
表2 基质效应与萃取回收率试验结果(±s,n=5)
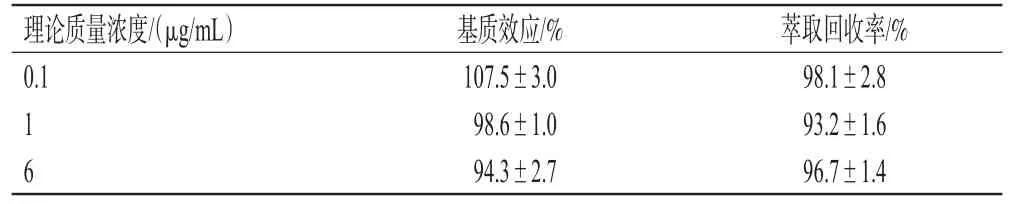
表2 基质效应与萃取回收率试验结果(±s,n=5)
理论质量浓度/(μg/mL)0.1 1 6基质效应/%107.5±3.0 98.6±1.0 94.3±2.7萃取回收率/%98.1±2.8 93.2±1.6 96.7±1.4
2.5.5 稳定性试验 按照“2.3”项下方法制备低、中、高质量浓度(0.1、1、6 μg/mL)的质控血浆样品,分别于室温下放置2 h、4 ℃放置6 h、-20 ℃下放置7 d、-80 ℃放置15 d、反复冻融(-80 ℃~室温)2或3次后,按照“2.4”项下方法处理后,再按照“2.1”“2.2”项下色谱与质谱条件进样分析,考察各样品在上述条件下的稳定性(各质量浓度样品平行操作5份,结果以实测质量浓度的RSD表示)。结果显示,除反复冻融3次外,各样品在其余条件下放置的稳定性均较好(RSD均小于10%),详见表3。
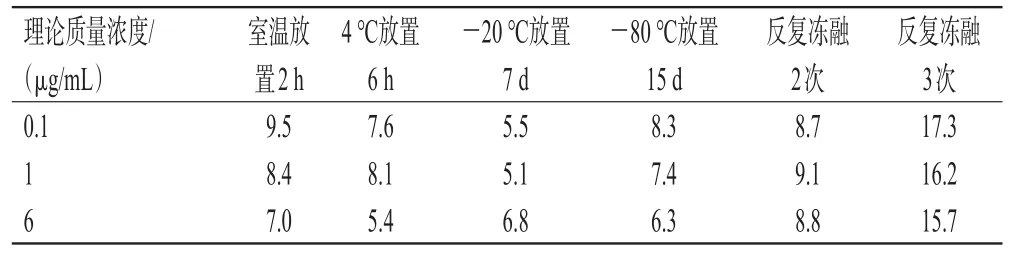
表3 血浆样品的稳定性试验结果(n=5,%)
同时,按照“2.3”项下方法配制质量浓度为1 mg/mL的DLM储备液和质量浓度分别为10、80 μg/mL的DLM标准溶液,考察上述溶液于室温下放置6 h、4 ℃放置15 d的稳定性(各质量浓度样品平行操作5份,结果以实测质量浓度的RSD表示)。结果显示,各样品在上述条件下放置的稳定性均较好(RSD均小于10%),详见表4。

表4 储备液和标准溶液的稳定性试验结果(n=5,%)
2.5.6 残留效应 取“2.3”项下质量浓度为8 μg/mL的标准曲线血浆样品,按照“2.4”项下方法处理后,再按照“2.1”“2.2”项下色谱与质谱条件进样分析,随后同法测定空白血浆样品以考察残留效应。结果显示,在DLM相同的保留时间处,空白血浆样品对应色谱峰峰面积与定量下限质量浓度血浆样品色谱峰峰面积的比值小于5%,表明残留效应对DLM的定量分析无明显影响。
2.5.7 稀释可靠性 取“2.3”项下质量浓度为8 μg/mL的标准曲线血浆样品,用空白血浆稀释10倍后,按照“2.4”项下方法处理后,再按照“2.1”“2.2”项下色谱与质谱条件进样分析以考察稀释可靠性(样品平行操作5份)。结果显示,稀释后样品的精密度RSD小于10%,准确度为98.9%,表明血浆样品用空白血浆稀释10倍对DLM的定量分析无明显影响。
2.6 方法应用
2.6.1 患者的纳入与排除标准 纳入标准包括:(1)年龄18~65岁;(2)临床确诊为MDR-TB患者;(3)规律服用DLM片1周以上,中途未中断或未更改剂量;(4)同意参加试验并已签署知情同意书。排除标准包括:(1)不耐受药物不良反应者;(2)1周内服用对DLM药物浓度有影响的药物者,如利福平等强细胞色素P450(cytochrome P450,CYP)3A4诱导剂[8];(3)妊娠期或哺乳期妇女。本研究方案经武汉市肺科医院医学伦理委员会审查批准,批件号为武肺伦理(2021)20号。
2.6.2 用药情况 本研究共纳入我院2021年4-10月收治的MTB-TB患者6例。其中,男性2例、女性4例;平均年龄为(28.8±11.7)岁;所有患者均口服DLM片,每次100 mg,每天2次,连续服用1周以上。
2.6.3 检测方法及结果 使用乙二胺四乙酸抗凝管采集患者末次服药后4 h的静脉血,于4 ℃下以3 000 r/min离心10 min,取上层血浆于离心管中,置于-80 ℃冰箱中保存,备用。取患者血浆样品,按照“2.4”项下方法处理后,再按照“2.1”“2.2”项下色谱与质谱条件进样分析,记录峰面积并使用随行标准曲线计算DLM的血药浓度。结果显示,6例患者体内DLM的血药浓度为0.61~2.76 μg/mL,平均(1.67±0.74)μg/mL。
3 讨论
DLM是一种霉菌酸生物合成抑制剂,对复制和休眠的结核分枝杆菌以及细胞内外的结核杆菌均具有抑制活性[10—11]。有研究指出,DLM联合其他活性药物用于难治性耐药TB,可实现较高的培养阴性率,且具有良好的安全性[12]。然而,在DLM上市后不久,临床出现了耐DLM结核杆菌感染患者,因此对该药的耐药性进行系统监测很有必要[13]。为了最大限度地延缓和减少耐DLM结核杆菌的出现,选择综合治疗方案并于治疗期间进行TDM十分重要,通过监测DLM血药浓度,可及时调整给药剂量,有助于实现个体化给药、降低耐药率、提高临床疗效。
TDM常用的分析技术主要有光谱法、色谱法和免疫学检测技术等,从药物专属性上推荐采用LC-MS/MS和高效液相色谱(HPLC)技术[14]。由于DLM在患者体内的血药浓度较低,HPLC技术已不能满足临床监测需求,而LC-MS/MS技术专属性强、灵敏度高,可降低内源性物质和其他药物的干扰,加之检测速度较快,故适用于DLM血药浓度的大样本监测。基于此,本研究建立了检测DLM血药浓度的LC-MS/MS法并将其应用于临床。
在流动相的选择中,为了弱化色谱峰拖尾并提高检测的准确性,本课题组分别考察了流动相中加入甲酸或(和)甲酸铵后的出峰情况,结果显示,在水相中加入甲酸,所得色谱峰的峰形较好;随后,本课题组依次以0.1%、0.2%甲酸溶液为水相,考察了两者的分离效果,最终选择了0.1%甲酸溶液作为水相,并确定了“2.1”项下色谱条件。
本课题组前期在扫描母离子时发现,DLM易形成[M+H]+峰,且在MRM正离子模式下的灵敏度较高;随后,本课题组对离子化电压、雾化气温度、气帘气压力、碰撞气压力、碰撞能量、去簇电压等质谱参数进行优化,以进一步提高灵敏度并降低基线信噪比,最终得到了“2.2”项下质谱条件。
研究指出,以甲醇沉淀蛋白所得样品的基质效应明显[15]。为此,本课题组首先在满足DLM血药浓度定量分析的前提下适当增加甲醇的体积,以减少基质效应的影响,最终确定按血浆-甲醇(1∶9,V/V)进行蛋白沉淀。随后,本课题组采用梯度洗脱方式,通过调整流速、优化水相和有机相的比例,尽可能地减少内源性物质的干扰。
本课题组前期分别采用内标法(以DLM同位素为内标)和外标法进行DLM的定量分析,结果发现,2种方法并无明显差别。结合相关文献[16—17]推荐,为缩短临床大样本监测时间并降低检测成本,本研究最终选择了外标法,以随行标准曲线计算MDR-TB患者体内DLM的血药浓度。
对比Meng等[18]所建的方法,本研究所建方法需要的样本量较少,仅需40 μL的血浆即可完成检测;同时,以甲醇沉淀蛋白进行血浆样品前处理,操作较为简便;在流动相组成方面,本法使用了成本较低且组成简单的甲醇-甲酸溶液;此外,DLM的出峰时间为1.9 min,检测时间不超过4 min,适用于临床大样本的快速检测。
综上所述,本研究成功建立了检测人血浆中DLM浓度的LC-MS/MS法,可用于检测MDR-TB患者体内DLM的血药浓度。由于目前暂无明确的DLM有效治疗浓度范围,且本研究的样本量较小,故后期本课题组将扩大样本量进行检测,同时收集该药有效性和安全性的相关数据,完善临床药动学研究。

