甘蔗居间分生组织腋芽的诱导研究
廖韦卫,韦海球,罗晟昇 ,马文清,何洪良,江清梅,谢君锋,2*
(1广西南亚热带农业科学研究所,广西龙州 532400;2广西大学农学院,广西南宁 530004)
0 引言
甘蔗是单子叶禾本科甘蔗属植物(Saccharum officinarum)植物[1]。甘蔗组织培养再生植株多采用新叶愈伤组织诱导或者茎尖顶端分生组织诱导的方法进行。甘蔗作为第一个组织培养成功的禾本科植物[2]经过多年研究,甘蔗组织培养已经发展成为一类比较成熟的应用生物技术。目前,植物组织培养技术在植物种苗快速繁殖、培育无病毒苗、种质资源保存、基因育种等方面得到了较为普遍的应用[3-6]。截至2022年5月,以“甘蔗”、“组织培养”为关键词查询可获相关文献共计70篇,但是成文时间较早,内容普遍涉及脱毒健康种苗繁育等实用技术,内容大多以诱导新叶愈伤组织、分化、增殖为主,而采用的组织培养部位多为新叶、茎尖。EVANS P S使用新叶诱导分化的方法第一次获取了甘蔗组培苗[7]。唐红琴等于 2011年报道了甘蔗茎尖脱毒健康种苗的研究进展,提到使用茎尖进行甘蔗组织培养的模式[8]。目前,植物组织培养技术在植物种苗快速繁殖、培育无病毒苗、种质资源保存、基因育种等方面得到了较为普遍的应用。近年来,广西南亚热带农业科学研究所生物技术研究中心实验研究发现,新叶愈伤组织的诱导存在着易变异、易褐化、苗细弱、后期分化能力不足的问题;茎尖顶端分生组织诱导也是存在着外植体要求高、接种操作较困难、技术门槛较高、培养基配比苛刻、褐化严重等诸多问题,而居间分生组织诱导刚好避免了上述的现实问题。在单子叶植物中,居间生长是单子叶植物生长的一个极其重要的因素[7],有关单子叶植物居间分生组织的研究,以稻、麦、玉米、高粱、甘蔗等植物的研究较多。居间分生组织是伸长节间的局部分生组织区域,是插入在或多或少已分化的组织区的分生组织[9]。所以,根据植物细胞的全能性理论,居间分生组织同样具有与顶端分生组织一样的分化能力,相较茎尖分生组织分别较少,且难以获取的特点,居间分生组织具有在同一植物内分布广,获取难度低的特点。因此,居间分生组织的诱导相较茎尖顶端分生组织诱导技术具有技术门槛下降的优势,是具有较好应用前景的一种甘蔗组织培养技术。如何打破休眠,诱导生长,成为居间分生组织进行植物组织培养的关键,而解决问题根本办法在于培养基及激素的选择。因此本文针对桂南亚08-186居间分生组织较厚易采的特点,采用了不同外缘激素叠加的试验方式,以期得到打破桂南亚08-186居间分生组织的休眠,诱导生长的方法,并给其他品种甘蔗居间分生组织植物组织培养诱导提供参考。
1 材料与方法
1.1 试验材料
甘蔗品种为桂南亚08-186,采自广西南亚热带农业科学研究所甘蔗资源圃。
1.2 试验方法
1.2.1 基础培养基选择
试验使用了常用的MS基本培养基(30 g/L蔗糖;pH 6.0)作为基础培养基。经过对比文献发现,甘蔗组织培养多采用MS培养基作为基础培养基,如常用的茎尖诱导、新叶愈伤组织诱导等[10-11]。
1.2.2 试验设计
试验培养基为 MS基本培养基+0.1 mg/L 6-BA+NAA(吲哚乙酸)+GA3(赤霉素),进行二因素多水平试验,具体处理见表1,其中NAA(设为A),水平分别为 0、0.1、0.5、0.75 mg/L;GA3(设为 B),水平分别为0、0.01、0.05 mg/L,对照CK为MS+0.5 mg/L 6-BA+0.01 mg/L NAA+30 g/L 蔗糖[8]。

表1 试验设计与处理
设3个重复,每个重复20瓶,每瓶放置外植体1个,培养15天后分别统计出芽数及出芽瓶数。此外,浅层培养进行甘蔗组织培养较常用的20 mL液体或固体培养基等模式效果要好[11],所以本次试验采用浅层培养方法。
1.2.3 居间分生组织获取及生长条件
取甘蔗茎顶部约 60 cm,带回实验室后于超净工作台上先用75%酒精擦拭表面,剥去叶梢,使用0.1% HgCl2处理7 min,使用无菌水冲洗5次。将已经消毒后并取剥除茎尖、削除外层组织后剩余的居间分生组织块,接入不同处理的培养基中,并放于培养间恒温26℃,光照1500 lx,持续12 h[12],控制污染率低于5%[13]。
1.2.4 数据处理
根据二因素试验统计分析方法进行方差分析检验试验结果[12]。F测验使用SPSS 22.0统计产品与服务解决方案软件进行分析。
2 结果与分析
2.1 出芽诱导结果
在培养至15天后,观察发现:除了A1B1外其余均有腋芽冒出(见表2、表3),由表2可知,A2B2、A2B3处理组芽数较多,经方差分析验证差异性。

表2 出芽数统计两向表

表3 出芽瓶数统计两向表
通过 SPSS分析可得表4,处理间显著性P为0.000<0.001,差异极显著,说明具有统计学意义。同理,通过对表3进行SPSS方差分析可得表5,处理间显著性P为 0.000<0.001,差异极显著,说明具有统计学意义。

表4 各处理出芽数方差分析表

表5 出芽瓶数方差分析表
2.1.1 出芽数分析
使用SPSS 22.0对各处理出芽数进行差异性分析(图1、图2),可以得出 A1B1、A1B2相差不大,意味着2个处理对居间分生组织诱导效果相同,对比统计表,可以判断A1B1、A1B2对居间分生组织的试验效果亦不佳。同理,CK、A1B3、A4B3、A2B1、A3B1、A3B2、A4B2、A3B3以及A4B1都处于颜色深度较近的区域内,因此处理效果可以理解为相似。而A2B3、A2B2在各个处理中,颜色与CK差异最大,通过对比表2数据可得,A2B3、A2B2是较为理想的诱导桂南亚08-186居间分生组织腋芽的理想培养基。但由于二者颜色差异不大,说明 A2B3、A2B2在芽数效果上差异不显著。
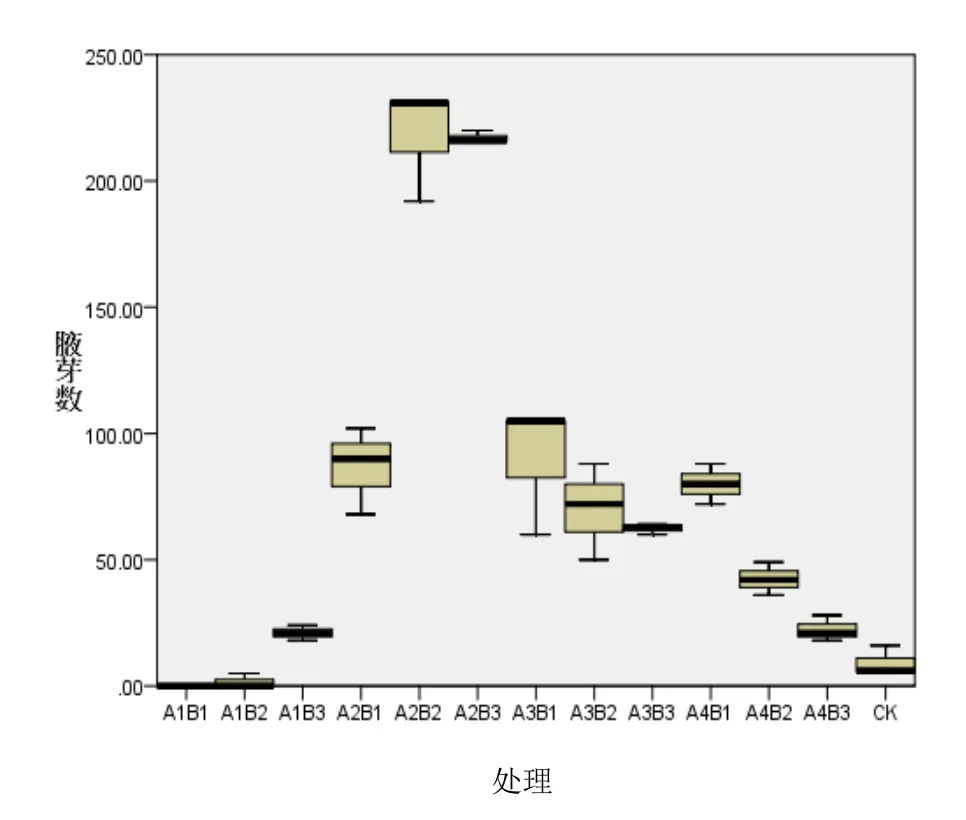
图1 各处理出芽数
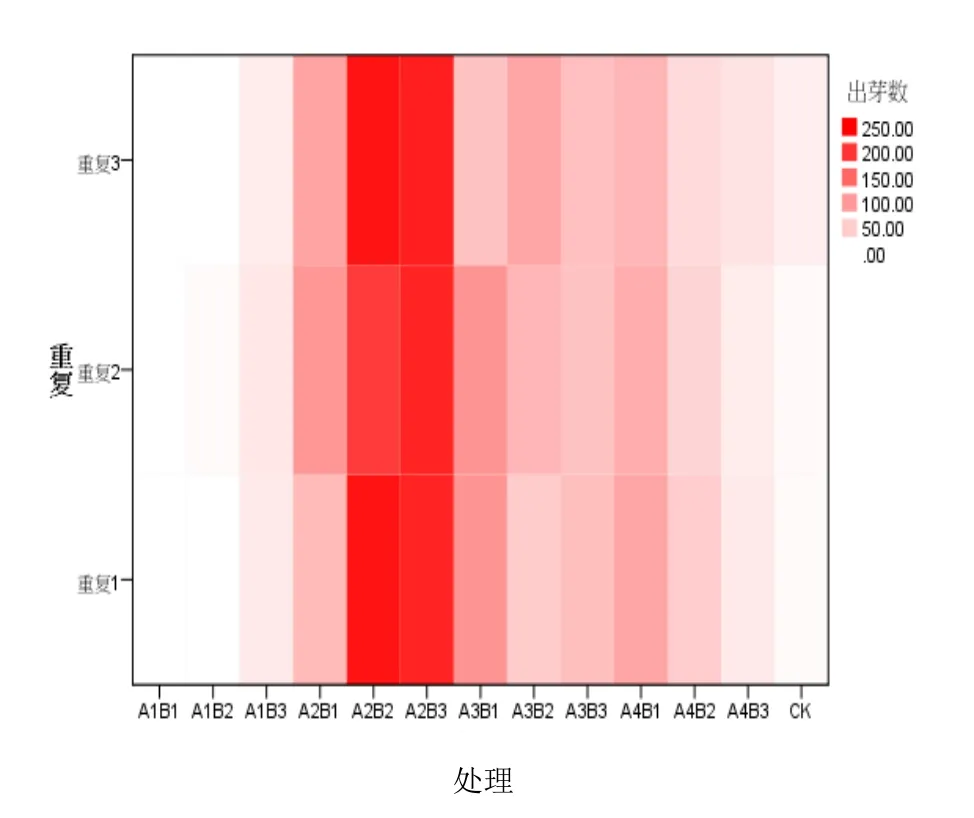
图2 各处理出芽数热图
2.1.2 出芽瓶数分析
通过分析出芽瓶数可以得出,A2B3在出芽瓶数上较为突出。说明整体而言 A2B3的出芽情况较为均匀,也就是说,A2B3的出芽较为稳定。
3 讨论与结论
本研究结果表明,A2B3(MS基本培养基+0.1 mg/L NAA+0.05mg/L GA3)、A2B2(MS基本培养基+0.1 mg/L NAA+0.01 mg/L GA3)具有很强的诱导居间分生组织腋芽分化的能力,但是对比出芽情况后发现,A2B3具有较为整齐的出芽情况,因此,A2B3(MS基本培养基+0.1 mg/L NAA+0.05 mg/L GA3)是较为理想的腋芽诱导处理。
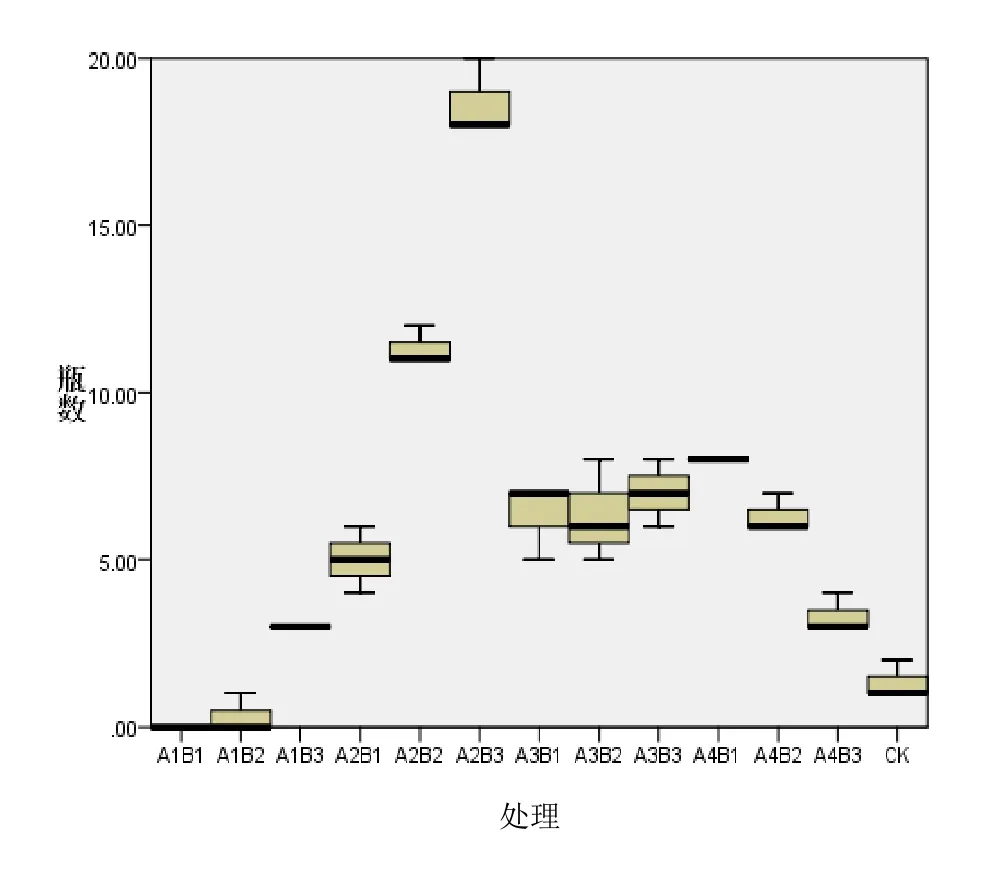
图3 各处理出芽瓶数
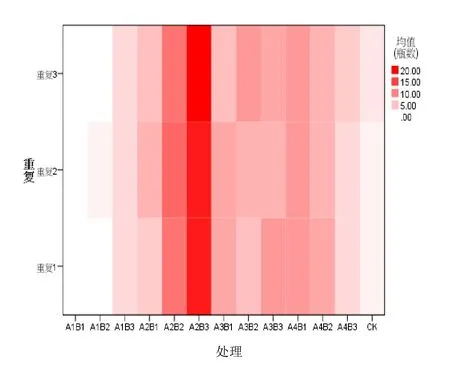
图4 各处理出芽瓶数热图
通过分析结果得出,发现 A2为 0.1 mg/L的NAA,NAA学名吲哚乙酸,是一种植物生长调节物质,NAA不仅有促进生根的作用,对于禾本科及某些单子叶植物而言,也有利于分化的作用[15];B3和B2分别为0.01和0.05 mg/L浓度的GA3,GA3学名赤霉素,作为一种重要的植物激素,参与控制多种多样的植物发育和生理过程。赤霉素参与调节植物生物发育中一个突出特点是促使茎的伸长和植株增高[16]。
本试验结果表明较低浓度的 NAA配合较高浓度的 GA3对桂南亚 08-186居间分生组织具有较强的诱导分化作用。NAA可以打破分化居间分生组织的休眠,而GA3辅助促进了腋芽伸长和增高,二者相结合的方式可以打破休眠诱导分化居间分生组织长出腋芽。另外,本研究中,出芽数与激素浓度数据并未呈现高度的线性分布,其中GA3的最佳浓度处于试验浓度中最高的,更高浓度的效果如何尚不清楚,需要扩大浓度范围进一步开展试验,以获得更加准确的激素浓度。
本实验中,桂南亚08-186在NAA与GA3外源激素的条件下均出现了良好的腋芽萌发现象,表现出对这 2种激素较为敏感。可以肯定的是NAA与GA3的作用,是打破甘蔗居间分生组织休眠并诱导甘蔗居间分生组织腋芽分化关键,因此,这2种外源激素也可以是其他甘蔗品种用于居间分生组织诱导腋芽发生的重要参考,也成为降低大规模甘蔗组培生产成本的重要关键。

