化瘀散结灌肠液对子宫内膜异位症盆腔痛大鼠的影响实验研究
宗春晓 徐 信 刘小丽 谢 伟 薛晓鸥 朱玉莹 徐 立
(北京中医药大学东直门医院,北京,100010)
子宫内膜异位症(Endometriosis,EMT)是妇科常见病,临床症状以痛经、慢性盆腔痛、月经失调、不孕等为主,严重影响患者的生命质量,但目前EMT发病机制尚不明确[1]。近年来研究表明,EMT与盆腔局部的炎症反应及氧化应激密切相关[2-3],核因子κB信号通路在EMT疼痛的发生发展中起重要作用[4-5]。
中医认为EMT的基本病机为瘀血阻滞冲任、胞宫,血瘀是其最基本的病理基础,治疗以活血化瘀为常法[6]。化瘀散结灌肠液由当归、川芎、赤芍、地黄、桃仁、红花、川牛膝、三棱、莪术、丹参、鳖甲、龟甲、木通、连翘、金银花等组成,具有活血化瘀止痛的功效。既往临床研究表明,化瘀散结灌肠液对缓解EMT患者的痛经、慢性盆腔痛症状疗效确切[7]。本研究旨在观察化瘀散结灌肠液对EMT盆腔痛模型大鼠氧化应激因子、核因子κB通路及炎症介质的影响,探讨化瘀散结灌肠液治疗EMT盆腔痛的作用机制。
1 材料与方法
1.1 材料
1.1.1 动物 选取40只无特定病原体(Specific Pathogen Free,SPF)级雌性SD大鼠,鼠8~10周,体质量180~230 g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0006,饲养于北京中医药大学东直门医院屏障环境动物室。温度24 ℃,湿度60%~70%,12 h明暗交替循环,自由饮食。动物实验严格遵守北京中医药大学东直门医院实验动物福利与伦理委员会的要求,伦理审批号:20-16。
1.1.2 药物 化瘀散结灌肠液(青海瑞成药业有限公司,国药准字Z20025840,药物组成:当归、川芎、赤芍、地黄、桃仁、红花、川牛膝、三棱、莪术、丹参、鳖甲、龟甲、木通、连翘、金银花),吲哚美辛胶囊(河北永丰药业有限公司,国药准字H13020834)。苯甲酸雌二醇注射液(上海全宇生物科技动物药业有限公司,兽药字163232511),缩宫素注射液(上海全宇生物科技动物药业有限,兽药字163231571)。SD大鼠给药量按照等效剂量系数折算法换算。
1.1.3 试剂与仪器 试剂:大鼠白细胞介素-1β(Interleukin-1β,IL-1β)酶联免疫试剂盒(南京建成生物工程研究所,货号:H002),肿瘤坏死因子-α(Tumor Necrosis Factor-α,TNF-α)酶联免疫试剂盒(南京建成生物工程研究所,货号:H052),超氧化物歧化酶(Superoxide Dismutase,SOD)测定试剂盒(南京建成生物工程研究所,货号:A001-1-2),丙二醛(Malondialdehyde,MDA)测定试剂盒(南京建成生物工程研究所,货号:A003-1-2),兔抗核因子κB p65抗体(北京博奥森生物技术有限公司,货号:bs-0982R),蛋白提取液(北京百奥思科生物医学技术有限公司,货号:MDL91201),蛋白酶抑制剂(北京百奥思科生物医学技术有限公司,货号:MD912893)。
仪器:低温离心机(Sigma,德国,型号:3-30K),脱色摇床(海门其林贝尔仪器制造公司,型号:TS-100),电泳仪(北京百晶生物技术有限公司,型号:BG-subMIDI),电热恒温水浴槽(上海一恒恒温设备厂,型号:HWS-24),聚偏二氟乙烯(Polyvinylidenefluoride,PVDF),膜(Millipore,美国,型号:ISEQ00010),ChemiDoc MP化学发光成像系统(Bio-rad,美国,型号:170-8280)。
1.2 方法
1.2.1 分组与模型制备 将40只雌性SD大鼠适应性喂养1周后,按随机数字表法选取6只为假手术组,剩余大鼠采用自体子宫内膜移植法加雌激素联合缩宫素注射建立EMT盆腔痛大鼠模型[8-10]。造模过程具体如下:将大鼠称重后以2%戊巴比妥钠(30 mg/kg)腹腔注射进行麻醉,固定于手术板,腹部备皮,常规消毒。选取尿道口上1 cm处为切入点,向上沿前正中线纵切开1.5~2.0 cm切口,逐层打开腹壁,进腹后找到大鼠“Y”形子宫,分离右侧子宫,结扎两端,剪下中间段约1 cm子宫组织,迅速放入装有生理盐水的培养皿中冲洗。用眼科剪纵行剖开管状子宫,切割成约5 mm×5 mm大小的碎片,将子宫组织内膜面朝向腹膜缝合于左侧腹膜血管丰富处,使其完全贴附于腹壁。检查无活动性出血后,腹腔内注射青霉素(0.1 mL/只)以抗感染,逐层关腹,消毒切口。术后前3 d连续腹腔注射青霉素(0.1 mL/只)以抗感染。假手术组术前准备、麻醉同造模组,只需要找到右侧子宫,紧贴左侧腹膜缝2针5-0尼龙线,缝合腹部伤口即可。造模4周后开腹查看造模情况,如肉眼看到移植物体积增大,移植物表面有血管形成,移植物呈小囊状、内含清亮液体,即判断EMT大鼠模型造模成功。术后第2天开始肌内注射苯甲酸雌二醇0.1 mg/kg,2次/周,假手术组雌性SD大鼠肌内注射等量生理盐水。造模4周后,腹腔注射缩宫素4 U/只,出现扭体反应即判断EMT盆腔痛大鼠模型造模成功。
选取30只造模成功的大鼠随机分为5组:模型组、阳性对照组、化瘀散结灌肠液低剂量灌肠组、化瘀散结灌肠液中剂量灌肠组、化瘀散结灌肠液高剂量灌肠组,每组6只。
1.2.2 给药方法 造模4周后,化瘀散结灌肠液剂量灌肠组、化瘀散结灌肠液中剂量灌肠组、化瘀散结灌肠液高剂量灌肠组分别给予每只大鼠相当于成药2.5 mL/kg、5 mL/kg和10 mL/kg的化瘀散结灌肠液配成的2.5 mL药液灌肠;阳性对照组大鼠给予2.5 mg/kg吲哚美辛配成的混悬液2.5 mL灌肠;假手术组和模型组给予同体积的生理盐水灌肠。每日1次,连续灌肠4周。
1.2.3 检测指标与方法
1.2.3.1 扭体反应观察 除假手术组外,其他组大鼠术后第2天开始肌内注射苯甲酸雌二醇0.1 mg/kg,2次/周,连续8周,假手术组大鼠肌内注射等量生理盐水。末次给药后,除假手术组外,其他各组大鼠均腹腔注射缩宫素4 U/只,假手术组大鼠腹腔注射等量生理盐水,记录大鼠30 min内扭体次数,根据公式计算扭体次数抑制率,抑制率(%)=(模型组扭体次数-给药组扭体次数)/模型组扭体次数×100%。扭体反应表现为大鼠腹部内凹,身体扭曲,后肢伸张,臀部高起。
研究人员称,父母对于子女日后的语言表达能力也起着十分重要的作用。所以婴儿期坚持给宝宝“磨耳朵”,日后会有意想不到的收获哦!
1.2.3.2 取材及组织形态学观察 造模后8周即最后1次灌肠结束后次日,麻醉大鼠进行剖腹以获取大鼠血清、正常子宫内膜及异位内膜组织。腹主动脉取血5 mL,室温静置20 min,置于离心机2 500 r/min,离心半径7 cm,离心15 min,收集血清。取异位内膜组织及假手术组正常子宫内膜组织,4%多聚甲醛固定,常规石蜡包埋,行5 μm连续切片,苏木精-伊红(Hematoxylin Eosin,HE)染色,中性树胶封片,光学显微镜下观察内膜组织学形态。
1.2.3.3 血清IL-1β、TNF-α、SOD、MDA水平测定 取大鼠血清,按照酶联免疫吸附试验试剂盒说明书检测血清IL-1β、TNF-α表达水平。按照试剂盒说明书操作要求,用羟胺法检测血清SOD水平,通过硫代巴比妥酸(Thiobarbituric Acid,TBA)法检测血清MDA水平。
1.2.3.4 蛋白质印迹法检测核因子κB p65蛋白表达 将异位内膜组织或假手术组在位内膜组织在冰上剪碎,加入细胞裂解液,冰浴上匀浆。在4 ℃条件下,12 000 r/min,离心半径7 cm,离心15 min后取上清,加入缓冲液,经二喹啉甲酸(Bicinchoninic Acid,BCA)蛋白浓度测定试剂盒测定蛋白含量,将蛋白定量为5 mg/mL,进行SDS聚丙烯酰胺凝胶电泳,电泳结束后,将凝胶上分离到的蛋白条带通过转移电泳方式转印至PVDF膜。将PVDF膜浸入封闭液轻摇1 h封闭后,加入核因子κB p65和β-机动蛋白一抗(稀释比例为1∶1 000)4 ℃孵育过夜,洗涤缓冲液(Tris Buffered Saline Tween,TBST)洗涤后,加入辣根过氧化物酶标记的二抗37 ℃孵育1 h,TBST洗膜后,将增强型化学发光试剂均匀铺在PVDF膜表面,室温作用4 min。抖掉膜上液体,将其放入化学发光成像系统成像,分析条带光密度(Optical Density,OD)值,目标蛋白的相对表达量=目标蛋白灰度值/内参β-机动蛋白灰度值。

2 结果
2.1 各组大鼠扭体反应比较 与模型组比较,阳性对照组大鼠扭体次数明显减少(P<0.01),其抑制率为81.63%,化瘀散结灌肠液剂量灌肠组、化瘀散结灌肠液中剂量灌肠组、化瘀散结灌肠液高剂量灌肠组均能显著减少大鼠扭体次数(P<0.05),其抑制率分别为26.52%、47.95%、53.58%。见表1。

表1 各组大鼠扭体反应比较
2.2 各组大鼠内膜组织形态学比较 假手术组大鼠子宫内膜上皮完整,柱状上皮细胞连续整齐排列,间质细胞排列致密整齐,微绒毛密集;模型组异位子宫内膜可见柱状、扁平状、立方体状上皮细胞增殖,间质细胞增殖密集,可见腺体;阳性对照组及化瘀散结灌肠液灌肠组异位子宫内膜可见柱状上皮细胞排列致密不规则,间质细胞疏密不等,腺体较少。见图1。
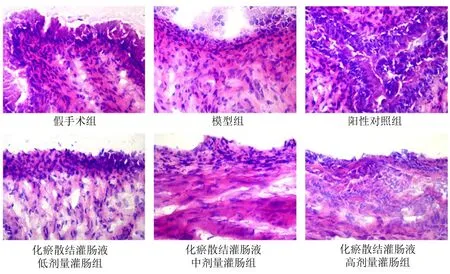
图1 各组大鼠内膜组织形态学比较(HE染色,×400)
2.3 各组大鼠血清IL-1β、TNF-α水平比较 与假手术组比较,模型组大鼠血清IL-1β及TNF-α水平均升高(P<0.01),与模型组比较,阳性对照组及化瘀散结灌肠液剂量灌肠组、化瘀散结灌肠液中剂量灌肠组、化瘀散结灌肠液高剂量灌肠组IL-1β、TNF-α水平均降低(P<0.05)。见表2。

表2 各组大鼠血清IL-1β、TNF-α水平比较
2.4 各组大鼠血清SOD、MDA水平比较 与假手术组比较,模型组大鼠血清SOD活力降低、MDA水平升高(P<0.01),与模型组比较,阳性对照组及化瘀散结灌肠液剂量灌肠组、化瘀散结灌肠液中剂量灌肠组、化瘀散结灌肠液高剂量灌肠组SOD活力升高、MDA水平降低(P<0.01)。见表3。

表3 各组大鼠血清SOD、MDA水平比较
2.5 各组大鼠内膜核因子κB p65蛋白表达比较 与假手术组大鼠在位内膜表达比较,模型组大鼠异位内膜核因子κB p65蛋白表达升高(P<0.05),与模型组比较,阳性对照组及化瘀散结灌肠液剂量灌肠组、化瘀散结灌肠液中剂量灌肠组、化瘀散结灌肠液高剂量灌肠组核因子κB p65蛋白表达降低(P<0.05)。见图2,表4。
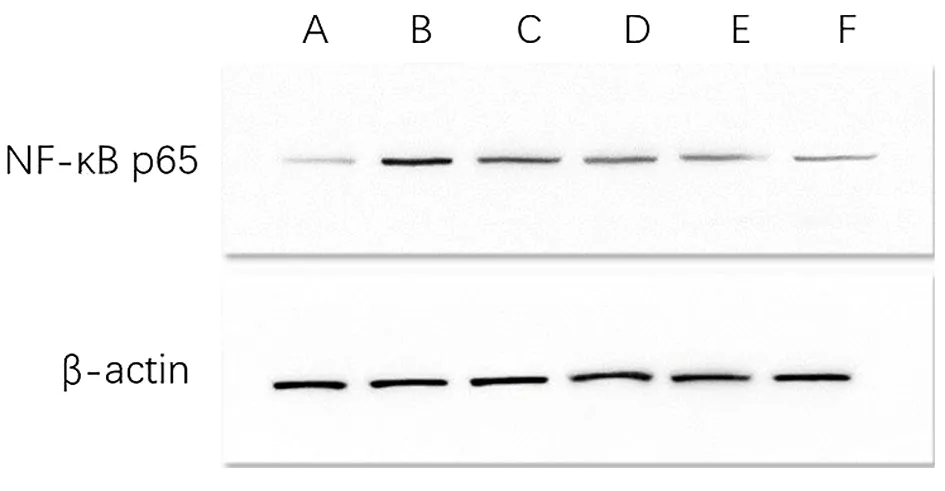
图2 各组大鼠子宫内膜组织中核因子κB p65蛋白含量表达电泳图

表4 各组大鼠核因子κB p65蛋白表达比较
3 讨论
中医学古文献中无确切EMT的病名记载,但根据EMT的主要临床症状与体征,可归属于“痛经”“月经不调”“癥瘕积聚”“不孕”的范畴。本病的基本病机为“瘀血阻滞胞宫、冲任”,治法以活血化瘀为主。化瘀散结灌肠液以养血活血之桃红四物汤为基础方,配伍三棱、莪术以破血消癥,鳖甲、龟甲软坚散结,丹参化瘀凉血,连翘、金银花清热散结,川牛膝、木通通利血脉、引血下行。诸药合用,共奏活血化瘀,软坚散结,清热解毒之效。且灌肠液对于盆腔痛的治疗具有直达病所,易于吸收,避免肝脏首过效应,减轻胃肠刺激的优势。既往临床研究表明,化瘀散结灌肠液临床治疗EMT取得良好疗效,能明显改善EMT患者疼痛症状,提高患者生命质量。现代药理研究表明,桃红四物汤、丹参、三棱、莪术等具有抗炎、镇痛、改善血流动力学及提高免疫力等功效。
目前关于EMT疼痛发生的机制尚未完全清楚,近期研究发现,参与EMT盆腔痛发生的可能因素有炎症反应、雌激素异常、神经纤维异常、盆腔粘连、神经的中枢敏感化及神经外周敏感化等[11]。
氧化应激是指机体在遭受各种有害刺激时,体内高活性分子产生过多,氧化程度超过氧化物的清除,抗氧化剂减少,氧化系统和抗氧化系统失去平衡,从而引起细胞氧化损伤。SOD是一种重要的抗氧化物酶,它可以将有害的超氧自由基转化为过氧化氢,过氧化氢进一步在过氧化氢酶和过氧化物酶催化下分解为水。氧化活性物质增加可对不饱和脂肪酸等脂质造成损伤。MDA是脂质过氧化的产物,可作为氧化应激的重要标志物。研究表明,氧化应激与EMT的发生发展密切相关。EMT异位病灶在诱导炎症反应清除异物的过程中会释放活性氧产物致使病变部位及其周围组织产生氧化应激,而氧化应激又能反过来诱导细胞因子产生,促进EMT的发展。抗氧化剂可以减弱炎症反应、缓解慢性盆腔痛[12-15]。
核因子κB是介导免疫与炎症反应的重要转录因子,参与多种复杂的细胞反应。研究表明,核因子κB能够通过介导炎症反应、抑制细胞凋亡、促进神经血管生成等机制影响外周敏化进而建立中枢敏化,抑制核因子κB可明显抑制EMT的发生和发展,并且减少EMT的相关疼痛症状[16-17]。氧化应激是核因子κB及其下游基因的强诱导因子,活性氧类可激活子宫内膜基质细胞的核因子κB通路,从而刺激IL-1β、TNF-α等炎症介质的产生,这些介质一方面可以刺激前列腺素分泌,引起子宫平滑肌收缩从而导致疼痛,另一方面又可以正反馈核因子κB激活通路,维持病灶中核因子κB的活性、巨噬细胞募集和腹腔内的炎症反应,从而活化周围神经纤维,刺激周围神经敏感化,改变神经组织的电信号,引发疼痛感觉[18-20]。此外,Khan等[21]提出氧化应激与炎症反应可以相互促进,通过相加作用进一步促进EMT的发生发展。
本研究结果表明模型组血清MDA、IL-1β、TNF-α处于高水平,SOD表达降低,异位内膜组织核因子κB表达增加,提示EMT盆腔痛模型大鼠存在氧化应激反应和炎症反应,核因子κB参与了EMT盆腔痛的发生发展。通过化瘀散结灌肠液灌肠干预后,化瘀散结灌肠液干预组及西药干预组可降低血清MDA、IL-1β、TNF-α水平,升高SOD水平,抑制异位内膜组织核因子κB表达。
综上所述,化瘀散结灌肠液能有效缓解大鼠EMT盆腔痛,其机制可能与抑制氧化应激反应,进而调控核因子κB通路,减少炎症介质产生有关。但本研究仅涉及化瘀散结灌肠液对氧化应激因子、核因子κB通路及相关炎症介质表达的影响,仍有待对该通路机制进一步研究。

