废次氯酸钠回收技术研究
陈斌武
(上海氯碱化工股份有限公司,上海 200241)
氯作为一种基础化工原料,广泛应用于农药、有机染料制备,塑料和橡胶合成、纸浆和织物漂白、过程杀菌消毒等领域。氯在参与PE、PP和PVC等聚合物氯化改性、甲烷氯化物和氟化工领域的化工产品制备中,大多以氯代反应进行,而伴随取代反应会有等摩尔的氯化氢产生,氯化氢中会掺混有一定量的氯,这部分氯最终被烧碱溶液吸收,形成一定浓度的次氯酸钠溶液。由于烧碱吸收氯的同时也吸收氯化氢,形成的次氯酸钠中含盐量较高,不能以正常次氯酸钠销售。
液氯生产、贮存及使用过程中,按设计规范,均需设计烧碱应急吸收处理装置,以应对紧急状态下氯泄漏事件,防止氯向大气及周边环境扩散。在此类应急装置的设计中,要求烧碱吸收液循环泵常开,该部分吸收液会因吸收空气中的二氧化碳生成碳酸钠并造成烧碱液浓度下降,需定期置换。置换出的循环吸收液继续用于吸收氯后形成的次氯酸钠,同样不能以正常次氯酸钠销售。
此类次氯酸钠或有效氯含量低、或含盐量过高,一般以废次氯酸钠形式进入市场,随着资源化、集约化理念的深入,有必要将此纳入产品全生命周期的闭环管理,充分回收循环利用。对这部分次氯酸钠的回收,一般是回收利用其有效氯或氯化钠和水,回收氯化钠和水时必须对次氯酸根进行适当处理,形成含盐废水后再综合利用。
1 废次氯酸钠回收方案
次氯酸钠的分解受光照、加热、pH值影响较大[1],对废次氯酸钠的回收方案设计,应充分考虑这些因素。
次氯酸钠溶液是强氧化剂,化学性质极不稳定,这是由ClO-的结构决定的。次氯酸根离子的价层电子对排布方式为四面体结构,氯原子以sp3杂化轨道和氧原子成键,酸根中存在着3个未成键的孤对电子。由于酸根离子价层电子对空间构型的高度不对称性和中心原子氯有较大的离子势(Z/r),导致次氯酸根极不稳定,具有较强的得电子能力,因此表现出较强的氧化能力[2]。
在处理次氯酸钠过程中,若处理不当,会造成氯气的扩散,必须以合适的方法将次氯酸根尽可能转变成氯离子,避免氯气的生成。
1.1 废次氯酸钠与电解系统盐水主要离子组成比较(见表1)
由表1主要离子组成比较分析,结合电解工艺盐水精制过程可知,废次氯酸钠中的阴阳离子,除次氯酸根离子外,其余均在盐水精制不同阶段出现,因此废次氯酸钠存在回收利用的可能性。
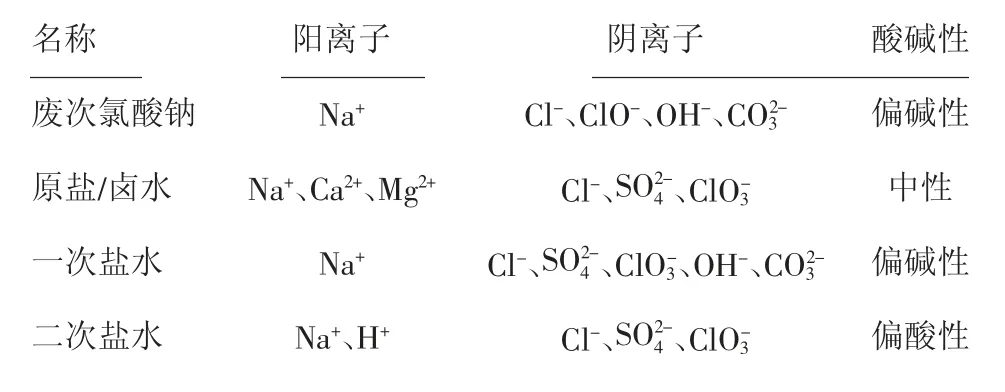
表1 主要离子组成比较
1.2 废次氯酸钠处理方法
回收方案以回收氯化钠为主要目标,回收液返回电解系统,实现资源的有效利用,在处理过程中,尽可能减少新引进阴阳离子,避免增加盐水精制难度。因此,需对废次氯酸钠进行综合分析和研判,设计合理工艺路线和处理方法。不同浓度、不同组成的废次氯酸钠,采用的回收工艺不尽相同,可以归纳为2种。(1)废次氯酸钠中含盐量高、有效氯浓度低,由吸收少量含氯的氯化氢而来。针对此类情况,一般在调节pH值后,用双氧水或亚硫酸钠处理其中次氯酸根至完全后返回盐水系统;(2)有效氯浓度较高,由吸收含较大量氯而来。为减少化学药剂的加入量,在调节pH值后,次氯酸盐先通过自分解法消减90%以上,剩余的次氯酸根再以双氧水或亚硫酸钠处理至完全后返回盐水系统。
废次氯酸钠处理方法包括:
(1)双氧水法
适用于低浓度次氯酸根处理,基于双氧水甲类危险化学品的属性,贮存、使用均有一定限制,反应迅速,反应后体系不产生新组成。
基本反应方程NaClO+H2O2→NaCl+H2O+O2
(2)亚硫酸钠法
适用于低浓度次氯酸根处理,亚硫酸钠作为一般化学品,其贮存、使用及生产装置设计要求较双氧水法低,反应迅速,但反应后体系会产生新物质。
基本反应方程NaClO+Na2SO3→NaCl+Na2SO4
(3)次氯酸钠自分解法
适用于高浓度次氯酸根处理,次氯酸钠受热发生歧化反应,歧化反应速度受温度及pH值影响,且反应不彻底,反应后体系会产生新物质,需再以双氧水或亚硫酸钠将次氯酸根完全去除。
基本反应方程3NaClO→2NaCl+NaClO3
1.3 方案合理性分析
进离子膜电解槽的精盐水,除对氯化钠浓度有要求外,对部分杂质离子也有特别控制指标,主要控制杂质及指标见表2[3]。

表2 进电槽盐水主要控制指标
由进电槽盐水的主要控制指标及盐水电解工艺过程可见,离子膜法烧碱电解过程不可避免会产生氯酸根,产生的氯酸根随淡盐水回盐水系统循环使用,氯酸根浓度会逐步积累,而过高的氯酸根浓度会使产品氯酸盐浓度同步上升,带来设备腐蚀等问题,必须将氯酸根浓度控制在合理范围内。
过高的氯酸根浓度,在氯酸盐高温酸化处理时,易产生二氧化氯,并进入氯气系统。因二氧化氯的超高活性,会给某些氯化工艺带来极大的负面影响,主要表现为反应速率急剧下降,因此,盐水中氯酸根浓度须控制在合理范围内。
氯酸钠高温酸化分解反应式如下。

在脱氯酸盐过程中产生的二氧化氯影响液氯质量,必须提高盐酸的用量,以有利于反应按式(a)进行,去除氯酸盐工艺是离子膜法烧碱盐水系统成熟工艺。
同样,在以亚硫酸钠处理盐水中游离氯(次氯酸根)过程中会形成硫酸盐,并在盐水系统中浓度逐步积累,当前大多以膜法脱硝将此部分硫酸盐以芒硝形式移出盐水系统,需将盐水中硫酸盐控制在合理范围内。
亚硫酸钠脱氯过程化学反应式如下。

对于次氯酸钠,不管是采用亚硫酸钠处理,还是选用次氯酸钠的歧化分解,其处理后的产物之一是硫酸钠或氯酸钠,均是离子膜法烧碱工艺盐水精制中常见的杂质离子,处理工艺简单可靠,同时,对这两种化学物质,电解的盐水系统均有较高的耐受度,均可作为处理次氯酸钠的可选工艺。
双氧水法与上述两种方法最大的区别在于,反应产物氧可以直接外排出系统,氯化钠和水可直接返回盐水系统,因此也可作为处理次氯酸钠的工艺。
按照进电槽盐水对有机物的要求,采用上述几种工艺处理废次氯酸钠,对其中是否含有机物提出了类似的要求,限制了这些工艺路线的应用与推广,要求在处理此类废次氯酸钠的同时,必须充分考虑有机物浓度对电解系统的影响。
2 试验过程
基于以上分析设计试验方案,分别对双氧水法、亚硫酸钠法,以及次氯酸钠自分解法进行试验,以确认针对不同来源的废次氯酸钠的较优处置方案。
2.1 双氧水法
由于双氧水浓度越高,其危险性也越大,本实验将双氧水浓度控制在6%以下,同时考虑到双氧水60℃以上易发生自分解反应,因此只考察反应温度、反应配比条件,跟踪处理前后次氯酸根浓度,以此判断反应是否完全。
温度条件20℃、30℃、45℃及55℃;
双氧水与次氯酸根配比1.01∶1~1.05∶1(摩尔比,以ClO-为基准)。
反应温度与残留次氯酸根浓度关系见图1,原料配比与残留次氯酸根浓度关系见图2。
由图1、图2可见,(1)双氧水与次氯酸根的反应是等摩尔反应,在55℃、原料配比1.01∶1(摩尔比)条件下,可基本将次氯酸根除至极限;(2)随着双氧水的过量加入,残留次氯酸钠量却异常增加,分析原因认为,过量双氧水的存在对次氯酸根浓度滴定过程产生较大影响,最终导致次氯酸钠测试数据失真,过量越大,偏差越大。
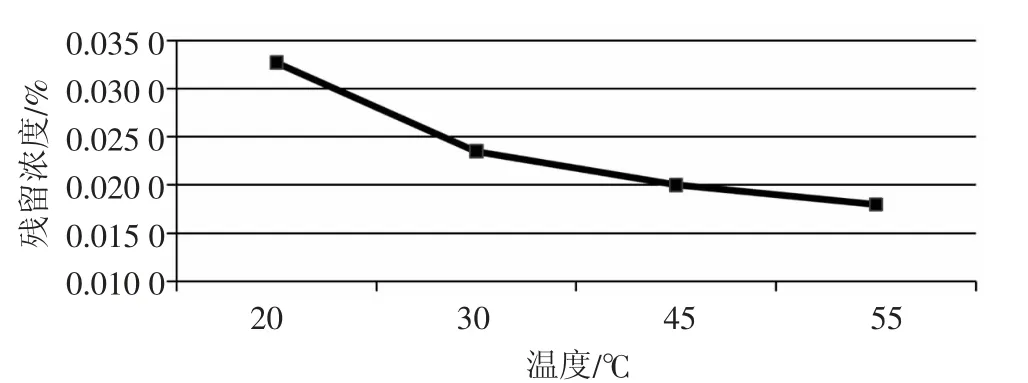
图1 反应温度与残留次氯酸根浓度关系(原料配比1.01∶1)

图2 原料配比与残留次氯酸根浓度关系(反应温度55℃)
2.2 亚硫酸钠法
以亚硫酸钠处理次氯酸钠是盐水精制中的常用处理方法,一般在碱性条件下(pH值为9~11),次氯酸钠与亚硫酸钠反应生成氯化钠和硫酸钠。
2.3 次氯酸根自分解法
次氯酸钠一般随存放时间、存放温度、受光照等因素影响,会发生自分解反应,有两种方式。

在一定pH值条件下,次氯酸钠在常温下缓慢分解,一般按分解反应(1)式进行,温度越高分解越快,达到75℃以上时按分解反应(2)式发生歧化反应,分解较迅速,但分解不彻底,需通过延长高温条件下的停留时间以尽可能减少次氯酸根的残留。
试验一:试样置于90℃恒温下,每隔3 min取样分析次氯酸根浓度,处理时间与ClO-去除率关系见图3。
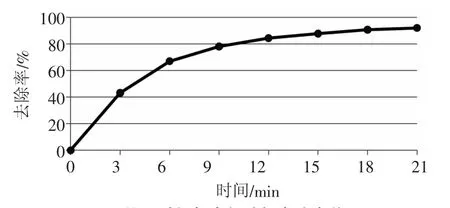
图3 处理时间与次氯酸根去除率关系
试验二:试样分别置于75℃、80℃、85℃及90℃条件下18 min后取样分析次氯酸根浓度,分解温度与ClO-去除率关系见图4。

图4 分解温度与次氯酸根去除率关系
由上述试验可见,当次氯酸根浓度超过一定值时,采用高温自分解方式处理较为理想,可省去大量双氧水或亚硫酸钠等化学药品的消耗,但其缺陷也显而易见,歧化反应的产物之一氯酸盐需要在后序的回收过程中进一步处理,以免过高的氯酸盐浓度影响盐水质量。
3 方案对比
从以上试验结果与分析可见,采用双氧水或亚硫酸钠处理废次氯酸钠,以及利用高温下次氯酸盐易歧化分解的特点,均可实现盐水的回收,但从工艺的难易程度、控制的复杂程度比较,存在一定的差别,主要表现见表3。

表3 废次氯酸钠不同处理工艺方案对比
4 应用
某装置用烧碱溶液吸收处理含CO2和Cl2的反应尾气,因CO2量较多,最终吸收液组成以Na2CO3为主。由于有效氯浓度低,无法向外出售,设计去除次氯酸根,回收其中氯化钠和碳酸钠。
双氧水法处理较为简单,但其化学危险性不适宜在本装置使用,如直接采用亚硫酸钠处理受限于盐水系统脱芒硝能力,最终采用次氯酸钠自分解,并结合亚硫酸钠调节,确保外送盐水次氯酸盐基本去除。
因含有大量的碳酸钠及少量的氢氧化钠,溶液的pH值很高,不利于次氯酸钠分解,须将pH值调整至适当范围。使用盐酸调节必须注意加入量,以减少碳酸钠消耗,相关数据见表4。
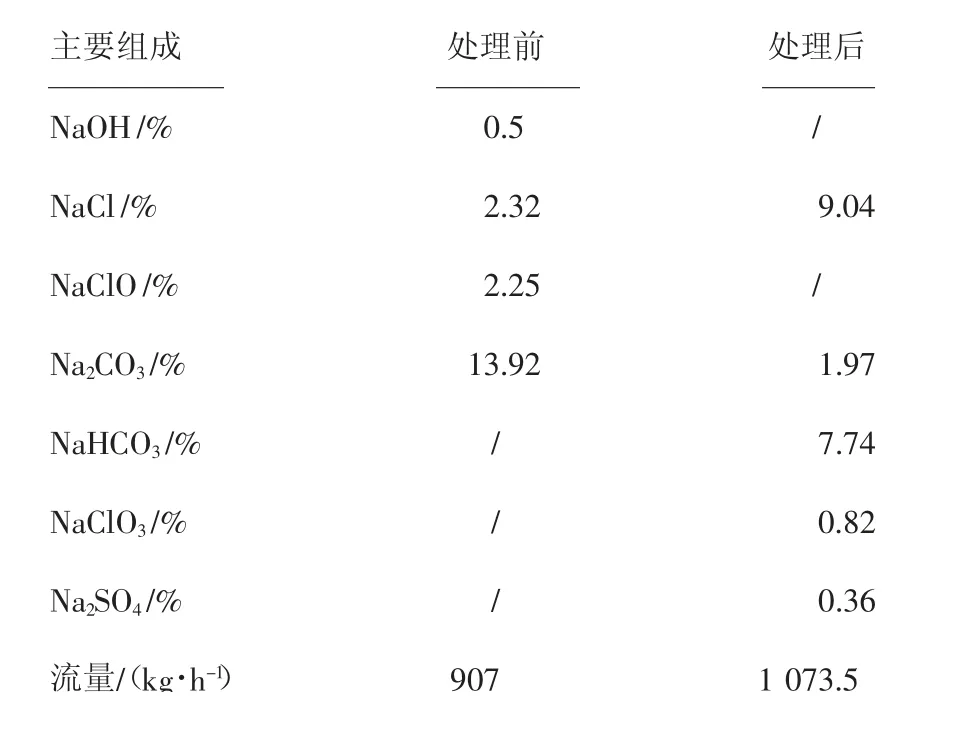
表4 运行数据对照表
经计算,处理后盐水中碳酸盐及碳酸氢盐的浓度较高,除此之外,其他杂质离子浓度对于电解用盐水而言,均在可接受范围内,因此可直接当作除Ca2+剂使用,返回盐水精制系统的碳酸钠回收利用率近50%,同时可回收整个处理过程产生的氯化钠,回收率可达95%。
5 结论
(1)针对有效氯浓度低、含盐量高,无法由下游市场消化的废次氯酸钠,均可采用双氧水法、亚硫酸钠法,或次氯酸钠自分解法进行处理,并回收其中的氯化钠,实现资源化利用;
(2)次氯酸钠自分解法适用于含较高浓度有效氯的处理,建议有效氯浓度4%以上废液优选采用此法。双氧水法、亚硫酸钠法更适用于有效氯浓度低于2%的废液处理;
(3)若废次氯酸钠含有一定量的有机物,其回收需结合有机物的处理,此部分内容有待进一步研究。

