健脾消癌方调控巨噬细胞M2 极化对结直肠癌细胞侵袭作用的研究
陈 娟,徐琳本,蒋益兰,翦林宏,曾宏亮,谭小宁*
(湖南省中医药研究院,湖南 长沙 410006)
结直肠癌(colorectal cancer, CRC)是最常见的恶性肿瘤之一,在全球所有恶性肿瘤的发病率和死亡率中分别位居第3 位和第2 位[1]。研究表明,40%~50%的患者在诊断初期即发现有远处转移,其中无转移者5 年生存率接近90%,而已转移者5 年生存率仅为10%[1]。 肿瘤微环境是肿瘤的生存场所,具有低氧、低pH、炎症、乳酸堆积等特点,在促进肿瘤转移中具有关键作用[2]。 在肿瘤微环境中的巨噬细胞被称作肿瘤相关巨噬细胞(tumor associated macrophages,TAM),TAM 数量和分型变化与CRC 的发生发展和临床治疗密切相关[3]。 研究证实,M2 型巨噬细胞不但能发挥免疫抑制作用,还能促进肿瘤微环境中的血管生成和基质重塑等,进而促进肿瘤转移[4]。
健脾消癌方是湖南省名中医蒋益兰教授根据多年的临床经验,结合现代医学知识,根据CRC“脾气亏虚、瘀毒内结”的病机特点,以扶正祛邪为原则,以健脾益气、化瘀解毒为治法而创立,具有显著的临床疗效[5-6]。 本实验在前期研究的基础上,以TAM 作为研究对象,在体外通过将巨噬细胞与人CRC 细胞HCT116共培养的方法来模拟CRC 免疫微环境,探索健脾消癌方拮抗CRC 转移的机制。
1 材料
1.1 细胞
人CRC 细胞HCT116 购于中国科学院上海细胞研究所,目录号TCHu 99;人单核巨噬细胞THP-1购于中国科学院上海细胞研究所,目录号:TCHu 57。
1.2 药物
健脾消癌方组成:人参15 g,茯苓15 g,薏苡仁30 g,淫羊藿15 g,白花蛇舌草30 g,石见穿30 g,莪术10 g,郁金15 g,炒枳壳6 g。 选用一级药材,按生药量加入10 倍水,煎煮1 h,保存药液;药渣再加入8 倍量水,煎煮1 h;合并药液,浓缩成近2 倍水量时,放置过夜,去沉淀,继续浓缩成1.5 g 生药/mL备用。
1.3 实验动物
雄性SD 大鼠20 只,SPF 级,体质量180~220 g,购自湖南斯莱克景达实验动物有限公司,实验动物生产许可证号:SCXK(湘)2019-0004,实验动物质量合格证号:43072721110275225,饲养于湖南省中医药研究院屏障环境,实验动物使用许可证号:SYXK(湘)2020-0008。 饲养环境:温度22~26 ℃、相对湿度50%~70%、12 h/12 h 光暗交替。本实验方案经湖南省中医药研究院实验动物福利伦理委员会批准实施(伦理审查编号:2021-0008),所有实验操作均按照《实验动物护理和使用指南》进行。
1.4 主要试剂
RPMI-1640 培养基(美国Hyclone 公司,批号:AD21356769);胎牛血清(美国Gibco 公司,批号:2148169CP);白细胞介素-4(interleukin-4,IL-4)(美国PeproTech 公司,批号:200-04-5);CD14、CD163流式抗体(美国eBioscience 公司,批号:12-0149-41、25-1639-41);E-钙黏蛋白(E-cadherin)、波形蛋白(Vimentin)、基质金属蛋白酶9(matrix metalloproteinase,MMP-9)、β-actin 抗体(美国Proteintech公司,批号:00018701、00096022、573145、10004156);cDNA 反转录试剂盒、SYBR Green PCR 试剂盒(日本Takara 公司,批号:RR047A、RR820A);ECL 发光液(美国Thermo 公司,批号:SF249787B)。
1.5 主要设备
化学发光成像系统(英国Syngene 公司,型号G:BOX ChemiXRQ);荧光正置显微镜(德国Leica 公司,型号:DM4000);微量核酸蛋白浓度分析仪(英国BioDrop 公司,型号:BioDrop Duo);电泳仪、转膜仪(美国Bio-Rad,型号:powerpac、Mini Trans-Blot C);荧光定量PCR 仪(美国Roche 公司,型号:FAST480Ⅱ)。
2 方法
2.1 健脾消癌方含药血清制备
SD 大鼠适应性喂养7 d 后,随机分为给药组(12 只)和对照组(8 只)。 按体表面积法进行大鼠等效剂量换算,给药组大鼠按14.9 g/kg 灌胃给予健脾消癌方水煎液,1 次/d,灌胃前空腹12 h,连续1 周;对照组大鼠按15 mL/kg 灌胃给予生理盐水。于第7天末次灌胃1 h 后腹主动脉采血,所采血液以2000 r/min,离心半径10 cm,离心10 min,吸取上清液即血清,合并同组血清,用0.22 μm 微孔滤膜过滤除菌后,无菌试管分装,放置于-20 ℃冰箱内保存备用。
2.2 细胞培养及实验分组
人单核巨噬细胞THP-1 为悬浮生长细胞,培养条件为含10%胎牛血清的RPMI-1640 完全培养基;人CRC 细胞HCT116 贴壁生长于含10%胎牛血清的RPMI-1640 完全培养基中。 细胞均在37 ℃及含有5% CO2环境的饱和湿度箱中培养。M0 型巨噬细胞诱导:将人单核巨噬细胞THP-1 用佛波酯(50 ng/mL)处理24 h 后,细胞贴壁生长,流式细胞术检测细胞表面CD14 蛋白。 IL-4(10 ng/mL)诱导巨噬细胞M0 型极化为M2 型,流式细胞术检测标志物CD163 蛋白。
共培养体系建立:利用Transwell 小室建立非接触的细胞共培养系统,取佛波酯处理24 h 的对数生长期的THP-1 巨噬细胞,使用胰酶消化制成细胞密度为2×106/mL 的单细胞悬液,每孔约500 μL 接种于Transwell 小室内底面,每孔补足培养基至2 mL。取生长状态良好的HCT116 细胞,胰酶消化制成细胞密度为5×105/孔,接种于上室。
实验分组:空白血清对照组(加10%空白血清处理);健脾消癌方含药血清组(加10%含药血清处理);IL-4+空白血清组(加10 ng/mL IL-4 和10%空白血清处理);IL-4+健脾消癌方含药血清组(加10 ng/mL IL-4 和10%含药血清处理)。 各组处理48 h 后进行检测。
2.3 流式细胞术检测巨噬细胞状态
用胰酶消化佛波酯诱导的THP-1 细胞和IL-4诱导的巨噬细胞M0 型细胞,3000 r/min,离心半径10 cm,离心3 min,小心吸取上清液,收集细胞,用PBS 清洗2 次后进行细胞计数,按照1×107/mL 的浓度用PBS(含1% BSA)重悬细胞。 待细胞充分混匀后,于每个流式管内加入100 μL 混悬液,并分别加入具有荧光素偶联的CD14、CD163 流式抗体5 μL,混匀后,室温下避光孵育30 min,PBS 清洗2 次后,加入500 μL 的PBS(含1% BSA)对细胞进行重悬,经过滤后上机。
2.4 RT-PCR 法检测Arg-1、CCL22 在巨噬细胞中的表达
收集各组巨噬细胞,提取总RNA,BCA 法测定浓度,按反转录试剂盒说明书进行RNA 反转录cDNA,反转录条件:37 ℃、30 min,85 ℃、20 s。然后以cDNA 为 模 板,GAPDH 为 内 参 基 因,SYBR Green PCR 试剂盒扩增Arg-1、CCL22,扩增条件:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火30 s,共40个循环。每组设置3 个复孔,目的基因相对表达量用2-ΔΔCt计算。 基因引物序列见表1。

表1 各基因引物序列
2.5 Transwell 法检测HCT116 细胞侵袭转移能力
Matrigel 胶与无血清培养基按1∶2 稀释后,每个小室铺胶60 μL,置于37 ℃培养箱内60 min,使胶凝固制备Transwell 小室,然后每个小室加70 μL基础培养基,37 ℃、30 min 水化基底膜。 将各组HCT116 细胞用无血清基础培养基(含5 g/L BSA)制成细胞悬液,调整细胞密度为1×105/mL,吸取100 μL加入到小室上室内,下室加入佛波酯处理24 h 的对数生长期的THP-1 巨噬细胞,培养24 h。 取出上室,放到装有PBS 的新孔中,上室PBS 洗3 遍,用棉球擦干净上室细胞,用4%多聚甲醛固定20 min,将膜取下。 0.1%结晶紫染色5 min,水洗5 次,置膜于载玻片上,显微镜下观察并拍照。
2.6 Western blot 法检测HCT116 细胞中E-cadherin、Vimentin、MMP-9 表达
收集各组HCT116 细胞,加200 μL RIPA 裂解液和1% PMSF 提取细胞总蛋白,BCA 法蛋白定量后上样SDS-PAGE 电泳,PVDF 转膜,5% BSA 封闭60 min,剪取对应蛋白条带分别加入E-cadheri(稀释比例1∶2000)、Vimentin(稀释比例1∶2000)、MMP-9(稀释比例1∶1000)和β-actin(稀释比例1∶2500)一抗,4 ℃孵育过夜,TBS-T 洗3 次,将稀释后的二抗(用封闭液稀释HRP 标记的二抗,稀释比例1∶5000)与膜共同孵育2 h,TBS-T 洗3 次×5 min,ECL 显影。 将各条带用Image J 软件进行灰度扫描并以βactin 为内参计算各组平均值。
2.7 统计学方法
3 结果
3.1 巨噬细胞诱导与极化
人单核巨噬细胞THP-1 形态饱满,大小均一,为单独生长的悬浮细胞(图1A),采用佛波酯刺激THP-1 细胞24 h 后,光镜下观察到大部分细胞仍呈圆形或椭圆形,但细胞大小较诱导前缩小,贴壁较紧(图1B)。CD14 作为人巨噬细胞特异性标记物,用以检测单核巨噬细胞的分化效率。据流式细胞术检测结果可知,佛波酯处理后的细胞促进CD14的蛋白表达(图1C、1D),说明THP-1 细胞被成功诱导成M0 型巨噬细胞。 IL-4 诱导巨噬细胞M0(见图2A)极化为M2 型(流式细胞术检测标志物CD163),光镜下观察到大部分细胞仍呈椭圆形,贴壁较紧,且易成团生长(图2B)。 据流式细胞术检测结果可知,IL-4 处理后的细胞CD163 蛋白表达升高(图2C、1D),说明IL-4 能诱导巨噬细胞M0 型极化成M2型。

图1 THP-1 细胞诱导成M0 型巨噬细胞
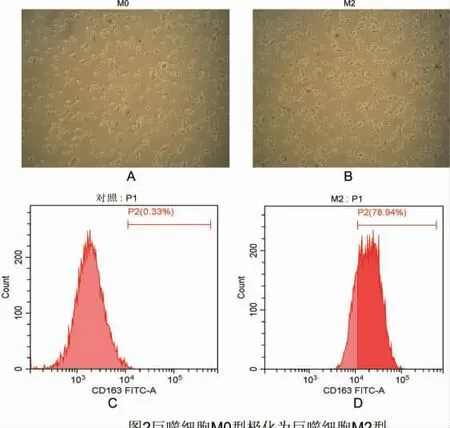
图2 巨噬细胞M0 型极化为巨噬细胞M2 型
3.2 健脾消癌方对巨噬细胞中CCL22、Arg-1 mRNA 表达的影响
与空白血清对照组比较,健脾消癌方含药血清组CCL22、Arg-1 表达水平显著降低(P<0.05);IL-4+空白血清组及IL-4+健脾消癌方含药血清组CCL22、Arg-1 表达水平显著增加(P<0.01)。 与IL-4+空白血清组比较,IL-4+健脾消癌方含药血清组CCL22、Arg-1 表达水平显著降低(P<0.01)。 详见图3。
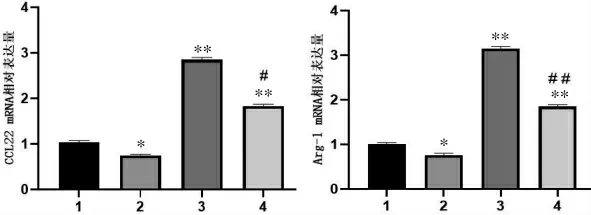
图3 各组巨噬细胞中Arg-1、CCL22 mRNA 表达
3.3 健脾消癌方对HCT116 细胞侵袭转移能力的影响
Transwell 小室穿膜细胞的数量反映肿瘤细胞的体外侵袭转移能力。与空白血清对照组比较,健脾消癌方含药血清组及IL-4+健脾消癌方含药血清组HCT116 细胞的侵袭数量明显减少(P<0.01);L-4+空白血清组细胞共培养体系中HCT116 细胞的侵袭数量显著增加(P<0.01)。与IL-4+空白血清组比较,IL-4+健脾消癌方含药血清组HCT116 细胞的侵袭数量降低(P<0.01)。 详见图4。
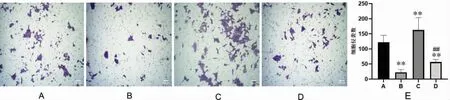
图4 各组HCT116 细胞侵袭数量
3.4 健脾消癌方对HCT116 细胞E-cadherin、Vimentin、MMP-9 蛋白表达的影响
与空白血清对照组比较,健脾消癌方含药血清组HCT116 细胞中Vimentin 蛋白表达降低,而Ecadherin 蛋白表达升高(P<0.05);L-4+空白血清组及IL-4+健脾消癌方含药血清组HCT116 细胞中Vimentin、MMP-9 蛋白表达增加,而E-cadherin 蛋白表达降低(P<0.01)。 与IL-4+空白血清组比较,IL-4+健脾消癌方含药血清组HCT116 细胞E-cadherin 蛋白表达升高,Vimentin、MMP-9 蛋白表达降低(P<0.05)。详见图5。
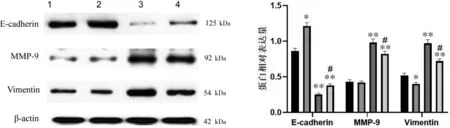
图5 各组HCT116 细胞E-cadherin、Vimentin、MMP-9 蛋白表达
4 讨论
目前,CRC 仍然是严重危害全球的公共健康难题,其发病率和死亡率均位居癌症前三[1]。从临床来看,肿瘤细胞往往通过营造独特的肿瘤微环境来逃避免疫监视[7]。 肿瘤微环境中高乳酸、缺氧等可以促进TAM 的浸润或募集,TAM 能够整合肿瘤微环境中的不同信号形成两种相反的极化状态,不同极化类型的巨噬细胞能够表达不同的细胞因子、酶类以及细胞表面标志物。 根据功能和表型的不同,巨噬细胞大致可分为M1 型和M2 型两类[8]。
M2 型巨噬细胞能抑制局部免疫,促进肿瘤免疫逃逸和进展。 GORDON 等[9]发现,在人类CRC 中,M2 型巨噬细胞可以高表达PD-1,而PD-1 抑制了T细胞的抗肿瘤功能和巨噬细胞的吞噬功能,发挥免疫抑制作用,促进肿瘤的发展。 M2 型巨噬细胞不但能导致免疫抑制,还能促进肿瘤转移[10]。研究证实,结肠癌中M2 型巨噬细胞可以通过释放各种趋化因子、促炎因子和生长因子来促进转移[11]。WAHAB 等[12]认为,CRC 微环境中大量浸润的巨噬细胞在IL-4、IL-13 等多种因子诱导作用下分化为M2 型的TAM,若可以阻断相关因子,将有助于免疫治疗取得成功。
中医药防治肿瘤具有独特优势,中医药能够系统调控机体,抗肿瘤复发转移,减少手术并发症,减轻放射治疗(简称“放疗”)、化学药物治疗(简称“化疗”)、分子靶向治疗等所致毒副反应,发挥协同增敏作用,改善肿瘤患者临床症状,提高生存质量,延长生存期,从而提高临床获益率[13-15]。 蒋益兰教授经过长期临床实践,凝练总结出CRC 主要由“脾虚、瘀积、岩毒”所致[16]。正气亏虚是大肠癌发病的内因,而脾为“后天之本”“气血生化之源”,脾虚则肠癌“留著于脉,稽留而不去,息而成积”,是CRC 的“病复”(复发)和“传舍”(转移)的病机主线。 蒋益兰教授以“健脾益气,化瘀解毒”为防治CRC 术后复发转移的基本治法,拟定防治CRC 复发转移的经验方健脾消癌方。 加之手术创伤、放疗、化疗导致的损伤等影响,CRC 患者多会出现CD4+、CD8+、CD4+/CD8+及免疫球蛋白水平下降[17],细胞免疫功能降低,免疫调节机制紊乱,免疫抑制占优势,消化道局部免疫功能低下[18]。 本研究以CRC 肿瘤微环境为切入点,探讨健脾消癌方对TAM 极化的调控作用,为健脾抗癌中药的临床应用提供实验依据。
临床研究显示,健脾消癌方联合化疗,治疗晚期转移性CRC 可提高患者疾病控制率,延长晚期CRC 患者的无进展生存期和总生存期,并能减轻化疗所致不良反应、提高患者生活质量、有效降低肿瘤标志物[5-6]。 前期实验研究表明,健脾消癌方可有效拮抗CRC 转移[19-24]。 本研究通过Transwell 法构建HCT116 细胞与M0 型巨噬细胞共培养体系,探讨健脾消癌方调控巨噬细胞M2 极化对HCT116 细胞侵袭转移能力的影响。 研究结果显示,M2 型巨噬细胞能够通过下调HCT116 细胞E-cadherin 表达,上调Vimentin、MMP-9 表达而促进HCT116 细胞侵袭数量,健脾消癌方能下调巨噬细胞M2 型极化相关基因CCL22、Arg-1 表达,上调HCT116 细胞E-cadherin表达,下调Vimentin 表达,抑制HCT116 细胞侵袭数量,表明健脾消癌方能一定程度上抑制巨噬细胞M2极化,阻断HCT116 细胞上皮间质转化进程,而抑制CRC 细胞侵袭转移能力。本研究为健脾消癌方拮抗CRC 提供进一步的理论依据和实验依据。关于健脾消癌方如何抑制巨噬细胞M2 极化需要进行下一步调控机制的深入研究。

