联二萘酚酰基硫脲催化下吲哚衍生物的高效合成
杨兰西,安雪婕,黄克俊,陈治明
(贵州师范大学 化学与材料科学学院 贵州省功能材料化学重点实验室,贵州 贵阳 550001)
0 引言
吲哚骨架是最重要的结构基序之一,广泛分布于许多天然产物、药物分子、农药和功能材料中[1-2],具有抗癌、抗菌、抗病毒、抗疟疾、抗抑郁、抗胆碱酯酶、抗血小板和抗糖尿病等多种药理活性[3-6]。同时作为常见生物活性分子的手性前体而在有机合成中有着极其重要和广泛的应用,如用于螺旋杆菌[7],靛蓝[8],奥卡拉明[9]等天然产物的全合成。鉴于吲哚骨架的巨大潜力,开发功能化吲哚化合物的合成方法很有意义,并且已经开发了许多有效的反应来合成手性吲哚衍生物。2009年,Hsieh等[10]用过渡金属钯催化吲哚与硝基烯烃的Friedel-Crafts烷基化反应获得了吲哚衍生物。松香酸-硫脲络合物催化[11]、BINOL磷酸催化[12]、双恶唑啉催化[13]、双恶唑啉与金属协同催化[14]、双咪唑吡啶催化[15]、尿素与金属有机骨架结合催化[16]、尿素与酸协同催化[17]、方酰胺催化[18-19]、手性磷酸电催化[20]、磺酰胺催化[21]等多种手性催化剂也被开发且应用于含吲哚支架的化合物的合成。尽管这些合成策略催化效率高和对映选择性好,但存在催化剂合成困难、反应条件复杂、需使用昂贵且污染环境的过度金属等问题。因此,开发一种简单、高效、经济、环保的方法用于吲哚衍生物的合成仍然是重要的研究方向。
本文设计合成了多种多功能联二萘酚硫脲氢键型手性催化剂,用于催化C3位具有较高的亲核性的苯并吡咯与亲电供体硝基烯烃的不对称Friedel-Crafts烷基化反应,高效合成了12种吲哚衍生物。该类催化剂中阻转异构体C2轴手性联二萘酚骨架上特殊的空间结构、电子性质以及硫脲和酚羟基上氢键的催化作用使合成的吲哚衍生物具有良好的收率(高达91%)和对映选择性(高达93%ee)。该合成策略操作简单、反应条件温和、催化剂高效且用量少(仅需10 mol%)、底物具有很好的官能团耐受性。
1 实验部分
1.1 实验主要反应试剂和仪器
RE-52旋转蒸发仪(上海泸西分析仪器厂有限公司);DRX型400MHz核磁共振仪、UHR TOF LC型超高分辨飞行时间质谱(德国Bruker公司);Perkin Elmer Frontier型红外光谱仪、WZZ-1型旋光仪(美国Perkin Elmer公司);X-6型熔点测定仪(北京泰克仪器有限公司);RE53-3型气相色谱仪(上海天美有限公司)。
实验所用试剂均为市售分析纯级。
1.2 联二萘酚硫脲催化剂1a~1c的合成
在100 mL反应瓶中加入的2 mmol (R)-3,3′-二羧酸-1,1′-联萘酚(合成方法参考文献[22-23])和2 mL亚硫酰氯于适量三氯甲烷中溶解,在70 ℃下回流8 h至气体完全逸出,旋蒸除去过量亚硫酰氯和溶剂,即得到R型的联二萘酚酰氯。往R型的联二萘酚酰氯中滴加30 mL二氯甲烷溶解,加入2 mmol硫氰酸钾、20滴聚乙二醇反应6 h,旋蒸除去溶剂即得到异硫氰双酯。往异硫氰双酯中滴加20 mL四氢呋喃溶解,滴加2 mmol 1-(4-甲氧基苯基)乙胺后充入氮气后密封,在冰浴0 ℃的条件下反应18 h,TLC检测反应完成,旋蒸除去溶剂,柱层析纯化(洗脱剂为V(石油醚)∶V(乙酸乙酯)=10∶1),即可得催化剂1a,产率68%,与前面合成方法相同,分别滴加1-(4-氟苯基)乙胺和2-噻吩乙胺后即可制得催化剂1b和1c,产率分别为65%和71%(图1)。
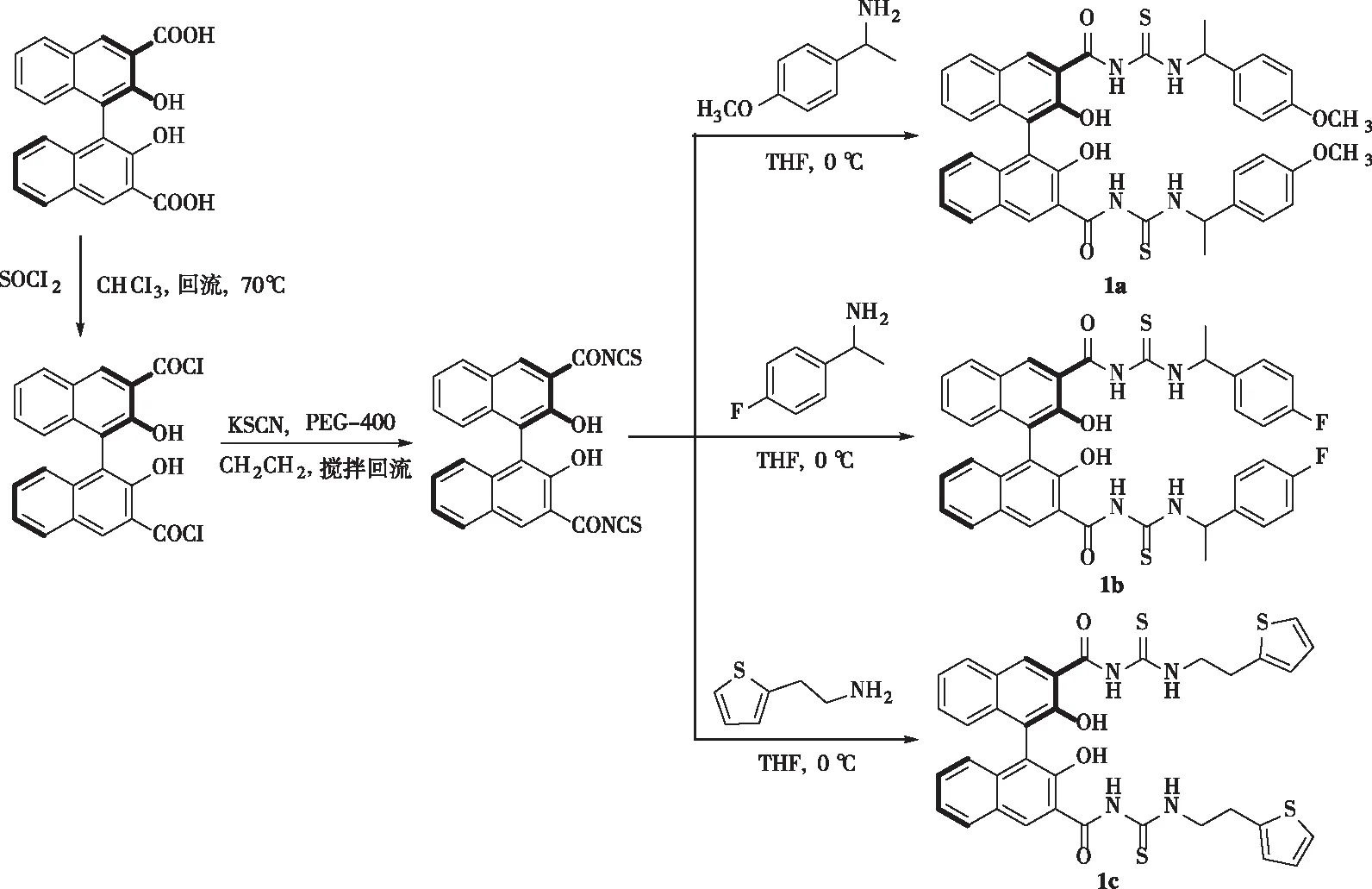
图1 催化剂1a~1c的合成Fig.1 Synthesis of catalysts 1a~1c
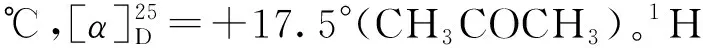
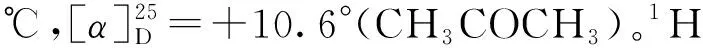
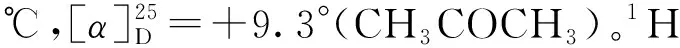
1.3 手性吲哚化合物4a~4l的合成
将0.1 mmol吲哚置于50 mL反应瓶中,加入5 mL二氯甲烷做溶剂,在室温下加入0.01 mmol催化剂1a搅拌溶解,后添加0.1 mmol硝基苯乙烯并升温至35 ℃下反应,TLC跟踪反应至完全。将5 mL饱和氯化铵溶液和5 mL乙酸乙酯加入反应液中进行萃取,用适量乙酸乙酯萃取水相2~3次,将有机相合并,用无水硫酸镁干燥后旋蒸出溶剂,柱层析纯化分离(洗脱剂为V(石油醚)∶V(乙酸乙酯)=7∶1),得目标产物4a,分别用取代基不同的吲哚和硝基苯乙烯按照类似的方法合成目标产物4b~4l(图2)。
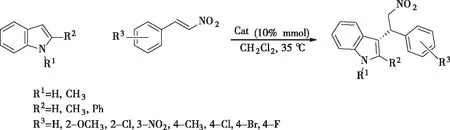
图2 目标产物4a~4l的合成Fig.2 Synthesis of target products 4a~4l
2 结果与讨论
2.1 催化剂及用量的筛选
以吲哚2a、硝基苯乙烯3a为底物,CH2Cl2为溶剂,35 ℃下反应18 h,考察了3种结构不同的联萘酚酰基硫脲催化剂的催化能力和催化剂的最佳用量,其结果见表1。
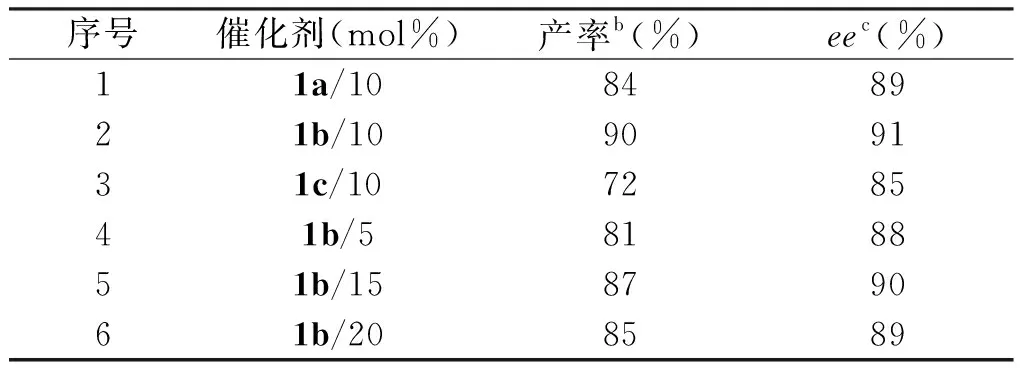
表1 催化剂及用量研究aTab.1 Study on catalyst and dosagea
由表1可知,3种氢键型手性催化剂联二萘酚酰基硫脲都能有效催化吲哚2a和硝基苯乙烯3a的不对称Friedel-Crafts烷基化反应,苯环上连有氟的酰基硫脲1b催化剂能以90%的收率和91%的ee值获得吲哚衍生物,苯环上甲氧基取代的手性酰基硫脲催化剂1a和连有噻吩的酰基硫脲催化剂1c也能分别以84%、89%的收率和72%、85%的ee值获得目标产物4a。催化剂1b的苯环上连有的氟是吸电子基团,强吸电子效应使催化剂的氢键与底物结合的能力增强,提高了催化效率,能以最高的收率(90%)和ee值(91%)获得手性吲哚衍生物,因此确定手性催化剂1b为该反应的最佳催化剂。在此基础上对催化剂1b的用量进行了筛选,当用量为10 mol%时其产率和ee值都达到了最高值。
2.2 反应条件的筛选研究
以吲哚2a、硝基苯乙烯3a为底物,10 mol%手性酰基酰基硫脲1b为催化剂,探讨该反应的最佳反应溶剂、温度和时间,其结果见表2。
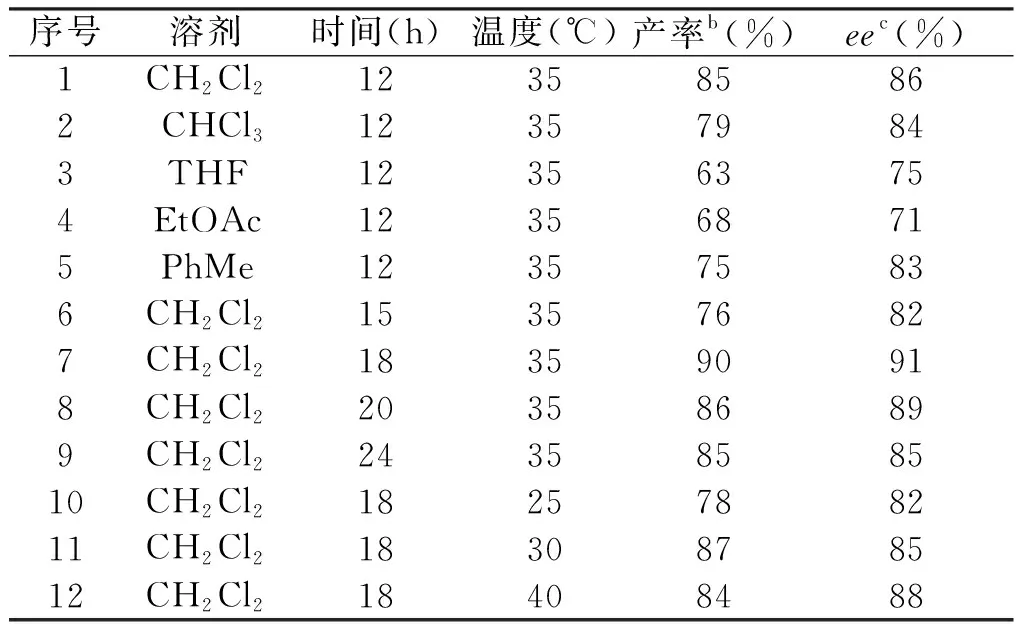
表2 吲哚2a和硝基苯乙烯3a不对称反应的条件筛选研究aTab.2 Condition screening study of asymmetric reaction between indole 2a and nitrostyrene 3aa
在35 ℃和12 h条件下对不同溶剂进行筛选,表2中显示,在甲苯、二氯甲烷、氯仿3种较低极性的溶剂产物4a都能以中等偏上的产率(75%~85%)和ee值(83%~86%)获得,在二氯甲烷中反应能达到最高的产率(85%)和ee值(86%),而在极性相对较大的乙酸乙酯和四氢呋喃溶剂中反应效果不是很理想,仅能得到63%和68%的收率和75%和71%的ee值,可能原因是该反应适合在较低极性的溶剂下反应,且底物和催化剂在二氯甲烷中的溶解性最好,因此溶剂选择为二氯甲烷。后对时间和温度进行了筛选,在35 ℃下反应18 h,目标产物吲哚能以90%的收率和91%的ee值获得,低于或高于该温度和时间,其催化性能都降低。最终筛选出以10 mol%酰基硫脲1b为催化剂、CH2Cl2为溶剂、35 ℃下反应18 h为合成手性吲哚衍生物的最佳反应条件。
2.3 反应底物的扩展
在10 mol%催化剂1b、二氯甲烷为溶剂、35 ℃下反应18 h的最佳反应条件下,对吲哚和硝基苯乙烯的反应底物进行了扩展,共扩展得到12种手性吲哚衍生物,如表3所示。
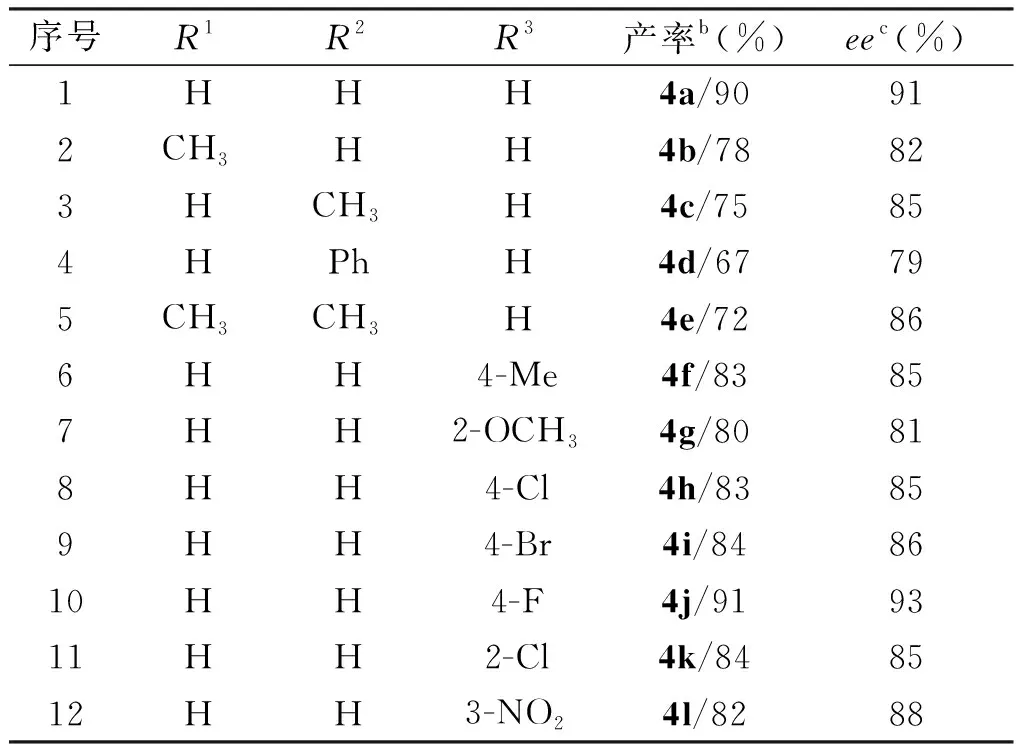
表3 吲哚2和硝基苯乙烯3之间的不对称反应aTab.3 Asymmetric reactions between indole 2 and nitrostyrene 3a
从表3中可知,该反应的底物适应性良好,能以67%~91%的产率、79%~93%的ee值获得目标产物。氮原子无保护的吲哚比氮甲基保护吲哚的收率和ee值相对高,可能原因是甲基的给电子效应使吲哚环上的电子密度受影响而降低了反应活性,且吲哚环上2连有甲基等供电子时,由于电子效应和空间位阻的双重影响也会使目标化合物的产率和ee值下降。对于硝基苯乙烯,苯环上对位连有吸电子基的底物比含有给电子基团的底物产率高,可能原因是硝基苯乙烯作为潜在的亲电受体,苯环上的吸电子基团导致硝基苯乙烯的反应活性增加而得到更高的产率,而取代基的位置对反应的收率影响较小,无论是邻位、间位还是对位都能得到中等偏上的收率。
2.4 化合物的数据分析
4a:白色固体,产率90%,91%ee。1H NMR (400 MHz,CDCl3),δ:8.67 (s,1H),7.52 (t,J=8.4 Hz,1H),7.41 (d,J=9.8 Hz,1H),7.36~7.30 (m,4H),7.26 (t,J=12.0 Hz,1H),7.21(t,J=10.6 Hz,1H),7.17~7.06 (m,2H),5.18 (m,1H),4.93 (dd,J=10.6 Hz,1H),4.54 (m,1H)。13C NMR(100 MHz,CDCl3),δ: 139.83,137.02,129.15,128.20,127.94,124.07,123.25,122.08,120.35,119.33,115.10,112.24,80.18,42.12。IR(KBr),v(cm-1) :1 638.26,1 549.73,1 385.44,689.20。对映异构体过量测定的色谱条件:手性柱为Chiralpak OD-H柱,流动相为V(正己烷)∶V(异丙醇)=80∶20,流速为1.0 mL/min,波长为254 nm(下同);tR=9.6 min、14.1 min(主峰)。
4b:白色固体,产率78%,82%ee。1H NMR (400 MHz,CDCl3),δ:7.60 (t,J=10.4 Hz,1H),7.47~7.32 (m,6H),7.28 (t,J=7.6 Hz,1H),7.21~6.94 (m,2H),5.18 (m,1H),4.97 (dd,J=12.8Hz,1H),4.43 (m,1H),3.80 (s,3H)。13C NMR(100 MHz,CDCl3),δ: 139.47,137.12,129.64,128.46,127.83,124.12,123.40,122.19,120.37,119.54,115.03,112.26,81.50,43.18,33.65。IR(KBr),v(cm-1) :1 618.34,1 556.65,1 384.81,735.52,702.73。tR=29.6 min、57.4 min(主峰)。
4c:淡黄色固体,产率75%,85%ee。1H NMR (400 MHz,CDCl3),δ:8.17 (s,1H),7.63 (t,J=8.0 Hz,1H),7.48~7.36 (m,6H),7.28 (t,J=13.4 Hz,1H),7.14 (t,J=11.8 Hz,1H),5.20~4.97 (m,2H),4.36 (m,1H),2.37(s,3H)。13C NMR(100 MHz,CDCl3),δ: 138.37,135.15,130.24,128.46,127.55,126.12,123.38,122.25,121.30,119.54,117.50,111.73,79.64,42.73,12.51。IR(KBr),v(cm-1) :1 619.50,1 554.40,1 384.75,738.83,899.20。tR=28.3 min、38.6 min(主峰)。
4d:黄色油状液体,产率 67%,79%ee。1H NMR (400 MHz,CDCl3),δ:8.43(s,1H),7.72 (d,J=12.0 Hz,1H),7.60~7.45(m,6H),7.38 (t,J=13.6 Hz,1H),7.36~7.17(m,4H),7.32~6.93 (m,2H),5.20 (m,1H),4.81 (dd,J=13.6 Hz,1H),4.25 (m,1H)。13C NMR(100 MHz,CDCl3),δ: 139.53,137.60,135.38,133.10,129.05,128.73,128.22,127.53,126.30,124.18,122.87,121.24,120.50 119.59,112.43,109.61,79.74,41.40,。IR(KBr),v(cm-1) :1 618.53,1 550.32,1 385.57,610.41。tR=19.9 min、22.9 min(主峰)。
4e:棕色油状液体,产率72%,86%ee。1H NMR (400 MHz,CDCl3),δ:7.62 (d,J=9.0 Hz,1H),7.57~7.38 (m,6H),7.28 (t,J=10.8 Hz,1H),7.20~6.94 (m,1H),5.14~4.97 (m,2H),4.50 (m,1H),3.48 (s,3H),2.50 (s,3H)。13C NMR(100 MHz,CDCl3),δ: 139.60,137.88,134.51,129.10,128.23,127.06,126.05,121.41,119.29,118.47,108.43,107.30,79.14,41.05,29.52,11.10。IR(KBr),v(cm-1) :1 619.46,1 548.40,1 384.73,744.52,613.18。tR=20.3 min、27.63 min(主峰)。
4f:白色油状液体,产率83%,85%ee。1H NMR (400 MHz,CDCl3),δ:8.35 (s,1H),7.58 (d,J=6.0 Hz,1H),7.46~7.38 (m,2H),7.24~7.08 (m,4H),7.04~6.97 (m,2H),5.17 (m,1H),4.90 (dd,J=12.0 Hz,1H),4.55 (m,1H),2.28 (s,1H)。13C NMR(100 MHz,CDCl3),δ: 139.47,137.20,134.51,132.81,128.10,126.33,125.14,123.25,119.08,116.26,114.34,110.37,80.50,42.12,22.04。IR(KBr),v(cm-1) :1 617.83,1 550.36,1 384.73,613.18。tR=9.5 min、13.9 min(主峰)。
4g:黄色油状液体,产率80%,81%ee。1H NMR (400 MHz,CDCl3),δ:8.31 (s,1H),7.60 (d,J=6.8 Hz,1H),7.48 (t,J=10.2 Hz,1H),7.26~7.17 (m,5H),7.12~6.95 (m,2H),5.17~4.90 (m,2H),4.48 (m,1H),3.69 (s,1H)。13C NMR(100 MHz,CDCl3),δ: 144.31,138.75,135.50,129.72,128.98,126.05,124.38,122.03,120.25,118.51,117.42,116.60,112.54,110.49,81.36,43.45,36.61。IR(KBr),v(cm-1) :1 618.91,1 558.05,1 385.48,617.30。tR=13.2 min、19.8 min(主峰)。
4h:白色固体,产率83%,85%ee。1H NMR (400 MHz,CDCl3),δ:8.27 (s,1H),7.63 (d,J=6.0 Hz,1H),7.46 (t,J=8.4 Hz,1H),7.38~7.32 (m,2H),7.28~7.21 (m,2H),7.18~6.97 (m,4H),5.09 (m 1H),4.93 (dd,J=10.6 Hz,1H),4.48 (m,1H)。13C NMR(100 MHz,CDCl3),δ: 139.61,138.55,135.68,131.71,129.33,128.30,123.55,120.08,119.34,117.22,114.37,111.05,80.38,40.23。IR(KBr),v(cm-1) :1 617.53,1 554.88,1 384.90,745.12,669.25。tR=9.5 min、14.0 min(主峰)。
4i:白色固体,产率84%,86%ee。1H NMR (400 MHz,CDCl3),δ:8.24 (s,1H),7.57 (d,J=8.6 Hz,1H),7.45 (d,J=6.0 Hz,1H),7.38~7.35 (m,2H),7.30~7.22 (m,2H),7.18~6.96 (m,4H),5.10 (m,1H),4.88 (m,1H),4.31 (m,1H)。13C NMR(100 MHz,CDCl3),δ: 138.97,137.62,133.51,130.53,127.75,124.70,122.14,120.98,120.21,117.90,114.07,111.84,80.83,41.46。IR(KBr),v(cm-1) :1 618.88,1 569.21,1 383.44,618.63。tR=9.1 min、13.8 min(主峰)。
4j:白色固体,产率91%,93%ee。1H NMR (400 MHz,CDCl3),δ:8.13 (s,1H),7.52 (d,J=7.8 Hz,1H),7.39 (t,J=6.4 Hz,1H),7.30~7.21 (m,4H),7.15 (t,J=8.0 Hz,2H),7.10~6.93 (m,2H),5.11 (m,1H),4.85 (m,1H),4.24 (m,1H)。13C NMR(100MHz,CDCl3),δ: 160.12,138.83,136.15,134.40,132.32, 128.71,123.23,121.04,119.60,117.32,115.51,111.75,40.57。IR(KBr),v(cm-1) :1 617.93,1 560.24,1 382.60,743.32。tR=12.0 min、21.3 min(主峰)。
4k:棕色油状液体,产率84%,85%ee。1H NMR (400 MHz,CDCl3),δ:8.22 (s,1H),7.75 (d,J=8.6 Hz,1H),7.60~7.48 (dd,J=12.0 Hz,2H),7.37~7.28 (m,3H),7.17 (t,J=8.2 Hz,2H),7.11~6.89 (m,2H),5.09 (m,1H),4.82 (m,1H),4.19 (m,1H)。13C NMR(100 MHz,CDCl3),δ: 139.87,137.05,133.22,132.40,129.43,128.68,127.10,126.15,124.06,121.17,119.43,117.59,115.72,111.73,81.87,40.57。IR(KBr),v(cm-1) :1 629.86,1 557.46,1 382.28,743.60。tR=12.6 min、22.6 min(主峰)。
4l:黄色油状液体,产率82%,88%ee。1H NMR (400 MHz,CDCl3),δ:8.30 (s,1H),7.76~7.70 (m,1H),7.61 (dd,J=10.8 Hz,2H),7.55~7.43 (m,2H),7.19 (s,1H),7.12~7.05 (m,1H),7.01~6.84 (m,2H),5.12 (m,1H),4.87 (m,1H),4.15 (m,1H)。13C NMR(100 MHz,CDCl3),δ: 147.81,141.24,139.77,136.53,133.26,129.55,124.17,124.02,121.73,121.10,119.45,118.58,115.39,111.60,81.42,41.47。IR(KBr),v(cm-1) :1 620.41,1 556.43,1 383.15,618.63。tR=9.6 min、14.1 min(主峰)。
3 结论
本文使用结构上下对称的氢键型多功能催化剂酰基硫脲催化吲哚和硝基烯烃的不对称Friedel-Craft反应,合成了12种手性吲哚衍生物。对反应条件进行了优化,实验表明:10 mol%手性酰基硫脲1b为催化剂,CH2Cl2为溶剂,35 ℃下反应18 h,以91%的收率、93%ee值获得吲哚衍生物。该反应底物范围广,有很好的普适性。该方案为在温和的反应条件下获得具有良好对映体过量值和底物范围的功能化氧化吲哚支架提供了途径。

