RNA甲基转移酶NSUN2的生物学功能及在肿瘤中的研究进展
张 群, 田秋思, 唐铖铖, 冯 光, 路宏朝
(陕西理工大学 生物科学与工程学院, 陕西 汉中 723000)
5-甲基胞嘧啶(m5C)是一种重要的RNA修饰,在真核细胞的核输出、转录稳定性和翻译启动中起着重要作用,从而调节细胞分裂和蛋白质合成。m5C可以被称为“写入者”(甲基转移酶)、“读取者”和“擦除者”(去甲基酶)的特定酶进行动态与可逆调节[1]。m5CRNA修饰由NOL1/NOP2/SUN结构域(NSUN)家族(NSUN1、NSUN2、NSUN3、NSUN4、NSUN5、NSUN6和NSUN7)以及DNA甲基转移酶(DNMT)同源物DNMT2催化,这些蛋白质以S-腺苷甲硫氨酸(SAM)为甲基供体,NSUN2能在mRNA上实施m5C修饰[2]。近年来,国内外许多研究对于NSUN2在肿瘤中的作用机制颇为关注,NSUN2的生物学功能也更进一步地被阐明。NSUN2对于肿瘤的细胞周期调控、细胞增殖、DNA损伤修复、耐药性等方面均具有重要的作用。本文旨在通过最近发表的研究结果对NSUN2的生物学功能及其在肿瘤中的作用作一综述。
1 NSUN2的生物学功能
1.1 NSUN2的m5C修饰功能
NSUN2可通过修饰靶基因上的m5C位点,发挥特定的生理功能。NSUN2可以对T淋巴细胞中白细胞介素17(interleukin 17,IL-17)mRNA上的m5C位点(C466胞嘧啶)进行修饰,提高其翻译效率促进蛋白表达,进而发挥免疫调控的功能[3]。此外,NSUN2亦可以参与ICAM-1(intercellular adhesion protein-1)mRNA中7个位点的m5C修饰,通过提高ICAM-1的蛋白表达量,促进血管内皮细胞的粘附能力[4]。
NSUN2最初被认为是一种典型的tRNA甲基转移酶。然而进一步的研究发现NSUN2与细胞增殖、干细胞分化、睾丸分化和人类癌症的特异性相关,表明NSUN2可能对tRNA及之外的其他RNA种类进行了甲基化。如:
(1)对tRNA修饰,表现为神经元NSUN2缺失产生tRNA转录组改变和蛋白质组改变,影响突触信号和行为[5];
(2)对mRNA的修饰,表现为NSUN2修饰疟原虫的5甲基胞嘧啶可稳定mRNA并介导配子体的发育[6];
(3)对vtRNA的修饰,表现为VTRNA1.1中第69位胞嘧啶的甲基化现象在人类细胞中频繁发生,且仅由NSUN2介导,决定了VTRNA1.1的加工过程为小VTRNA(svRNAs),以及对microRNA的一些其他修饰作用等[7]。
1.2 NSUN2调控细胞的增殖分化
哺乳动物的细胞分裂周期受到细胞周期调控因子的严格控制,并且细胞周期进程伴随着相应调控因子的表达水平而发生改变。NSUN2,也称为Myc诱导的含SUN结构域的蛋白,是一种核仁RNA甲基转移酶,Myc是控制细胞生长和增殖的关键转录因子之一[8]。Myc通过降低抑制细胞生长的基因表达来促进细胞分裂周期的进展(例如:p21/CDKN1A、p15/CDKN2B、p27KIP1/CDKN1B、GADD34、GADD45和GADD153),并通过诱导促进细胞生长的基因如细胞周期蛋白D1(CCND1)、细胞周期蛋白依赖性激酶(CDK4和CDK2)的表达,从而影响细胞周期的进程。Michaela Frye和Fiona M.Watt[9]首先发现NSUN2在细胞周期中的作用,NSUN2的表达在Myc激活时升高,在G1期水平最低,在S期水平最高。此外,NSUN2还可在有丝分裂中修饰纺锤体,对纺锤体的正确组装至关重要。在另一项研究中,NSUN2被描述为Aurora-B蛋白激酶的底物,该酶使NSUN2的Ser139位点磷酸化[10]。在有丝分裂期间,磷酸化的Aurora-B对NSUN2的RNA甲基转移酶活性和核仁RNA的组装都有抑制作用,可能的机制是在细胞有丝分裂时NSUN2与NPM1的关联受到抑制,因为正常情况下具有Aurora-B磷酸化突变位点(S139A)的NSUN2与NPM115存在结构性关联。有研究表明NSUN2还可以通过甲基化p16INK4/CDKN2A mRNA的3’UTR稳定p16的mRNA,从而导致氧化应激细胞中p16水平的升高[11]。最近的一项研究发现NSUN2可以在C1733(m5C)处对CDK1mRNA的3’UTR进行甲基化[12],具体机制表现为NSUN2甲基化CDK1可以通过增加核糖体在CDK1的mRNA上的组装来增强CDK1mRNA的翻译,这反过来又提高了CDK1的翻译并促进了细胞增殖。另一方面,NSUN2通过C64(m5C)上p27mRNA的5’UTR甲基化抑制了p27的翻译。以上实验结果均表明NSUN2是调控细胞增殖的关键蛋白,具体调控机制总结见图1。
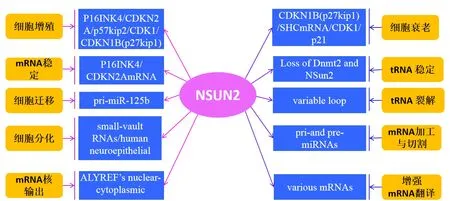
图1 NSUN2的生物学功能
2 NSUN2与肿瘤
近年的研究表明,NSUN2不仅能够调控干细胞增殖分化,同时可以稳定细胞纺锤体。而在肿瘤细胞中,NSUN2也可以通过稳定分裂期纺锤体而促进细胞分裂。特别在食道癌、结肠癌、胃癌、胰腺癌、肝癌、胆囊癌和乳腺癌细胞的增殖过程中发挥重要功能[13]。这些研究分析表明,NSUN2对维持肿瘤干细胞更新和分化之间的动态平衡有着至关重要的作用[14]。且NSUN2在多种癌组织中表达上调,如图2所示。UALCAN数据库[15]分析结果显示NSUN2在多种肿瘤与正常组织间差异表达,其中在肺腺癌与正常肺组织间的表达差异尤其显著(见图2)。
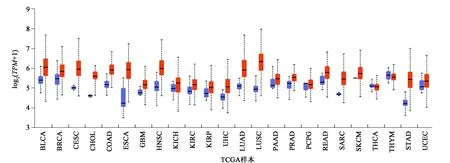
图2 使用UALCAN评估的NSUN2泛癌表达(正常与肿瘤)
2.1 NSUN2与肝癌
肝癌是一种常见的恶性肿瘤,死亡率较高。我们目前研究的目的是发现可以控制肝癌进展的分子策略。研究表明,RNA甲基转移酶参与了细胞凋亡、增殖的调控,并与肿瘤的发生发展密切相关[16-17]。Zhai Chun-tao等[18]的研究表明,下调NSUN2可有效抑制肝癌细胞的细胞活力和增殖,并诱导细胞周期阻滞和凋亡。这些数据表明,NSUN2可能调节肝癌的发生和发展,过表达FZR1可以抑制NSUN2诱导的细胞增殖抑制。可以通过敲低NSUN2降低FZR1水平来抑制裸鼠肝癌的生长。这一发现不仅揭示了NSUN2在肝癌生长中的作用,而且也为肝癌治疗提供了一个很有前途的靶点。
黄奕芝团队[19]的研究发现NSUN2通过甲基化PRPS2和ADSL等基因的mRNA,稳定其表达,参与调控核苷酸代谢通路,促进肝癌增殖的发生发展。然而,该研究中NSUN2对PRPS2 mRNA的甲基化,是通过在HEK293中进行重亚硫酸盐测序的结果猜测的,要确认肝癌细胞中NSUN2甲基化PRPS2,还需要对肝癌细胞进行重亚硫酸盐测序或进行m5CIP实验,给出更直接可靠的证据。
最近的一项研究表明,NSUN2可以甲基化肝癌细胞的H19lncRNA,并影响其稳定性。基于NSUN2的存在,Ras-Gtpase激活蛋白结合蛋白1(G3BP1)被证实与甲基化的H19RNA结合[20]。在最近的许多研究中,H19被确定为一种Onco-lncRNA,并促进肿瘤发生,如胶质母细胞瘤[21]、结直肠癌[22]和胃癌[23]。在HepG2细胞中,H19RNA在C986位点被甲基化,在NSUN2干扰后,这种甲基化完全消失。
2.2 NSUN2与咽鳞状细胞癌
与其他头颈部鳞状细胞癌(HNSCCs)[24-25]相比,下咽鳞状细胞癌(HPSCC)是恶性程度比较高的肿瘤之一,占所有颈部鳞状细胞癌[26-27]的3%~4%。大多数患者在晚期被诊断为HPSCC[28],预后较差。HPSCC肿瘤发生和行为的分子机制尚不完全清楚。因此,更好地了解这些因素可能会导致改善HPSCC的诊断和治疗。
Chen Li-xiao等[29]的研究证明头颈部鳞状细胞癌中NSUN2修饰了TEAD1的3’-UTR,TEAD1是一种参与了许多癌症的致癌基因,NSUN2介导的TEAD1 mRNA的m5C甲基化是一种与HNSCC起始和进展相关的新机制。
2.3 NSUN2与食管鳞状细胞癌
食管鳞状细胞癌(ESCC)是最恶性的癌症之一,五年生存率仅为19%[30-31]。由于缺乏有效的治疗方法[32],大多数ESCC患者最终死于癌症进展。因此,迫切需要进一步阐明ESCC的综合分子机制,以开发更有效的ESCC诊断和治疗干预措施。
有研究表明,E2F转录因子1(E2F1)与NSUN2的启动子结合并增强其表达,在ESCC中可以显著增加生长因子受体结合蛋白2(GRB2)中m5C的形成[33]。RNA结合蛋白lin-28同源物B(LIN28B)作为m5C中介,优先与m5C修饰的GRB2结合并增强其稳定性。GRB2的上调可诱发了致癌的PI3K/AKT和ERK/MAPK信号通路。
2.4 NSUN2与胃癌
胃癌是最常见的胃肠道肿瘤。尽管手术技术和患者管理都有了改善,但五年总生存率的改善并不显著,胃癌进展的分子机制尚不清楚。因此,更好地了解肿瘤的形成和诊断标志物,将提高胃癌的诊断和治疗。
既往研究表明,RNA甲基化酶在调节mRNA的衰减、翻译和加工中发挥潜在作用[34]。在Mei Lin等[35]的研究证实了RNA甲基转移酶NSUN2可以在胃癌中影响p57Kip2mRNA的稳定性。通过m5CRIP和qRT-PCR检测发现,m5C抗体显著富集了p57Kip2mRNA的3’-UTRmRNA和敲除NSUN2降低了p57Kip2mRNA的m5C水平,表明NSUN2主要甲基化p57Kip2的mRNA3’-UTR,导致p57Kip2下调。此外进一步的研究发现RNA甲基转移酶NSUN2的不同功能机制取决于m5C修饰后甲基化的位置[36-38]。
2.5 NSUN2与乳腺癌
一些研究[39-40]已经报道了NSUN2在乳腺癌细胞中的过表达,但其潜在的机制仍不清楚。研究表明,肿瘤的发生与调节细胞增殖、细胞死亡和基因组不稳定性[41]的基因和蛋白质的遗传和表观遗传改变的逐步积累有关。Yi Jie等[42]在NSUN2启动子区域发现了一个156 bp长的CpG岛,并且该启动子在乳腺癌组织中被低甲基化。进一步在乳腺癌组织中验证,NSUN2启动子区域的频繁低甲基化,即使是在低级别肿瘤中,也与乳腺癌和其他类型的肿瘤[43]中已知致癌基因的低甲基化频率相当。
2.6 NSUN2与其他癌症
m5C RNMTs的作用现在已经在其他几种癌症中被确定。在一项早期研究中,证实了NSUN2蛋白表达的升高,包括食管癌、胃癌、肝癌、胰腺癌、子宫颈癌、前列腺癌、肾脏癌、膀胱癌、甲状腺癌和乳腺癌[29]。在皮肤癌中,当比较肿瘤淋巴结转移(TNM)期正常皮肤和皮肤癌的蛋白表达水平时,NSUN2表达缺失与恶性肿瘤增加相关,并与肿瘤起始细胞的增加相关。在卵巢癌中因为NSUN2高表达和低IGF-II高表达的患者显著优于总体生存和无进展生存[44],所以认为NSUN2/IGF2的特征具有预后生存价值。最近一项关于头颈鳞状癌(HNSCC)的荟萃分析研究发现,NSUN2在肿瘤中上调了约2倍,这与缩短22个月的总生存期和更高的死亡风险相关[45]。此外,NSUN2的高表达与HNSCC中的T细胞激活有关。
在膀胱癌中,Y-Box结合蛋白1(YBX1)已被确定为m5C“阅读器”,并通过与Elav-Like结合蛋白1(ELAVL1)的相互作用,通过稳定肝癌衍生的生长因子(HDGF)来促进癌变。重要的是,NUSN2、YBX1和HDGF的高共表达被发现预测膀胱尿路上皮癌(UCB)[46]的生存率。
综上所述,NSUN2在食道癌、结肠癌、胃癌、肝癌、胆囊癌、乳腺癌等癌症中的作用机制汇总见表1。

表1 NOL1/NOP2/SUN结构域(NSUN2)在癌症中的表达和作用

续表
3 NSUN2的非肿瘤生物学功能
NSUN2功能丧失的突变个体提供为NSUN2介导的m5C在人类健康和疾病中的重要性提供了有力证据,分别表现为智力障碍、面部畸形和远端肌病[53-56]。在果蝇和小鼠[25,57]的研究中进一步验证了NSUN2缺乏导致神经系统异常的假设,其中包括敲低果蝇的NSUN2 (dNSUN2),后者会损害短期记忆。此外,具有NSUN2种系缺失的小鼠表现出运动活动和行为的各种损伤,以及由于产前大脑中过度细胞死亡而导致的大脑尺寸减小[25]。最近Shigematsu团队[58]发现NSUN2在阿尔茨海默病(AD)患者的大脑中失调,迄今为止对这些缺陷提出的机制是NSUN2消融后增加的tRNA碎片从而诱导的翻译受损。
最近,NSUN2已被证明可以甲基化线粒体tRNA[59],并且鉴于线粒体在涉及神经变性的神经系统疾病中的主要作用,可以不难推测出,如果在细胞核和线粒体环境中的m5C RNA甲基化缺陷也可能在神经疾病中发挥作用。
4 总结与展望
迄今已鉴定出150多个RNA转录后修饰,广泛分布于各类RNA上,包括mRNA、tRNA、rRNA、小非编码RNA(SncRNA)和INcRNA。这些大量修改和多种RNA的多样性和广泛性突出了它们在调节生物学和疾病方面的巨大潜力。在此基础上,RNA表观遗传学(表观)修饰已被证明在组织发育和疾病的许多关键生理方面发挥着重要作用。尽管如此,在这个相对新兴的领域还有许多未知因素。
虽然NSUN2的主要靶点是tRNA,但仍不清楚NSUN2缺失的表型变化是由tRNA甲基化减少引起的,还是其他RNA底物也有助于观察到的表型。因此,我们需要开发创新的技术来精确操作表转录组和功能分析,从而了解它们对每个修饰RNA的动态作用机制,因为单个RNA修饰物的消耗可能不足以全面理解它们的作用。
另外,虽然很多研究显示,m5C相关调节因子和作用途径可作为癌症治疗中的新的靶点,但缺乏一定的临床实践,而m5C在许多方面都能影响基因的表达,其副作用也不可忽视。未来的工作,旨在深入研究m5C修饰中的“Writers”“Erasers”“Readers”参与疾病进程调节的分子机制,结合临床数据评估m6A与疾病的相关性,进一步增强我们对肿瘤恶性转化的理解,并有助于设计新的癌症治疗药物。

