豆类活性肽PA1b研究进展
黄欣媛,范红波
(1.湖北工程学院 湖北省植物功能成分利用工程技术研究中心,湖北 孝感 432000;2.湖北职业技术学院 医学基础部,湖北 孝感 432000)
提取自豌豆种子中的小分子多肽PA1b(Pea Albumin 1 Subunit b,豌豆白蛋白1b)[1]具有显著的昆虫毒性,能杀灭一些蚜虫和粮食储藏中的主要害虫象鼻虫,很有希望开发成新型生物杀虫剂。PA1b在其他豆科植物中也广泛分布,均具有高度紧缩的三维结构,构象非常稳定,不被杀菌剂变性,也耐受胃酸降解,是目前已知的少数几种口服活性的昆虫毒性肽之一。此外,PA1b还表现出激素样生理活性,参与调节植物生长发育,在哺乳动物中还能调节葡萄糖代谢,是一种重要的多功能生物活性肽。
1 PA1b的结构及其生物多样性
1.1 PA1b的结构
PA1b由37个氨基酸残基组成,分子内第3、7、15、20、22和32位均为半胱氨酸,形成三对二硫键(图1)。这些二硫键的三维排布是典型的抑制胱氨酸结(cystine knot inhibitor, ICK)结构模型(图2),这一结构赋予PA1b高度的稳定性,在煮沸、有机溶剂(如:甲醇、戊烷、乙醚乙酸酯、丙酮、15%三氯乙酸水溶液等)提取后仍有活性,可以耐受蛋白酶(胰蛋白酶、木瓜蛋白酶和蛋白酶K)、昆虫肠道提取物或反刍动物瘤胃的消化降解作用[2-5],也使得PA1b的分离纯化程序相对简单,可以从豌豆粉中经溶剂萃取和经典反相HPLC完成[6]。
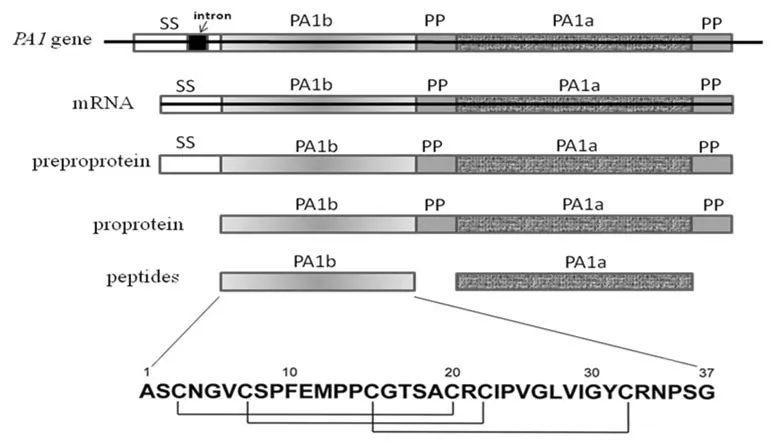
图1 PA1基因的结构和PA1b的一级结构
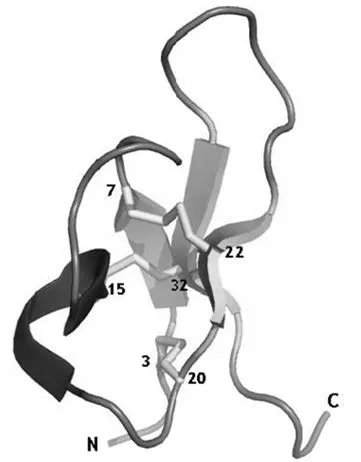
图2 PA1b的三维结构
1.2 PA1b的编码基因——PA1基因
在豌豆中,PA1b由PA1(pea albumin 1)基因编码[1]。PA1具有两个外显子,由一段位于信号肽编码序列内的较短的内含子分隔开(图1)。PA1基因最初转录和翻译为前原蛋白PA1(130aa,分子量13.9kDa),通过信号肽(26aa,2.7kDa)靶向运送至内质网中。信号肽裂解后产生的原蛋白(104aa,11.2kDa)再被引导至豌豆种子蛋白质储存体中进行内源性蛋白裂解,切除两个前肽片段后最终产生两个成熟形式的多肽,即PA1a(53aa,6kDa)和PA1b(37aa,3.8kDa)。
PA1基因在豌豆种子早期萌发中很少或不转录,但在豌豆生长发育成熟过程中转录水平逐渐增加达到最大值(开花后20 ~ 22天),然后急剧下降[1,4]。窄叶羽扇豆中的PA1b样基因也主要在萌发的种子中存在,种子发芽两天后就检测不到[7],这些研究表明PA1基因的表达在豆科种子萌发和生长过程中具有严谨的时空调节机制。然而目前但对其表达调控的机理知之甚少,调节转录的上游顺式作用元件尚未鉴定。
1.3 PA1b的同源异构体
PA1b属于多基因家族,具有多种同源异构体,因而可以统称为PA1b蛋白家族。迄今为止,在豌豆中已发现9个同源异构体[8-10],它们绝大多数都具有杀虫活性[9]。在黄豆、绿豆、蚕豆、菜豆、小豆、洋刀豆、扁豆、羽扇豆、黄芪等其他豆科植物中也发现了多种PA1b的同源异构体[11-12](表1),这些同源蛋白质虽然有其他不同的命名,如leginsulin(豆类胰岛素)[13]、aglycin(胰安肽)[14]等,但是它们之间氨基酸序列相似性都在60%以上,均为36 ~ 39个氨基酸残基的小肽,具有保守的ICK结构模型。这种结构模型在植物、真菌、海洋软体动物、蜘蛛中广泛存在,这类多肽往往具有多种生物活性,如离子通道抑制剂、蛋白酶抑制剂、抗微生物肽等。迄今为止,研究发现PA1b及其同源异构体仅存在于豆科植物中,提示PA1b家族在豆科植物进化中的重要性,尤其是其显著的抗虫活性,是豆科种子抵御虫害的重要组分[15]。

表1 豆科植物中部分PA1b同源异构体序列对比
2 PA1b的生理功能
PA1b对昆虫、植物和哺乳动物表现出不同的生理功能。它可能通过和特异性受体结合来发挥作用,但是在昆虫、植物以及动物中的受体不一样,因而有不同的作用机制。
2.1 对昆虫的作用
PA1b对谷物象鼻虫、蚜虫具有显著的杀伤力,尤其是能强力杀灭尖音库蚊、伊蚊等传染性病毒载体,而对蜜蜂和赤眼蜂等农业益虫没有毒害作用,使得PA1b成为一种很有潜力能大规模应用的新型生物杀虫剂[16]。总的来说PA1b杀虫谱系为鞘翅目昆虫,鳞翅目对此肽不敏感。然而,体外培养的Sf9昆虫细胞(来源于草地夜蛾)对低剂量的PA1b敏感,提示草地夜蛾有其他机制来抵消PA1b的毒性作用[17]。
由于昆虫主要通过消化作用吸收豆类食物中的PA1b,因而寻找PA1b在昆虫肠道中的受体是揭示PA1b昆虫毒作用机制的关键。某些PA1b不敏感昆虫如甘蓝夜蛾的肠道提取物不能降解PA1b,PA1b敏感的象鼻虫也是如此,因此昆虫对PA1b的耐受性差异与其肠道对PA1b降解吸收的差别无关[2]。Gressent等[18]在象鼻虫肠细胞膜中发现了PA1b的一个高亲和力受体,该受体为PA1b敏感的象鼻虫品系所特有,耐药品系中未检测到,说明这一结合位点是PA1b昆虫毒作用的分子靶标。后来鉴定出该受体为V型ATP酶(V-ATPase)[19]。昆虫V-ATPase由14个亚基组成两个复合物,嵌入膜上的复合物V0中c亚基围成环形成质子通道;胞质侧复合物V1则具有ATP酶活性,利用跨膜的质子电化学梯度推动ATP的合成[20]。电生理研究表明PA1b能抑制Sf9细胞膜上的V-ATPase,阻碍其质子泵功能,使细胞膜去极化。进一步研究发现PA1b结合于V-ATPase的V0复合物,进而抑制全酶活性,是V-ATPase的首个多肽类抑制剂[19],和V-ATPase抑制剂巴弗洛霉素具有同样的作用效果。该研究组接着[21]又利用电子显微镜技术揭示出PA1b和V-ATPase的具体结合位点涉及V0的c亚基环和e亚基,PA1b结合后将c亚基环"转子"锁定到静态亚基e上,从而抑制了质子泵的工作。c亚基突变导致象鼻虫对PA1b不再敏感。在昆虫消化道中,V-ATPase活性是昆虫吸收营养物质所必需能量的主要来源,PA1b的昆虫毒性作用的机制在于抑制昆虫肠道中V-ATPase活性,从而妨碍营养物质吸收[22]。另一方面,PA1b昆虫毒作用的机理还在于PA1b和昆虫肠细胞膜上的受体V-ATPase相互作用后,激活中肠细胞内caspase-3活性,触发了中肠细胞凋亡,导致昆虫死亡[23]。
为研究PA1b氨基酸残基对其结构和杀虫活性的影响,Da Silva等[24]化学合成了PA1b的13个突变体,每个突变体均有一个氨基酸残基被替换成Ala(即丙氨酸突变扫描),结果发现PA1b的三维结构几乎没有受到这些突变的影响,所有突变体和天然PA1b一样都能抵抗蛋白酶降解,凸显了PA1b分子结构中ICK模体的稳定性。特别的是,PA1b和受体V-ATPase结合以及杀象鼻虫活性依赖于Phe-10,Arg-21,Ile-23和Leu-27这几个关键残基,它们分布在PA1b的一个侧面上[23-24]。
Eyraud等[25]构建了一种特殊的PA1基因载体,能够表出达出豌豆种子中存在的PA1b的6种同源异构体形式。杀虫试验表明,5种具有相似的杀虫活力,一种没有杀虫活性,该无活性同源异构体和其他同源异构体结构区别很大,其亲水性侧面变为疏水性,因而整个分子缺乏两亲性,说明PA1b的两亲性质是杀虫活性必需的[25]。
2.2 对植物的作用
Leginsulin是PA1b在黄豆中的同源异构体[13],两者序列同源性近65%,三维结构相似性超过80%,下文合称leginsulin/PA1b。leginsulin/PA1b在黄豆中的受体是一种43kDa蛋白[26-27],属于碱性7S球蛋白(basic 7S globulin, Bg7S),能调控细胞增殖和分化[28]。在胡萝卜细胞的培养基中添加leginsulin/PA1b,可以促进细胞增殖,刺激愈伤组织再分化,对照组只观察到愈伤组织增殖,未见器官分化,说明leginsulin/PA1b与植物生长和分化的调控有关[29]。将leginsulin/PA1b基因转入胡萝愈伤组织中进行表达,相比对照组,转基因的愈伤组织在分化早期生长更迅速,leginsulin基因转入车轴草中也观察到类似现象[29]。胡萝卜中也含有leginsulin/PA1b的受体43kDa蛋白,因此推测leginsulin/PA1b是一种新型植物多肽激素,通过和43kDa蛋白结合并使其磷酸化而激活其酪氨酸激酶活性,从而激活细胞信号转导,参与调控植物细胞增殖与分化。另外,赵燕英等[4]用竞争抑制ELISA法检测了PA1b在豌豆种子萌发过程中的含量变化,发现随着发芽时间增加,PA1b含量逐渐减少,表明PA1b可能参与豌豆发芽过程,对植物生长发育起调控作用。
Hanada等[27]利用丙氨酸突变扫描分析了19个leginsulin/PA1b突变体,发现对leginsulin/PA1b与43kDa蛋白结合有影响的氨基酸残基有13个,其中能够显著干扰两者结合的是C端的几个芳香族氨基酸和疏水性氨基酸残基,最关键的是Val-29和Phe-31。尽管leginsulin和PA1b的三维结构高度相似,涉及到和各自受体结合的关键氨基酸残基却是不同的,在空间上也位于分子上相反的侧面,使得两者在植物和昆虫中的受体结合模式不同,因而具有不同的活性[24]。
2.3 对哺乳动物的作用
PA1b具有抗癌活性。体外实验表明从发芽的黄豆中提取的leginsulin/PA1b能抑制宫颈癌细胞的增殖和促进细胞凋亡,用该提取物饲喂接种了宫颈癌细胞的裸鼠,肿瘤生长几乎完全被抑制(肿瘤体积减少92%以上)[30]。未发芽黄豆的提取物效果次之,可能是由于发芽激活了这一活性肽的产生[30],与上文所述leginsulin/PA1b在豆类种子萌发时含量最高的现象相符合。
PA1b还能调节哺乳动物的葡萄糖代谢和胰岛素感受性,有望开发成口服的糖尿病防治药物。外源添加PA1b能明显延长原代大鼠胰腺β细胞存活时间,并能调节其胰岛素分泌水平[6]。小鼠皮下注射Aglycin(从猪肠中分离纯化而来,和PA1b氨基酸序列完全相同,两者为同一蛋白。推测Aglycin源于食物中的PA1b被猪肠道消化吸收[31],下文中Vglycin也是Aglycin的同源异构体,两者仅1、2、31号氨基酸有区别),能提升血糖浓度[31]。利用表面等离子共振(SPR)技术和肽指纹图谱分析,鉴定出Aglycin/PA1b在小鼠胰腺中的一个与糖脂代谢相关的结合蛋白——电压依赖阴离子选择性通道1(voltage dependant anion-selective channel-1,VDAC-1)[31-32]。进一步的电生理研究表明PA1b使大鼠胰腺β细胞膜去极化,打开膜上的L型钙离子通道,使细胞外钙离子内流从而提升胞内钙离子浓度,促进β细胞的分泌活动[33]。由于在植物中leginsulin/PA1b可与胰岛素竞争结合受体碱性7S球蛋白[28],因而推测PA1b有可能结合到哺乳动物的胰岛素受体上。然而PA1b调节血糖的作用是否通过与VDAC-1、L型钙离子通道或胰岛素受体结合还在进一步研究中。
为研究PA1b在糖尿病中的作用,对链脲霉素(STZ)加高脂饮食诱导的2型糖尿病小鼠[14]和大鼠[34]模型给以4周的日常Aglycin/PA1b灌胃,结果有效降低了血糖水平,改善了口服葡萄糖耐受性。进一步分析模型鼠体内胰岛素相关信号分子的变化,发现Aglycin/PA1b的作用在于维持胰岛素受体(IR)和胰岛素受体底物1(IRS1)的mRNA和蛋白质的正常表达水平,提升p-IR,p-IRS1,p-Akt和膜GLUT4(葡萄糖转运蛋白4)蛋白的表达,从而修复糖尿病鼠的胰岛素信号转导[14]。虽然受损β细胞的胰岛素合成和分泌未显著增加,但胰岛形态在Vglycin/PA1b影响下得到了改善,胰岛素敏感性增加,胰腺功能得到恢复[34]。Vglycin/PA1b可通过促进β细胞增殖、抑制凋亡和分化从而补充β细胞数量,改善糖尿病鼠体内葡萄糖自稳平衡[35]。另外,PA1b具有良好的稳定性,能抗胃蛋白酶和胰蛋白酶降解,长期给药安全性较好[5]。这些研究提示Aglycin/Vglycin/PA1b有开发成口服药剂用于糖尿病的预防和治疗的潜力[5,14,34-37]。
3 PA1b的异源表达
基于PA1b在农业病虫害防治和糖尿病药物开发中的巨大潜力,大量获取PA1b蛋白进行工业规模应用或者深入研究作用机制就显得十分必要。PA1b存在许多同源异构体,它们序列非常相似,通过生物化学分离方法来逐一纯化它们是很困难甚至是不可能的[6]。因此,为了研究某个特定的PA1b异构体的功能,有必要将其表达在异源系统中。虽然可以通过体外化学合成的方法合成有活性的PA1b[38],但是技术复杂,耗时长耗资高,最理想的还是通过基因工程手段将PA1b在异源系统中进行表达。
在植物中表达PA1b的尝试最早是Ealing等[39]报道的。由于PA1b富含半胱氨酸,他们以提高反刍动物食用的牧草中含硫蛋白质的量为目的,将PA1基因用农杆菌介导导入白三叶草中制备成转基因白三叶草,结果只检测到高水平的PA1mRNA,相应的原蛋白几乎检测不到,只在嫩叶中发现微量的PA1a,全株植物中未检测到PA1b,说明PA1b以及绝大部分PA1a可能在蛋白加工过程中被白三叶草中内源性蛋白酶降解了。提示异源表达PA1b必须考虑PA1前原蛋白加工过程的稳定性问题,不能忽视PA1a的作用。2013年,Eyraud等[25]的研究结果印证了这一论点,他们利用农杆菌侵染法将完整的PA1cDNA导入烟草叶片中,大量表达出了有活性(能够杀伤象鼻虫和Sf9昆虫细胞)的PA1b(达35 mg/g鲜叶),表达量在侵染后8天达到最大值,随后锐减。而单独转化PA1b的cDNA则无法表达出PA1b,证实了PA1a的重要性。后来范亚军等[40]也同样用农杆菌介导法将构建在瞬时表达载体pCAPE2上的PA1b基因转入发芽的豌豆种子中,在豌豆植株中过表达了PA1b蛋白,为进一步研究PA1b抗虫机制提供了基础。另外从营养学角度来看,PA1b作为一种优质的食源性硫蛋白,在亚洲的黄豆品系中含量很高,但是北美品系中几乎不含[41]。2015年,Krishnan等[42]用渐渗杂交技术将leginsulin/PA1b基因转移到一种北美黄豆品系中,使之大量表达出leginsulin/PA1b,也提升了该品系的总蛋白含量,可用于制作高品质豆腐。
PA1b在酵母中的表达见李弘剑等[43]的研究,他们将PA1b基因克隆到毕赤酵母分泌型表达载体pPICZαA上,导入GS115酵母菌中用甲醇诱导表达,培养基经过超滤和HPLC分离获得重组PA1b,得率约10 mg/L。重组PA1b对象鼻虫敏感株表现出很强的毒力,而对象鼻虫抗性株无明显毒力,这与直接纯化自豌豆种子的PA1b毒力一致。
大肠杆菌是最常用的原核表达宿主,PA1b作为真核基因在其中表达,必须考虑如何保证分子内二硫键正确形成、肽链正确折叠等因素。在大肠杆菌中表达出有活性PA1b的报道最早见于2003年,Hanada等[27]在BL21大肠杆菌中导入完整的PA1基因,能表达出具有活性的leginsulin/PA1b,分子内二硫键正确,也能和受体43kDa蛋白结合。杜雯等[44]将PA1b对应的cDNA与麦芽糖结合蛋白(MBP)基因构建成融合基因在大肠杆菌DH5α中进行了可溶性表达,然而细菌周质空间中表达量太低,以及融合蛋白中MBP标签去除需经Factor Xa酶切成本高,因而并无后续。另有Louis等[10]尝试在大肠杆菌中表达PA1b,仅转化PA1b对应的cDNA,结果显示尽管形成了3对二硫键,PA1b的产量非常低,而且是没有正确折叠的无活性形式。因此,推测PA1a在翻译后加工过程中起着重要作用,它可能作为分子伴侣有助于PA1b正确折叠,从而保证PA1b获得相应的生物活性。最近,黄敏华等[45]将Aglycin/PA1b通过一个能在体外进行自剪切的内含肽MxeGyrA与自组装肽ELK16连接,构建了重组表达载体pET30a-Aglycin-Mxe-PT-ELK16,转化入大肠杆菌BL21进行蛋白诱导表达,得到目的蛋白聚集体,随后进行DTT切割,最终得到纯度为98.15%、产量为5.53 mg/g菌体湿重的Aglycin肽。该肽有比阿卡波糖更强的α-葡萄糖苷酶抑制活性,证明其有开发为降糖药剂的潜力。
4 PA1b的应用与展望
PA1b调节血糖的活性已经在多项细胞和活体实验研究中得到证实。PA1b为豆科植物所特有,对于人和其他哺乳动物来说是一种安全的食源性含硫蛋白,食用后没有毒性和变应原性,而且可以耐受胃蛋白酶的降解,在肠道中保持活性。因而PA1b具有开发成口服降糖药物的广阔应用前景。
PA1b的另一显著活性是昆虫毒性,可开发成一种理想的生物杀虫剂。它能特异性杀害象鼻虫、蚜虫等害虫而不损害蜜蜂等益虫,因而可大规模应用。PA1b蛋白家族赋予豆类种子特异的杀虫活性,在粮食储藏和饲料加工中可适量添加豆粉,使粮食和饲料抵抗害虫侵蚀从而更耐储藏,减少化学保藏剂的有害作用[46]。此外,面包制作中添加少量豌豆粉水解物可使面包在室温下至少储藏21天而不染真菌,同添加0.3%丙酸钙一样具有防腐效果,水解物中抗真菌多肽成分之一被鉴定为PA1b[47],说明PA1b可能开发成安全的食品防腐剂。
PA1b化学本质是多肽,可用基因工程技术进行异源表达,从而大量制备。在异源表达系统中如何提升PA1b的表达量,以及如何促进PA1b正确折叠成活性形式是需要重点考虑的问题。鉴于PA1b同源异构体之间活性存在差异,随着对PA1b结构与功能关系的研究不断深入,将有可能开发出氨基酸序列更优化的重组PA1b来增强其活性,扩展应用范围。

