血清卵泡抑素与分化型甲状腺癌患者临床病理特征及预后的关系
郑 宇, 陈 晋
(海安市人民医院普外科,江苏 海安 226600)
近年来,甲状腺癌的发病率呈逐年上升趋势[1]。虽然大多数分化型甲状腺癌[甲状腺乳头状癌(papillary thyroid cancer,PTC)和甲状腺滤泡癌(follicular thyroid carcinoma,FTC)]的预后良好,但仍有部分患者术后会出现复发或远隔转移[2]。血清标志物在分化型甲状腺癌的诊断及预后评估中具有重要的价值[3]。卵泡抑素(follistatin,FS),又称激活素结合蛋白,属于糖蛋白,富含半胱氨酸,能够与激活素结合,并抑制其生物学功能[4-5]。既往研究发现,多种类型的恶性肿瘤,如肺腺癌[6]、肝癌[7]、前列腺癌[8]、卵巢癌[9]患者均存在FS过表达,其水平升高常提示预后不良。但FS在甲状腺癌中的作用尚不明确。因此,本研究拟探讨分化型甲状腺癌患者血清FS的变化及其在预后评估中的作用。
1 材料和方法
1.1 研究对象
选取2017年1—12月海安市人民医院分化型甲状腺癌患者78例(甲状腺癌组,PTC 68例、FTC 10例),其中男41例、女37例,年龄21~60岁,体质量指数(body mass index,BMI)为(23.08±3.76)kg/m2。纳入标准:经病理学检查明确诊断为分化型甲状腺癌,年龄>18岁。排除标准:(1)合并其他恶性肿瘤;(2)合并严重的肝、肾等重要器官功能不全;(3)非首次诊断为甲状腺癌。选取同期海安市人民医院术后经病理学检查证实为甲状腺良性结节患者41例(良性结节组),其中男24例、女27例,年龄24~68岁,BMI为(22.68±4.29)kg/m2。另选取同期海安市人民医院体检健康者35名(正常对照组),其中男18名、女17名,年龄18~58岁,BMI为(37.85±13.67)kg/m2。3组之间年龄、性别和BMI差异均无统计学意义(P>0.05)。本研究经海安市人民医院伦理委员会批准,所有对象均知情同意。
1.2 手术方案及随访
对所有甲状腺癌患者常规行甲状腺全切术+双侧中央区淋巴结清扫术或甲状腺次全切除术+单侧中央区淋巴结清扫术。如患者有明确的颈侧区淋巴结转移的临床或影像学证据,则加做颈侧区淋巴结清扫术。
对所有甲状腺癌患者进行术后随访,每3个月1次,行影像学检查(如颈部超声)及生化项目(甲状腺球蛋白)检查,以监测术后复发。复发定义为手术后影像学检查阴性,而经过一段时间随访后残存甲状腺再次出现病灶。若患者术后发现残存甲状腺存在病灶或出现转移,则判定为持续性甲状腺癌。随访时间为3年。
1.3 方法
1.3.1 临床资料收集 收集所有对象的临床资料,包括年龄、性别、BMI、甲状腺结节大小(以超声测量的结节最大直径为准)、包膜侵犯情况、结节个数(单发、多发)、淋巴结转移情况、有无脉管癌栓、甲状腺外侵犯情况、有无远隔转移、TNM分期、甲状腺激素[促甲状腺激素(thyroid-stimulating hormone,TSH)、总三碘甲状腺原氨酸(total triiodothyronine,TT3)、总甲状腺素(total thyroxine,TT4)]检测结果。
1.3.2 血清FS水平测定 采集所有患者术前及术后3个月首次随访时、健康体检者体检当日的空腹静脉血5 mL,4 ℃条件下3 000×g离心10 min,分离血清,-80 ℃保存待测。采用酶联免疫吸附试验检测血清FS水平,试剂盒购自江苏碧云天公司(货号PF322),检测仪器为Multiskan FC酶标仪(美国ThermoFisher Scientific公司)。
1.4 统计学方法
采用SPSS 24.0软件进行统计分析。呈正态分布的计量资料以±s表示,术前与术后比较采用配对t检验,多组间比较采用单因素方差分析,两两比较采用Tukey事后检验。计数资料以例或率表示,组间比较采用χ2检验或Fisher确切概率法。采用受试者工作特征(receiver operating characteristic,ROC)曲线评估FS鉴别诊断甲状腺癌及颈部淋巴结转移的效能。采用Logistic回归分析评估甲状腺癌患者发生持续性甲状腺癌的危险因素。以P<0.05为差异有统计学意义。
2 结果
2.1 各组甲状腺激素水平比较及甲状腺癌患者临床病理特征分析
甲状腺癌组、良性结节组和正常对照组TSH、TT3、TT4水平差异均无统计学意义(P>0.05)。见表1。

表1 3个组甲状腺激素水平比较
78例甲状腺癌患者中,甲状腺结节≤1 cm 55例、>1 cm 23例,有包膜侵犯9例,结节呈单发35例、多发43例,无甲状腺外侵犯74例、有显微镜下甲状腺外侵犯3例、有肉眼可见甲状腺外侵犯1例,有脉管癌栓13例,淋巴结转移状态N0 35例、N1a 21例、N1b 22例,发生远隔转移3例,TNM分期Ⅰ~Ⅱ期72例、Ⅲ~Ⅳ期6例。
2.2 各组血清FS水平比较
甲状腺癌组术前血清FS水平显著高于良性结节组和正常对照组(P<0.001),良性结节组与正常对照组之间血清FS水平差异无统计学意义(P>0.05);甲状腺癌组术后3个月的血清FS水平显著低于术前(P<0.01);良性结节组术前、术后血清FS水平差异无统计学意义(P>0.05);见表2。甲状腺癌组中,PTC和FTC患者术前血清FS水平分别为(3.51±1.53)、(3.67±1.80)ng/mL,差异无统计学意义(P>0.05)。
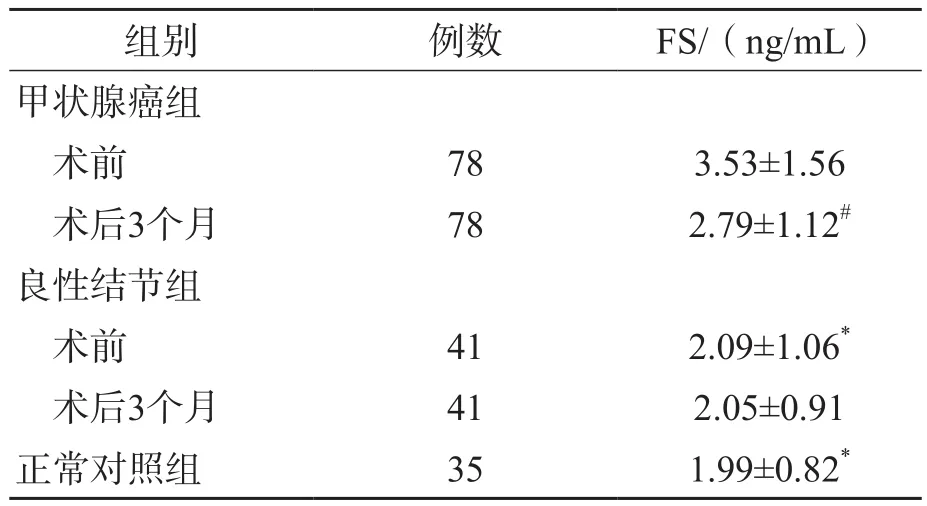
表2 3个组血清FS水平比较
2.3 FS鉴别诊断甲状腺癌的效能
ROC曲线分析结果显示,FS鉴别诊断甲状腺良性结节与甲状腺癌的曲线下面积(area under curve,AUC)为0.78,95%可信区间(confidence interval,CI)为0.69~0.85,最佳临界值为2.90 ng/mL,敏感性为70.5%,特异性为82.9%。见图1。

图1 FS鉴别诊断甲状腺良性结节与甲状腺癌的ROC曲线
2.4 FS判断甲状腺癌患者颈部淋巴结转移的效能
ROC曲线分析结果显示,FS判断甲状腺癌患者颈部淋巴结转移的AUC为0.69,95%CI为0.58~0.79,最佳临界值为3.71 ng/mL,敏感性为58.1%,特异性为77.1%。见图2。
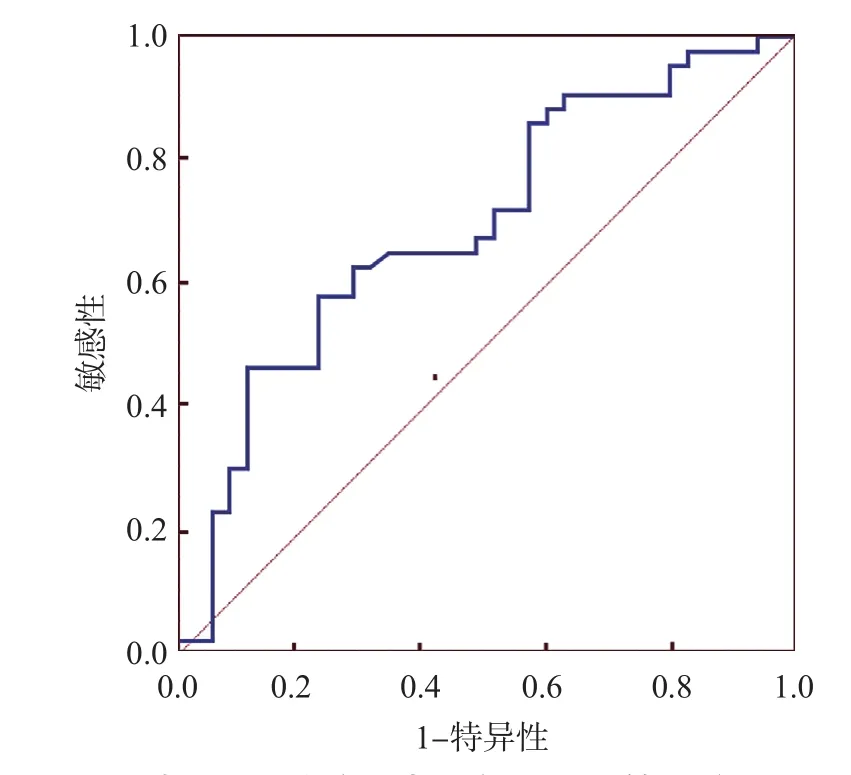
图2 FS判断甲状腺癌患者颈部淋巴结转移的ROC曲线
2.5 血清FS与甲状腺癌患者临床病理特征的关系
根据FS鉴别诊断甲状腺癌与甲状腺良性结节的最佳临界值将甲状腺癌患者分为高FS组(55例,FS≥2.90 ng/mL)和低FS组(23例,FS<2.90 ng/mL)。高FS组发生淋巴结转移的例数多于低FS组(P<0.05)。2个组之间年龄、性别、BMI、结节大小、包膜侵犯、结节个数、甲状腺外侵犯、脉管癌栓、远隔转移和TNM分期差异均无统计学意义(P>0.05)。见表3。

表3 高FS组与低FS组临床病理特征比较
2.6 甲状腺癌患者发生持续性甲状腺癌的危险因素分析
随访结果显示,78例甲状腺癌患者中有19例患者发生持续性甲状腺癌。ROC曲线分析结果显示,FS判断持续性甲状腺癌的最佳临界值为4.33 ng/mL。单因素Logistic回归分析结果显示,年龄≥45岁、有包膜侵犯、有甲状腺外侵犯、有脉管癌栓、有淋巴结转移、有远隔转移、TNM分期Ⅲ~Ⅳ期及血清FS≥4.33 ng/mL是甲状腺癌患者发生持续性甲状腺癌的危险因素(P<0.05)。多因素Logistic回归分析显示,TNM分期Ⅲ~Ⅳ期和血清FS≥4.33 ng/mL是甲状腺癌患者发生持续性甲状腺癌的独立危险因素[比值比(odds ratio,OR)值分别为8.97、7.77,95%CI分别为2.12~18.33、4.54~15.98]。见表4。

表4 各项指标判断甲状腺癌患者有无持续/复发及转移性甲状腺癌的危险因素分析
3 讨论
B超是目前最常用的鉴别诊断甲状腺良、恶性结节的方法,具有无创、简便等优势,但受操作者水平的限制较大。甲状腺核素扫描亦是区分良、恶性结节的有效方法,但具有一定的辐射,无法反复多次进行。目前可用于甲状腺良、恶性结节鉴别的血清学标志物较少。PANAGIOTOU等[10]的研究结果显示,甲状腺癌患者术后血清FS水平显著高于健康对照者(P<0.05),且与肿瘤侵袭性和TNM分期相关。JANIK等[11]发现胸腺上皮肿瘤患者血清FS水平升高,肿瘤切除后FS水平明显下降,且其水平与肿瘤分期及无复发预后相关。本研究结果显示,甲状腺癌患者术后3个月的血清FS水平显著低于术前(P<0.01),且血清FS水平较高的甲状腺癌患者更易发生颈部淋巴结转移。KRNETA等[12]发现过表达FS基因的裸鼠实体瘤内血管网更加密集,这可能是肿瘤淋巴结转移的潜在机制。
本研究Logistic回归分析结果提示血清FS水平是甲状腺癌患者发生持续性甲状腺癌的危险因素。虽然大多数分化型甲状腺癌患者预后良好,但仍有部分患者会出现复发或远隔转移。一项纳入7 048例甲状腺癌患者的Meta分析结果显示,男性、甲状腺外浸润、颈部淋巴结转移、肿瘤直径>2 cm、远隔转移是分化型甲状腺癌患者术后复发的危险因素[13],与本研究结果类似。LE BRAS等[14]发现,FS能增强食管癌细胞的侵袭性,提示高FS水平可能会增加肿瘤转移的风险。本研究多因素Logistic回归分析结果显示,仅TNM分期及血清FS水平是甲状腺癌发生持续性甲状腺癌的独立危险因素。ZHANG等[15]发现肺癌患者血清FS水平与TNM分期有关,FS水平较高者预后较差,与本研究结果基本一致。
本研究为单中心研究,样本量相对较少,未来需要前瞻性、多中心、大样本研究对本研究结论加以验证。另外,本研究未分析FS与甲状腺癌的因果关系,后续还会进一步研究。
综上所述,高水平FS是甲状腺癌患者发生持续性甲状腺癌的危险因素,血清FS水平在甲状腺良、恶性结节的鉴别及甲状腺癌是否发生颈部淋巴结转移的判断中有一定的临床价值。

