浅水湖泊草-藻型稳态转换理论研究进展
张 事,马方凯,徐望朋,王 健,朱捷缘,李迎喜,吴振斌
(1.长江勘测规划设计研究有限责任公司,湖北 武汉 430010; 2.水利部长江治理与保护重点实验室,湖北 武汉 430010; 3.流域水安全保障湖北省重点实验室,湖北 武汉 430010; 4.中国科学院水生生物研究所,湖北 武汉 430072)
0 引 言
湖泊是陆地表层水体的重要组成部分。据统计,目前全球面积大于0.1 km2的自然湖泊有142万个,总面积和总容积分别为2.67×106km2和181.9×103km3[1]。中国湖泊集中分布在长江中下游平原和青藏高原,面积大于1 km2的天然湖泊2 693个,总面积为81 414.6 km2[2]。湖泊是全球水分循环、水量调控和物质能量平衡的重要组成部分,在社会经济发展和生物多样性维持等方面起着至关重要的作用。
1 浅水湖泊稳态转换理论
1.1 稳态转换理论来源及内涵
浅水湖泊作为与人类联系最为密切的淡水生态系统,夏季不存在热力分层且健康状态下能够大面积生长水生植物。近年来,由于物理、化学和生物作用的干扰,湖泊原有结构和功能遭到严重破坏,湖泊生态系统发生稳态转换,优势种群由沉水植物转变为浮游植物。“湖泊生态系统可能不止一种稳定状态”这一理论假设最初是由Lewomin于1969年提出[3]。随后,淡水生物学家在富营养化湖泊的治理中发现淡水生态系统可能也存在两种稳态:草型清水态和藻型浊水态[4]。Scheffer作为浅水湖泊稳态转换理论研究的奠基人,于2001年在《Nature》上发表了题为《Catastrophic shifts in ecosystems》的研究性文章,详细阐述了浅水湖泊草-藻型稳态转换理论[5]。中国知名水污染治理专家年跃刚教授2006年在《环境科学研究》中发表了关于富营养化浅水湖泊稳态转换理论的文章[6]。
稳态转换是指随着干扰强度的增强而出现的结构或功能的突然变化,这种变化具有突发性、难预知性,兼具非线性、多稳态、多阈值以及迟滞效应等特征[7]。基于生态系统状态对外界环境参数的响应过程,稳态转换的变化过程可总结为3种类型:平滑型、突变型和不连续变化型(图1),可以根据“杯中弹子”概念模型对湖泊稳态进行判定[5,8-10]。

图1 稳态转换临界点及弹性恢复力经典模型
(1) 平滑型是指生态系统和外界条件之间具有线性响应特性,生态系统处在一个连续性渐变的过程中,浅水湖泊藻型稳态转换就是其中比较典型的现象。藻类水华形成的主要驱动力是磷,藻类生物量和水体中磷浓度之间就存在线性关系[11-12]。
(2) 突变型是指当外界条件发生变化时,生态系统在较短时间内发生非线性的本质变化。最典型的实例是人为富营养化所导致的浅水湖泊透明度突然降低,水生植物迅速消亡[13-14]。
(3) 不连续变化型是指当外界条件变化超过生态系统自我调节能力时,生态系统发生灾变,由一种状态突然变化到另一种状态,并呈现出一定的迟滞现象[8]。
1.2 浅水湖泊稳态转换驱动因素
由于温跃层的存在,使得深水湖泊的上部混合层与下部滞水层很难发生物质交换,因而比较稳定。而浅水湖泊由于水深较浅,营养盐、气候、捕食作用、风浪风暴、自然灾害等变化均会触发水体发生稳态转换[15-16]。这些影响浅水湖泊生态系统稳态转换的驱动因素可以概括为化学、物理和生物因素。
在浅水湖泊生态系统草-藻型稳态转换过程中,氮磷过量导致有毒有害藻类疯长,与此同时藻类的过度生长又会减低水体的溶解氧及透明度,进而直接干扰沉水植物的光合作用。随着沉水植物的消亡,鱼类和原生动物丧失了饵料和庇护场所,种群数量急剧下降。这就大大减小了浮游植物的摄食压力,进一步加剧了其生长速度,这类生态系统正反馈机制加速了草型稳态向藻型稳态的转换进程[17-18]。除了化学因素驱动以外,气候、水位、岸带环境以及酸碱度等物理因素也会影响稳态转换过程。气候因素中温度变化对水生态系统影响最为显著:一方面温度直接影响水生生物的代谢强度,从而控制其生长、发育和分布;另一方面温度可以通过水生生物的各种反馈机制间接地影响着其赖以生存的水环境[19]。水深的波动也会改变水生植物的生长环境,进而影响水生植物的演替,水位的降低会导致沉水植物丰度的增加[20]。此外,由于岸带湿地的消失而引起的风浪及水动力变化,也是浅水湖泊稳态发生变化的物理驱动因素之一[21]。上述物理化学因素作为生态系统的无机组成部分,可以通过各种正负反馈机制影响生态系统稳定性。对于浅水湖泊而言,鱼类和大型浮游动物是影响草-藻型稳态转换的主要生物因素。生物操纵法主要是通过放养凶猛性鱼类以期达到控制底栖食性鱼类的数量,促使大型浮游动物丰度增加,进而利用浮游动物的牧食压力来控制浮游植物的生长[22-23]。
浅水湖泊的水体质变发生是量变累积的结果。湖泊的稳态转换最初往往是由营养盐的增加引起,营养盐的增加带来一系列级联效应(比如生态系统的退化演变等),最终由清水稳态转换为浊水稳态。
1.3 浅水湖泊稳态转换阈值判定
目前,对浅水湖泊稳态转换阈值判定的定量方法主要分为实验观测、模型模拟和统计分析方法。
(1) 实验观测主要以生态系统物种结构和功能进行监测,以期了解湖泊内部的显著变化。野外观测数据的分析主要包括时间序列法、频数分布法和分段函数法[24-26]。实验观测法由于其对监测指标的特定性,使其对于特定浅水湖泊的稳态转换阈值判定更为准确,但是由于缺乏对生态系统整体变化的判定以及较难长时间获取实验观测数据,所以并不适用于普遍的浅水湖泊。
(2) 传统的实验观测手段因为稳态转换的突变型及非明显预兆性而难以广泛使用,因此能够预测和预警的模型模拟法便得到快速发展。该方法从较为全面的尺度上识别浅水湖泊稳态转换关键过程和判定关键因子阈值。目前使用较多的还是以模拟湖泊营养物质含量变化和生态变化过程的模型为主[27],但是多为线性或简单非线性模型,没有反映生态系统稳态变化的非线性特征,在模型误差和不确定性的处理上仍然存在很多问题。
(3) 统计分析法不需要掌握湖泊生态系统的复杂动态机制和过程,便能够揭示长时间序列监测数据的规律,并借以判断稳态转换阈值或者预警稳态转换现象,能够弥补模型模拟法的不确定性[28]。统计分析法主要是将稳态转换过程视为时间序列上的突变,进而将其视作向量自我回归过程中的变化点加以分析。目前对阈值判定的常用统计方法包括方差或标准偏差的增加、偏度突变、条件异方差、自相关性增强和干扰后的恢复速率五大类[5,26,29-31]。
2 长江流域浅水湖泊稳态转换研究现状
2.1 浅水湖泊富营养化现状
作为国家战略水源,长江在中国区域发展总体格局中具有举足轻重的地位,是中华民族永续发展的重要支撑[32]。随着社会经济的迅速发展和城市化进程加快,大量城市废水、工业污水和农业面源污染带来的氮和磷等营养元素进入长江流域,造成水体富营养化进程加速,蓝藻水华频繁发生,严重危及水生态系统[33]。据《长江流域水资源公报》统计显示,纳入富营养化评价的浅水湖泊数量从2008年的10个增加到2018年的61个,湖泊的营养水平从贫营养和中营养逐渐发展为“贫营养湖泊消失,轻度富营养化”为主体的格局。湖泊富营养化趋势没有得到好转,中营养湖泊比例从2009年的31.3%逐步降低至2018年的13.1%,中度富营养化湖泊比例从2009年的31.3%增加至2018年的42.7%(图2)[34]。以藻型浊水稳态为主的浅水湖泊数量不断激增,充分反映出长江沿线浅水湖泊的水生态系统不断恶化的现状。
2.2 典型浅水湖泊稳态转换研究现状
太湖是中国五大淡水湖泊之一,位处长江三角洲的南缘,流域中部水域面积为2 338 km2。李文朝[35]在对太湖的研究中发现湖泊所处的状态不仅与湖水营养水平有关,而且与湖泊形态(如水深、湖面开敞度)、湖区气候(如温度、风情、辐射强度)等因素有关;除了藻型及草型水态以外,浅水湖泊还存在泥沙型浊水状态,湖泊状态的跃变不是在同一营养水平上的滑动,而是伴随大幅度的营养水平变化,“杯中弹子”模型已经无法反映这些特征,所以提出了一种全新全面的多稳态概念模型(图3)。刘聚涛[36]又采用Mann-Kendall趋势检验法对1981~2008年间太湖湖泊稳态转换关键因子总氮(TN)、总磷(TP)和叶绿素a(Chla)进行突变识别,研究发现太湖可以划分为草藻共存、藻草共存和藻型浊水稳态3个阶段。第一阶段为1981~1987年,TP浓度为0.025 mg/L,属于草藻共存,接近于清水稳态阶段;第二阶段为1988~1996年,TP浓度为0.086 mg/L,属于藻草共存阶段;第三阶段为1997~2008年,TP浓度为0.103 mg/L,属于藻型浊水稳态。太湖之所以存在多稳态突变过程主要有以下两方面原因:① 太湖流域的面源污染分散且复杂,外源输入的总氮及总磷含量波动性较大;② 污染源责任不清导致的利益分配与协调机制缺失,使得治理缺乏持久动力,许多治理技术因未考虑实施成本与经济效益而难以落地和推广。
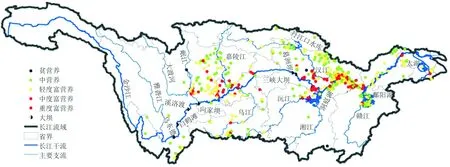
图2 长江流域富营养化湖泊分布[34]
洞庭湖是中国第二大淡水湖,地处长江中下游典型淤积平原,面积达到2 579.2 km2。张佳磊[37]对长江三口、南部四水、西洞庭湖、南洞庭湖和东洞庭湖5个主要湖区进行野外比较湖沼学研究,通过频数分布法验证了洞庭湖水生态系统多稳态的存在,并识别出洞庭湖水生态系统分布特征。发现洞庭湖在不同时空水生态系统均存在多稳态。枯水期长江三口和南洞庭湖基本处于过渡态,南部四水和西洞庭湖草型稳态和过渡态两者皆有,东洞庭湖处于藻型稳态。到了涨水期和丰水期,长江三口和南部四水处于草型稳态,西洞庭湖和南洞庭湖多处于过渡态,东洞庭湖存在过渡态和藻型稳态。而退水期长江三口和南洞庭湖生态系统转换为过渡态,南部四水和西洞庭湖则以草型稳态为主,东洞庭湖彻底转换为藻型稳态。三峡水库建设对洞庭湖的主要水系湖区稳态转换具有极其关键的影响,年内和年际上的水系涨水、蓄水及退水均会影响其水环境特征,进而改变洞庭湖生态系统状态[38-39]。

注:S1~S6为不同的生态系统类别。
滇池是云南省最大的淡水湖,位于长江上游干流金沙江支流普渡河上源,流域面积约为2 920 km2。滇池的稳态转换过程与太湖的稳态转换过程比较相似,也是分为3个阶段,20世纪50~60年代为清水态,20世纪70~80年代为过渡阶段,1993年至今为浊水态[40]。高路等[41]在探索人为活动干扰下滇池湖泊稳态转换过程中指出,目前滇池水体富营养化问题具有非线性、不可预测性等特征,以单一的控源截留作为主要治理工程手段已无法彻底解决问题。污染控制与生态修复并重、“局部治理”向“流域治理”转变的治理理念需要深入人心。滇池稳态转换的深入研究对滇池的长久治理具有重要的理论指导意义,借助稳态转换理论研究,发现滇池的治理还需要加强先进的科学技术开发及自然管理理念。
长江流域大部分类似于太湖及滇池这种典型湖泊,因人类活动而导致水体生态系统处于多稳态状态。比较特殊的是洞庭湖及鄱阳湖,因其在航运方面的特殊性,导致生态系统中的水生植物大量消亡,进而加剧草型稳态向藻型稳态转换的进程。
3 浅水湖泊水生植物适宜生物量评估方法
3.1 水生植物重要性
水生植物是浅水湖泊草型清水稳态十分重要的组成部分。水生植物作为初级生产者,生长过程中可以吸收水体中氮磷等营养盐,维持自身的生长与繁殖[42];同时水生植物通过遮光、营养盐的吸收以及分泌化感物质等过程抑制藻类的生长[43];其中以挺水植物和沉水植物为代表,不仅可为鱼类提供重要的附着场所,同时也可提供丰富的食物。丰富的植物群落为鱼类生长发育和躲避天敌提供极好的场所,而平缓的水流生境又为幼鱼提供良好的栖息环境[44];水生植物还能够通过减缓水流流速,以达到促进悬浮颗粒物沉降、保护湖岸免受风浪的直接冲刷和侵蚀的效果[45]。但是过多的水生植物会威胁水生动物的健康状况,腐解引起水质恶化,进而加速湖泊淤积和沼泽化。因此,合理控制水生植物的生物量对浅水湖泊草型清水稳态的构建及水生态修复具有重要的指导作用。
3.2 水生植物生物量目标评定方法
目前关于浅水湖泊水生植物适宜生物量评估方法主要包括历史最大值法、最大容纳值法以及生态模型评估法[46]。
(1) 历史最大值法即浅水湖泊的水生植物从有历史记录以来的最大覆盖度或最大生物量。主要是通过工程措施对已经退化或消失的水生植物进行修复,以期恢复浅水湖泊水生植被退化前的结构、功能和相关的物理、化学和生物特征,重新发挥其在浅水湖泊系统中的重要作用。该方法的评定基础在于浅水湖泊的主要土地利用格局、污染负荷、水文要素以及地形地貌等与历史参照时间点基本没有太大的变化[47-48]。而对于需要生态修复的浅水湖泊来说,湖泊生境已经发生明显变化,因此完全按照历史最大值来评定就违背了生态恢复学的基本原理。
(2) 最大容纳值法是指浅水湖泊目前的生境条件所能容纳的最大水生植物覆盖度或生物量[49]。早期浅水湖泊生态修复过程中建议尽可能恢复水生植物生物量或覆盖度,但是这种方法弱化甚至忽视了水生植物对浅水湖泊的负面效应,因此也不能作为一种理想的水生植物适宜生物量评估方法。
(3) 目前用生态模型来评定浅水湖泊水生植物适宜生物量已经得到大量的研究和应用。其中Ecopath with Ecosim模型基于能量流理论特性,能够全面评价浅水湖泊生态系统管理措施的经济、生态和社会效益,同时提出适宜的生态系统管理措施[50]。LakeWeb模型作为比较综合的湖泊生态系统模型,对水质净化法等有更好的预测效果[51]。而荷兰湖沼生态模型学家Janse团队研发的PCLake模型作为只适用于浅水湖泊的生态模型,综合考虑了浅水湖泊生态系统的基本元素,对浅水湖泊水生植物适宜生物量评估具有很好的指导作用[52]。
4 结论与展望
本文系统总结了浅水湖泊稳态转换理论、驱动因素及稳态转换阈值判定;典型浅水湖泊稳态转换研究现状及水生植物适宜生物量评估研究。浅水湖泊生态系统稳态转换与外部环境因子和内部生物因子密切相关,并且这些因子存在复杂的相互反馈作用;此外,不同浅水湖泊所处的演化进程、营养状态、物理形态等各不相同,导致稳态转换过程存在极大的差异性。基于现有研究总结需要进一步探索的问题如下:
(1) 联合多种技术手段还原反演湖泊生态系统演化进程。联合遥感领域多源卫星对地观测,收集环境、水文和气象学科的观测数据,发展新的观测方法,研究浅水湖泊生态系统历史演化进程及其成因。
(2) 加大浅水湖泊稳态转换理论研究分析样本。由于导致浅水湖泊稳态转换过程的因素除了营养元素外,也包含其所处纬度、深度等流域特征,因此应加强样本湖泊的比较湖沼学研究,寻求不同类型湖泊所处的稳态,同时研究不同稳态的主要影响因素。
(3) 丰富水生植物恢复的种群搭配。对于草型清水稳态构建过程中,不仅水生植物适宜生物量的评估至关重要,同时水生植物的种群搭配也是浅水湖泊水生态治理的重要环节。

