弥漫性原发中枢神经系统淋巴瘤的临床及多模态影像表现
林钱森,廖伟华,陈杰云,孟莉
原发中枢神经系统淋巴瘤(primary central ner-vous system lymphoma,PCNSL)是一种少见的仅发生于中枢神经系统的非霍奇金淋巴瘤,通常表现为单发或多发结节/肿块样病变。极其罕见的情况下,PCNSL表现为弥漫浸润性病变,不形成明显肿块,既往称为脑淋巴瘤病(lymphomatosis cerebri,LC)[1]。由于此型的临床及影像学表现与典型PCNSL差异较大,容易与免疫相关性病变、炎性脱髓鞘病变和弥漫性胶质瘤等相混淆[2-4],因而早期诊断困难、误诊率高。笔者通过回顾性分析经病理证实的11例弥漫性PCNSL的临床资料和多模态影像学资料结合文献复习,总结其多模态影像学特征并分析误诊原因,旨在提高对本病的认识及早期诊断水平。
材料与方法
1.研究对象
搜集2016年6月-2022年5月在中南大学湘雅医院经立体定向穿刺活检或手术切除病理证实的11例弥漫性PCNSL患者的临床及多模态影像资料。临床资料主要包括年龄、性别、临床表现、脑脊液常规及生化检查、随诊情况及病理结果;多模态影像学资料包括CT平扫、MR平扫及增强扫描、DWI、DTI、SWI、1H-MRS及18F-FDG PET-CT。弥漫性PCNSL的诊断标准:①病理诊断为淋巴瘤并排除血管内和系统性淋巴瘤;②影像学表现为弥漫脑白质病变(病变范围至少累及3个脑叶或3个解剖分区),增强扫描示脑组织内无明显肿块样强化[5]。排除标准:①首次就诊时的MRI平扫和增强资料不完整;②影像学表现为边界清楚的结节或肿块样病灶。
2.检查方法
使用Philips Brilliance 16排和Toshiba Aquilion One 320排螺旋CT机进行头颅CT常规平扫。MRI扫描使用GE Signa HDxt 1.5T、Premier 3.0T及Siemens Aera 1.5T和Prisma 3.0T磁共振仪和头部线圈。10例行头颅CT检查,11例行常规序列MRI平扫和增强扫描,9例行DWI,5例行1H-MRS和SWI,2例行DTI,4例行PET-CT扫描。MRI平扫包括横轴面SE T1WI、FSE T2WI和FLAIR序列;增强扫描采用Gd-DPTA经肘静脉注射,剂量0.1 mmol/kg,扫描序列包括横轴面、矢状面及冠状面T1WI。DWI序列b值取0、1000 s/mm2;1H-MRS采用短TE(35 ms)或中等TE(135 ms)单体素点分辨波谱序列,分析的代谢物包括胆碱复合物(choline,Cho)、N-乙酰天冬氨酸(N-acetylaspartate,NAA)、肌酸(creatine,Cr)、乳酸(lactate,Lac)和脂质(lipid,Lip)。DTI采用单次激发EPI序列,15个扩散方向,b值为0、1000 s/mm2。PET-CT检查使用GE Discovery STE成像仪,检查前禁食6 h以上,空腹血糖控制在7.1 mmol/L以下,按照4.07 MBq/kg的剂量静脉注射18F-FDG,平静休息1 h后行CT和PET显像。
3.图像分析
由两位高年资神经放射医师共同分析图像并协商达成一致意见。主要观察指标:病灶的位置及分布特征、密度和信号、强化方式;1H-MRS上各波峰的改变及是否出现Lip和Lac峰;SWI上病灶特征采用病变内磁敏感信号(intralesional susceptibility signal,ILSS)分析[6],即将病变内点状、线样或弥漫性低信号表现分为4级,无ILSS为0级,1~5个为1级,6~10个为2级,≥11个或弥漫性为3级;DTI图像上有无纤维束中断、破坏,并测量FA值;PET-CT图像上病变的放射性浓聚情况及最大标准化摄取值(maximum standard uptake value,SUVmax)。
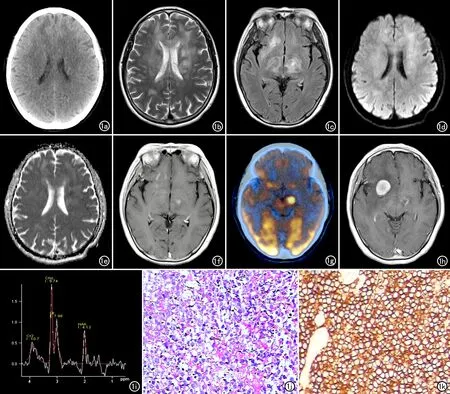
图1 患者,女,53岁,因反应迟钝和精神行为异常5月余入院,脑内病变的病理诊断为弥漫大B细胞淋巴瘤。a)CT平扫示双侧额叶可见稍低密度灶;b、c)分别为T2WI和T2-FLAIR图像,显示非对称性弥漫脑白质病变累及深部脑白质、侧脑室旁、胼胝体和基底节区,T2WI呈稍高信号、T2-FLAIR呈高信号;d)DWI示病灶呈稍高信号;e)ADC图示病灶以稍高信号为主,夹杂小斑片状稍低信号;f)增强后T1WI示病变表现为小斑片状强化;g)18F-FDG PET-CT示中脑左侧有结节状放射性浓聚,SUVmax值为17.2;h)第42天后复查(未进行激素治疗和放化疗),增强扫描示病变呈结节样明显强化,强化范围较前增大;i)1H-MRS示Cho峰明显增高,NAA峰减低,可见倒置的Lac峰;j)病理图片镜下示体积较大的异形淋巴样细胞弥漫性浸润(×400,HE);k)免疫组化检查镜下示肿瘤细胞膜呈黄色染色,提示CD20表达阳性(×400,Envision染色)。
结 果
1.主要临床资料
在11例弥漫性PCNSL患者中,男7例、女4例,年龄34~67岁,平均(53.5±8.7)岁。临床表现多样,主要包括肢体乏力(5/11)、精神行为异常(2/11)、行走不稳(2/11)、复视(2/11)、记忆力减退(1/11)、意识障碍(1/11)和性格改变(1/11),病程2周~6个月。8例行脑脊液检查,常规检查提示氯含量均正常、蛋白轻度升高4例、细胞数轻度增多3例;其中,6例行寡克隆区带检测,均为阴性;3例行自身免疫抗体和中枢脱髓鞘四项检测,结果均为阴性;1例行副肿瘤抗体检测,结果为阴性。11例患者均无免疫缺陷性疾病。
2.多模态影像学表现
病变分布特征:11例均表现为非对称性弥漫性脑白质病变(图1a~g、2a~b)、以深部脑白质或皮质脊髓束分布为主,沿皮质脊髓束分布6例(图3a~b)。其中,累及深部脑白质7例、侧脑室旁白质区6例、皮层下白质及U形纤维6例,累及胼胝体7例,累及基底节区10例、脑干9例、丘脑6例、海马2例和小脑半球2例。幕上病变的分布按脑叶来划分,包括额叶7例(均为双侧)、颞叶5例(双侧4例、单侧1例)、顶叶4例(双侧3例、单侧1例)、枕叶3例(均为双侧)和岛叶2例(单侧)。本组中2例行脊髓MRI检查,其中1例可见病变累及脊髓,呈不连续、多节段分布(图2c)。
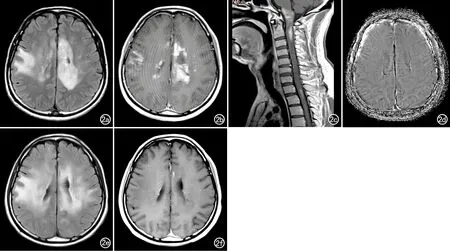
图2患者,男,34岁,肢体乏力5个月,脑内病灶病理证实为弥漫大B细胞淋巴瘤。a)T2-FLAIR图像示非对称分布的弥漫性脑白质病变呈高信号,累及皮层下、皮层下U型纤维和侧脑室旁;b)增强后病变呈斑点状、斑片状明显强化;c)增强示颈胸髓见多发斑片状明显强化;d)SWI图像,ILSS为0级;e)激素治疗第25天复查MRI,T2-FLAIR图像示病变范围增大;f)复查MRI,增强扫描示强化范围明显减少。
10例行头颅CT检查,CT平扫图像上病灶以稍低密度为主5例(图1a),CT值25~27 HU;呈稍高、稍低密度灶5例,CT值约25~40 HU。
11例均行头颅MR平扫,大部分病变在T1WI呈稍低信号、在T2WI上呈稍高信号(图1b)、FLAIR图像上呈高信号(图1c、2a),部分病变在T1WI和T2WI上呈等信号。以FLAIR图像上显示病变最佳,可发现CT平扫遗漏的等密度病灶。9例行DWI检查,7例表现为病灶内大部分区域在DWI上呈稍高信号(图1d)、ADC图上呈高信号,小部分病区域可呈稍低信号(图1e);2例表现为病灶扩散受限,在DWI上呈显著高信号,在ADC图上呈低信号(图3a)。MR增强扫描:8例表现为散在斑点状或斑片状强化(图1f、2b),3例表现为沿皮质脊髓束走向有斑片状强化(图3b)。1例病变累及脊髓,呈散在多发斑片状强化(图2c)。本组中2例病变沿皮质脊髓束分布的患者行DTI检查,提示病变区域神经纤维束减少、部分中断破坏(图3c),病变的FA值明显减低,2例分别为0.199(对侧非病变区4.095)和0.265(对侧0.585)。本组中5例行SWI检查,病变区域均未见明显低信号灶,ILSS分级为0级(图2d)。5例行1H-MRS检查,显示病变区域Cho峰增高、NAA峰下降、Cho/Cr比值升高(图1i),其中2例可见高耸的Lip峰(图3d),3例出现Lac峰(图1i)。
本组4例行18F-FDG-PET/CT检查,3例与首诊MRI检查间隔分别为3、4和10天,表现为脑实质内散在斑片、结节状放射性浓聚(图1g),其SUVmax值分别为17.2、17.4和11.2,诊断意见均倾向为炎性病变可能;1例与首诊MRI检查间隔40天,表现为脑实质内多发结节、斑片放射性浓聚,SUVmax值为27.4。
3.随诊复查情况
本组中有5例在手术前复查MRI。其中,4例未接受激素或放化疗治疗,分别于第27、40、42和54天复查MR平扫和增强扫描,显示病变范围和强化范围均较前进展,2例表现为多发结节、肿块样病变并有均匀明显强化(图1h),1例复查1H-MRS可见高耸的Lip峰;1例行激素治疗后第25天行MRI平扫和增强扫描,显示病变范围较前进展(图2e)、但强化范围较前明显缩小(图2f)。
4.影像诊断
11例弥漫性PCNSL患者首次影像检查中诊断为免疫相关性病变5例,脱髓鞘病变2例,淋巴瘤3例,肿瘤性病变1例。
5.病理结果
本组中2例行手术切除,9例行立体定向活检。术后病理检查结果:送检组织内可见异形淋巴样细胞弥漫浸润(图1j);10例行免疫组化检查,提示CD20均为阳性表达(图1k),细胞增殖相关标记物Ki-67阳性率为60%~90%(中位数75%)。最终病理诊断为弥漫性大B细胞淋巴瘤10例,淋巴瘤(未具体分型)1例。
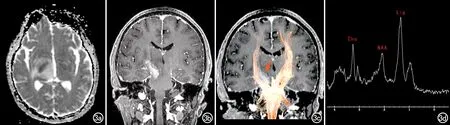
图3 男,50岁,左侧肢体乏力半月余,脑内病灶病理证实为弥漫大B细胞淋巴瘤。a)ADC图示右侧内囊后肢病灶呈明显低信号,周围可见片状水肿带呈高信号;b)增强扫描示病变沿右侧皮质脊髓束分布,呈斑片状强化;c)DTI示病变沿右侧皮质脊髓束分布(箭),邻近的神经纤维束中断、稀疏;d)1H-MRS示病变区的Cho峰增高,NAA减低,可见高耸的Lip峰。
讨 论
弥漫性PCNSL是PCNSL的一种罕见类型,表现为弥漫浸润性病变而不形成明显肿块,既往也称为脑淋巴瘤病。1978年Tadmor等[7]报道一例CT表现为弥漫性低密度而无明显肿块的PCNSL,1999年Bakshi等[1]报道2例MRI表现为弥漫浸润性病变的PCNSL,并首次提出将其命名为脑淋巴瘤病。此后,国内外学者陆续有不少相关研究报道,但主要以个案或小样本病例为主[8-10],国内学者刘效辉等[11]于2016年首次以脑淋巴瘤病报道了1例,至今中英文文献中报道的病例数不足百例。2021年陈智杰等[4]对58例脑淋巴瘤病的临床及MRI表现进行较详细的样本量最大的研究。然而,术语“脑淋巴瘤病”尚未被广泛认可。有学者认为表现为弥漫浸润性病变的PCNSL命名为“弥漫性PCNSL”更合理和精准[5],而且最新的2021年WHO中枢神经系统肿瘤分类标准中并无脑淋巴瘤病的分类[12]。弥漫性PCNSL的临床表现和影像学特征均不典型,临床实际工作中对本病的认识不足,易导致误诊。
1.临床特征
弥漫性PCNSL患者的发病年龄为19~85岁,主要见于中老年人,以往有文献报道患者的平均年龄约57岁,男女比例相当[5]。本组患者的平均年龄为53.5岁,与文献报道接近,但本组患者中以男性多见,与Ruan等[13]学者报道的结果相似。弥漫性PCNSL常见临床表现为进行性的步态不稳、认知功能障碍和精神行为异常,而其它脑肿瘤患者常见的头痛、恶心呕吐、癫痫发作等临床表现相对少见,可能与弥漫性PCNSL以深部脑白质分布为主、呈弥漫浸润性生长故而无明显占位效应有关。本组中5例患者出现肢体乏力,可能与病变沿皮质脊髓束分布并累及内囊有关。本组11例患者均无免疫缺陷病史,与以往认为的非典型PCNSL与免疫功能缺陷/低下有关的观点不同[14],目前文献报告弥漫性PCNSL患者仅极少数存在免疫功能缺陷[15],说明弥漫性PCNSL的发生可能与个体的免疫功能无明显相关性。
2.多模态影像表现
弥漫性PCNSL的分布特征为非对称性弥漫脑白质病变,主要位于深部脑白质、基底节区或沿皮质脊髓束分布,也可累及皮层及皮层下白质、侧脑室周围、胼胝体、脑干、丘脑和小脑,甚至向下蔓延至脊髓[5,13,16]。随着病程进展、病变范围逐渐增多、增大,病变分布具有整个中枢神经系统弥漫浸润的趋势[5]。本组中有6例患者呈沿皮质脊髓束分布,与文献报道的研究表明弥漫性PCNSL具有沿皮质脊髓束向上或向下扩散的趋势相一致[5,13]。
弥漫性PCNSL的CT平扫表现为等或稍低密度为主,部分呈稍高密度,与典型PCNSL常见的稍高密度影不同,可能与弥漫性PCNSL肿瘤细胞浸润程度及未形成局限性肿块有关。病变在平扫MR序列上,主要表现为T1WI稍低信号、T2WI稍高信号和FLAIR高信号,以T2-FLAIR显示病变为最佳,能发现CT平扫漏诊的等密度病灶且对病变范围的显示更精确。病灶主体在DWI上呈稍高信号、ADC图上呈等~稍高信号,其内可见散在小斑片状区在DWI上呈稍高信号、在ADC图上呈稍低信号。此外,本组中2例病灶表现为扩散明显受限,与以往文献报道相似[13,17]。笔者认为扩散受限程度与肿瘤细胞浸润程度及分布有关,扩散受限区域的肿瘤细胞浸润较明显、肿瘤细胞排列较致密。
弥漫性PCNSL在首诊时的MR增强扫描图像上,主要表现为无强化或散在斑点、斑片状的非肿块样强化,随访过程中可见强化范围逐渐增大甚至出现结节状/肿块样强化。本组病例首次MR增强扫描表现:8例仅呈现散在斑点状或小斑片样强化;3例沿皮质脊髓束走行,呈斑片状强化;1例累及脊髓,表现为脊髓内散在多发斑片状强化。在短期随诊过程中(均未经激素及放化疗等治疗)发现病变范围进展及强化范围增多,原未见明显强化区域可观察到新增异常强化灶,强化方式从斑点状、斑片状强化发展为结节、团块状均匀明显强化,与Izquierdo等[18]的研究结果基本一致。此表现可能与弥漫性PCNSL淋巴样细胞浸润程度有关,早期血脑屏障破坏较轻、强化范围较小,随着病变进展血脑屏障进一步破坏、强化范围增大、强化程度更加明显。本组2例在随诊过程中(未经激素治疗或放化疗等治疗)呈现结节、团块状强化,与阮志兵等[19]报告4例弥漫性PCNSL进展为结节肿块性病变相似,这可能提示着弥漫性PCNSL随着病变进展很有可能发展为类似典型PCNSL的结节肿块性病变。此外,本组1例在激素治疗后第25天复查时可见病变强化范围明显减小,极易误导临床,这可能与皮质类固醇激素诱导淋巴瘤样细胞凋亡和溶解而导致短期内病灶缩小、甚至消失的现象[5,19]。
本组中5例患者的MRS检查提示病变强化区域的Cho峰升高,NAA峰下降,Cho/NAA和Cho/Cr不同程度增高,符合肿瘤性病变的MRS改变,有利于与非肿瘤性病变相鉴别[20],其中2例出现高耸的Lip峰,提示病变可能富含脂质、有助于弥漫性PCNSL与胶质瘤进行鉴别。3例在TE 135 ms时出现倒置的Lac峰,这可能与弥漫性PCNSL肿瘤细胞沿血管周围浸润、导致微循环障碍、肿瘤无氧代谢有关。陈兵等[21]研究表明肿块实质成分出现高耸的Lip-Lac峰有利于非典型PCNSL的诊断,可资与脱髓鞘假瘤相区分。本组中5例行SWI检查,均提示病变区域无明显低信号、ILSS分级为0级,有利于与血管炎和脱髓鞘性病变等相鉴别[17]。本组2例病变沿皮质脊髓束分布的患者行DTI检查,提示病变区域的神经纤维束中断破坏,FA值明显减低,有利于与非肿瘤病变相鉴别。Abdelsalam等[22]研究表明PCNSL的FA值略高于高级别胶质瘤,FA的最佳诊断阈值为0.185时可较准确地鉴别PCNSL与高级别胶质瘤。目前对弥漫性PCNSL的DTI表现鲜有文献报道,有待于更大样本的研究总结。
本组4例行18F-FDG PET-CT检查,3例表现为脑组织内散在放射性浓聚,SUVmax值分别为17.2、17.4和11.2,因未形成明显结节或团块样病变,被误诊为炎性病变。胡雨等[23]研究表明当SUVmax大于15.0时提示PCNSL的可能。此外,1例患者在MRI检查后40天行PET-CT检查,表现为结节肿块样明显放射性浓聚。笔者认为这可能提示随着病程进展,病变区域肿瘤细胞浸润程度加重、排列更加致密,从而导致局部代谢明显增高。也有学者认为PET-CT图像上弥漫性PCNSL可表现为无明显放射性浓聚[24],与本文结果存在差异,这可能与弥漫性PCNSL病变进展程度及肿瘤细胞浸润程度有关。目前关于弥漫性PCNSL的PET-CT影像特点的研究仍较少,有待于进一步更大样本的研究总结。
3.误诊分析
弥漫性PCNSL的临床特征、常规MRI平扫和增强表现与免疫介导性脑炎、炎性脱髓鞘病变和弥漫型胶质瘤相似,极容易被误诊。本组11例中误诊为免疫介导性脑炎5例、炎性脱髓鞘病变2例和弥漫型胶质瘤1例。弥漫性PCNSL相对少见,相关文献报道较少,对本病认识不足是临床工作中发生误诊的主要原因。其次,本病经激素治疗后可短期好转,容易误导临床,且若在此期间活检取材很可能出现假阴性。本组1例激素治疗两周后进行穿刺活检,但病理检查难以确定诊断,停用激素一个月后再次活检才明确确诊为弥漫性PCNSL。此例患者的表现,与Velasco等[25]报道的类固醇激素治疗可降低PCNSL患者活检诊断阳性率相一致。此外,临床上在免疫介导脑炎、炎性脱髓鞘病变患者中常可发现脑脊液及血清学标志物的异常,如寡克隆带区和自身抗体阳性等,虽然相应标志物特异性高、但敏感性低。尽管如此,脑脊液及血清学标志物在临床工作中应常规检查,如果呈现阳性,有助于鉴别诊断。
综上所述,弥漫性PCNSL是PCNSL的罕见类型,其临床特征和常规MRI表现缺乏特异性,诊断较困难,充分利用多模态影像学检查有利于本病的诊断。笔者认为在临床工作中若遇到以下几点应该考虑到弥漫性PCNSL的可能:①主要临床表现为肢体乏力、行为异常、步态不稳和认知障碍等;②病变分布特点为非对称性弥漫性脑白质病变,以深部脑白质、基底节区为主,可累及胼胝体,或沿皮质脊髓束分布;③MR平扫呈稍长T1、稍长T2信号,增强后早期无明显强化或呈斑点状、斑片状强化,随病程进展病变范围增大,强化方式可从斑点、斑片状强化演变为结节或肿块样强化;④MRS表现为NAA峰下降、Cho峰增高、可出现Lip-Lac峰,DTI示病变区域纤维束中断破坏、FA值明显减低,PET-CT表现为散在放射性浓聚。尤其临床脑脊液及血清学标记物检查如寡克隆带、自身抗体和脱髓鞘四项等为阴性结果时,更应高度怀疑弥漫性PCNSL的可能,应及时行MR或CT引导下立体定向活检术,应尽量避免在激素治疗后立即进行穿刺活检。

