柑橘种质对柑橘轮斑病菌的抗性评价*
刘凤娇, 乔兴华, 胡军华, 周慧珍,张嘉, 陈娜, 陈力, 江东, 周彦
1. 西南大学 柑桔研究所, 重庆 400712; 2. 重庆市万州区植物保护与果树技术推广站, 重庆 万州 404020
柑橘轮斑病(Pseuduofabraeacitricarpa)是一种由柑橘假叶埋盘菌引起的低温诱导性真菌病害[1-3], 该病对柑橘的叶片、 叶柄、 嫩梢、 枝干、 茎、 果实等均具有侵染性. 植株染病后在初期呈针尖大小水浸状暗褐色斑点, 随后病斑迅速扩大呈轮纹状, 病情进一步发展, 叶片干枯、 木质部变色, 甚至扩展至韧皮部, 从而出现大量枯枝、 落叶及落果, 病害发生严重的果园大面积被毁, 造成巨大的经济损失[4-5].
柑橘轮斑病于2012年在陕西城固的温州蜜柑和金柑上首次被发现[1], 2018年又突然在重庆万州尤力克柠檬果园暴发[4], 2019年在湖北宜昌的温州蜜柑和湖南吉首的椪柑上也观察到了柑橘轮斑病的发病症状[6], 呈现出由北向南扩散的趋势. 徐永红等[7]对柑橘轮斑病适生区域的预测发现, 柑橘轮斑病对长江上中游柑橘优势区及鄂西—湘西两大柑橘产区具有重大威胁; 占爽等[4]研究发现柑橘轮斑病菌对苹果和梨也具有侵染性, 表明柑橘轮斑病对我国果树产业具有较大的潜在威胁.
Yang等[8]基于SCAR标记开发了P.citricarp的快速鉴定法为病害监测提供了有效方法. 占爽等[4]、 朱丽[5]通过室内毒力测定的方法筛选了部分药剂, 为田间病害防控提供保障. 但是, 柑橘轮斑病传染力极强, 发病速度快, 目前尚未准确掌握柑橘轮斑病的最佳防治方法[9], 一旦病害暴发, 防控难度较大. 抗病品种的选育和利用是控制植物病害的有效措施, 评价柑橘品种(种质)的抗病性对于种质资源抗病性鉴定与评价有重要意义, 可为我国对柑橘轮斑病实施预防和防控措施提供科学依据. 本试验建立了一套柑橘轮斑病菌的抗性鉴定体系, 并在此基础上对83份柑橘种质开展抗性鉴定, 以期筛选对柑橘轮斑病有较强抗性的种质资源, 挑选优良柑橘抗病品种, 继而挖掘抗柑橘轮斑病相关基因, 为柑橘轮斑病的防治和优良柑橘品种选育提供科学的理论依据.
1 材料与方法
1.1 试验材料
供试菌株: 柑橘轮斑病菌(Pseuduofabraeacitricarpa)WZ1菌株分离自重庆市万州区尤力克柠檬叶片, 对菌株进行鉴定并保存[4]; DS3菌株分离自陕西省城固县斗山基地本地早橘叶片, 由西南大学植物保护学院杨宇衡老师赠送[8]. 菌种活化后在PDA培养基上20 ℃恒温培养7 d, 保存备用.
植物材料: 83份柑橘种质均采自西南大学柑桔研究所国家柑橘种质资源圃. 2021年11-12月期间选取当年抽发的健康、 粗细均匀、 成熟度一致的秋梢, 清水冲洗后用75%乙醇表面消毒15 s, 无菌水漂洗3次, 置于托盘中保湿备用.
1.2 试验方法
1.2.1 室内接种方法
采用离体枝条烫伤接种法[10], 略有改动. 枝条两端用石蜡封口. 电烙笔(0.3 cm×0.3 cm)400 ℃提前预热1 min, 间隔一定的距离烫伤树皮2 s, 在烫伤部位接种直径5 mm菌饼, 以接种无菌PDA作为空白对照. 接种后的枝条置于托盘内20 ℃保湿培养. 每个处理接种15根枝条, 每根枝条上2个接种点, 4次重复. 于接种后3 d, 5 d和8 d观察枝条的发病情况, 采用十字交叉法测量病斑直径.
数据分析: 运用SPSS 25.0软件对各重复进行统计分析, 采用Tukey HSD和邓肯氏新复极差法对不同处理病斑平均直径及病情指数进行数据统计学分析.
1.2.2 抗病性评价方法
参考《农药田间药效试验准则(二)第98部分: 杀菌剂防治杧果炭疽病》(GB/T 17980.98—2004)中对杧果炭疽病的划分标准[11], 根据病斑面积占枝条面积的比例进行发病级别划分: 0级, 无病斑; 1级, 病斑面积占枝条面积的5%以下; 3级, 病斑面积占枝条面积的6%~15%; 5级, 病斑面积占枝条面积的16%~25%; 7级, 病斑面积占枝条面积的26%~50%; 9级, 病斑面积占枝条面积的51%以上. 根据病斑占枝条面积的比例分级, 统计各个级别的病斑数, 计算病情指数(DI)和抗性分级.
病情指数=∑(相对病级数值×各级病斑数)/(最高发病级数×调查总病斑数)×100
病情指数法: 抗性分级标准参照《柑橘种质资源描述规范》(NY/T2930—2016)中柑橘炭疽病抗性标准并进行调整[12], 依据病情指数划分为: 高抗(DI<15.0), 抗病(15.0≤DI<30.0), 中抗(30.0≤DI<40.0), 感病(40.0≤DI<60.0), 高感(DI≥60.0).
系统聚类分析法: 参考周娜等[13]对柑橘蒂腐病菌的评价方法, 依据病情指数, 采用SPSS 25.0软件对不同处理方法、 聚类距离和聚类方法的组合进行数据分析, 筛选出最合适的系统聚类分析方法.
病斑平均直径法(简称AD法): 参考周娜等[14]对柑橘蒂腐病菌的评价方法并调整:
AD=∑发病点病斑直径/接种点数
抗性分级标准: 免疫(I)为AD=0 mm, 高抗(HR)为0 mm
2 结果与分析
2.1 抗病性评价方法的建立
2.1.1 WZ1菌株接种后病斑直径及病情指数
采用烫伤法在少核默科特橘橙、 北京柠檬、 早津温州蜜柑、 韦尔金橘、 尤力克柠檬5个品种上接种WZ1菌株, 观察3 d, 5 d, 8 d并记录病斑直径. 结果发现, 整个观察期对照均不发病, WZ1菌株接种处理3 d时, 接种部位均出现褐色梭形病斑, 病斑直径与病情指数从大到小依次为早津温州蜜柑、 韦尔金橘、 少核默科特橘橙、 尤力克柠檬、 北京柠檬. 接种5 d和8 d时, 病斑直径与病情指数从大到小依次为尤力克柠檬、 早津温州蜜柑、 韦尔金橘、 少核默科特橘橙、 北京柠檬. WZ1菌株接种5~8 d, 5个柑橘品种的病斑直径逐渐增大, 病斑直径和病情指数差异有统计学意义(图1、 图2).

小写字母不同代表不同品种间差异有统计学意义(p<0.05).图1 WZ1菌株接种5个柑橘品种的病斑直径

小写字母不同代表不同品种间差异有统计学意义(p<0.05).图2 WZ1菌株接种5个柑橘品种的病情指数
2.1.2 WZ1菌株和DS3菌株接种5 d病斑直径及病情指数
接种WZ1菌株、 DS3菌株于少核默科特橘橙、 北京柠檬、 早津温州蜜柑、 韦尔金橘、 尤力克柠檬枝条上. 结果发现, 对照在整个观察期均不发病. 接种5 d时, 2个菌株在供试品种枝条上均可产生褐色梭形病斑. 接种WZ1菌株病斑直径及病情指数从大到小依次为尤力克柠檬、 早津温州蜜柑、 韦尔金橘、 少核默科特橘橙、 北京柠檬, 接种DS3菌株平均病斑直径及病情指数从大到小依次为韦尔金橘、 早津温州蜜柑、 尤力克柠檬、 北京柠檬、 少核默科特橘橙. 5个品种接种WZ1菌株和DS3菌株5 d时病斑直径及病情指数差异均有统计学意义(图3、 图4).
据此, 采用离体柑橘当年生成熟秋梢枝条烫伤法接种, 20 ℃保湿培养5 d时的病斑大小及病情指数, 可作为抗柑橘轮斑病菌评价标准方法.
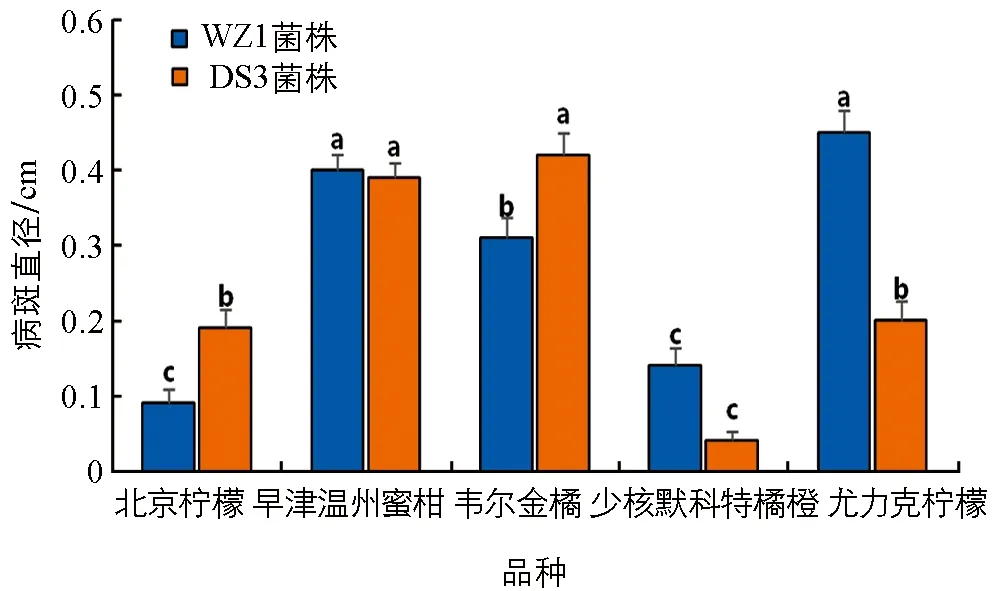
小写字母不同代表不同品种间差异有统计学意义(p<0.05).图3 WZ1菌株和DS3菌株接种5 d病斑直径比较

小写字母不同代表不同品种间差异有统计学意义(p<0.05).图4 WZ1菌株和DS3菌株接种5 d病情指数
2.2 抗病性评价
试验结果看出, 83个种质枝条接种WZ1菌株5 d时, 病斑直径范围为0.07~1.02 cm. 宽皮橘中立花橘、 新会甜橘发病严重, 病斑直径超过0.8 cm; 金乐柑、 聂都野橘No.1、 莽山野橘(尖叶)发病较轻, 病斑直径小于0.3 cm. 甜橙中发病最重的是塔罗科血橙, 病斑直径0.68 cm; 枸头橙、 红河大翼橙、 刘金刚甜橙发病轻, 病斑直径小于0.3 cm. 柚子中发病最重的是绿柚, 病斑直径0.66 cm; 古巴柚、 楚门文旦病斑直径小于0.3 cm. 柠檬类发病最重的是尤力克柠檬, 病斑直径0.45 cm; 北京柠檬发病较轻, 病斑直径0.09 cm. 金柑类中四季橘发病较重, 平均病斑直径0.68 cm. 其余品种平均病斑直径均小于0.3 cm. 3种评价方法均可将83个柑橘属种质划分为高抗、 抗病、 中抗、 感病和高感5类(表1).

表1 柑橘种质对柑橘轮斑病菌WZ1菌株的抗病性反应

续表1
当聚类分析法采用病情指数原始数值不转换、 聚类距离采用欧式距离、 聚类方法采用质心聚类法时聚类效果与发病情况吻合度最好. 以欧式距离5作为最佳聚类分割点, 将83个柑橘种质分为5类(图5). 第1类包括野生金豆、 北京柠檬、 楚门文旦、 聂都野橘No.1等17个品种, 病情指数范围为3.17~14.49; 第2类包括枸头橙、 晚锦橙、 大香橼等36个品种, 病情指数范围为15.84~27.01; 第3类包括暹罗柚、 红江橙、 S-26锦橙等18个品种, 病情指数范围为28.91~39.10; 第4类包括金橘、 金堂绿柚、 伏令夏橙等10个品种, 病情指数范围为42.66~51.78; 第5类包括新会甜橘和立花橘, 病情指数范围为62.12~63.95及以上. AD法将供试种质划分为高抗品种20个, 抗病品种36个、 中抗品种15个、 感病品种10个、 高感品种2个. 病情指数法将供试种质划分为高抗品种17个, 抗病品种38个、 中抗品种16个、 感病品种10个、 高感品种2个.
与病情指数法和聚类分析法对澳指檬一号(高抗)、 枸头橙(抗病)、 大香橼(抗病)、 刘金刚甜橙(抗病), 瓯柑(抗病)、 莽山野橘(中抗)的划分结果不同, AD法划分为: 澳指檬一号(抗病)、 枸头橙(高抗)、 大香橼(高抗)、 刘金刚甜橙(高抗)、 瓯柑(高抗)、 莽山野橘(抗病). 病情指数法和AD法将暹罗柚和红江橙划分为抗病, 而聚类分析将暹罗柚和红江橙划分为中抗. 3种评价方法将野生金豆、 北京柠檬等16个品种划分为高抗品种, 将金橘、 金堂绿柚等10个品种划分为感病品种, 将新会甜橘、 立花橘2个品种划分为高感, 3种评价方法结果一致性较高.
3 结论与讨论
室内抗病性评价可选用叶片、 枝条、 果实、 花等作为离体接种材料[13-15], 不同的组织, 得到的鉴定结果存在一定差异[16], 选择合适的材料, 是准确评价品种抗性的基础. 占爽等[4]采用室内离体接种的方法, 测试了柑橘轮斑病菌对重庆万州地区8个规模种植的柑橘品种叶、 枝、 果的致病力, 结果显示轮斑病菌对枝条的致病性强于叶片和果实, 发病更快速、 明显. 朱丽[5]通过盆栽幼嫩枝条接种轮斑病菌孢子悬浮液发现, 病菌可侵染温州蜜柑的叶柄、 嫩梢、 枝干和茎. 枝干上的病斑会环绕嫩梢或枝干逐渐扩大导致枝条逐渐萎蔫直至整个枝干枯死. 果园发生轮斑病时, 病斑会在枝条上扩展, 进而导致整枝干枯, 造成果树大量落叶落果[4], 据此, 认为轮斑病在柑橘枝条上造成的为害大于叶片. 同时本研究在室内接种试验中发现, 采用离体叶片接种时, 在20 ℃环境中叶片不易保存, 且随着时间的推移, 病斑大小差异显著性降低, 无法准确区分各品种的抗病性差异. 因此选用离体枝条做抗病性评价组织更能反映田间真实的发病情况. 目前枝条烫伤接种法已广泛应用于抗病性评价, 臧睿等[10]测试了从陕西分离得到的61株苹果腐烂病菌对红富士和秦冠苹果的致病力, 刘普等[17]完成了梨树腐烂病抗性种质筛选, 殷辉[18]等、 张楠等[19]对苹果种质资源进行了腐烂病菌的抗病性评价.
本研究在借鉴上述研究方法上略做改进, 建立了一套柑橘轮斑病菌抗病性评价方法. 该方法致伤程度一致, 条件便于控制, 评价周期短, 20 ℃保湿培养5 d时的病斑大小即可充分显示不同品种间的差异, 在测试同一菌株接种不同柑橘品种以及不同来源菌株对同一品种的致病力时, 病斑直径差异明显, 可提高抗性评价的准确性和可靠性. 利用该评价方法对5大类83个柑橘品种进行抗病性评价, 采用3种分析方法对抗病性进行分级, 供试的83份柑橘属种质可划分为高抗、 抗病、 中抗、 感病和高感等5类, 未发现免疫种质. 3种分析方法均划分为高抗的种质16种, 包括金柑中的野生金豆、 金弹(宁波)、 金弹(温州)、 罗浮(温州)、 罗浮(宁波)5个品种, 柚子中的古巴柚、 楚门文旦、 玉环文旦柚3个品种, 宽皮橘类和甜橙类4个品种和柠檬中的北京柠檬, 以及其他类别中的3个品种. 3种评价方法均划分为高感的种质有2种, 为宽皮橘中的新会甜橘和梨花广橘. 据此, 金柑类及柠檬类种质大部分为高抗品种, 柚子类相对抗病, 而部分宽皮橘和甜橙易受柑橘轮斑病菌侵染.

图5 柑橘属83个种质对柑橘轮斑病抗性的聚类分析
柑橘轮斑病在陕西地区主要危害温州蜜柑、 椪柑、 金柑、 冰糖橘及朱红橘. 据田间调查, 柑橘感病后病情指数为14.6~33, 按感病从强到弱依次为温州蜜柑系列品种、 椪柑、 金柑及本地的城固冰糖橘、 朱红橘等, 而本地早、 柚类等品种表现出抗病特性[9,20]. 本研究结果显示, 温州蜜柑病情指数为22.76, 金柑中四季橘较感病, 其余为高抗品种, 柚子相对抗病, 与田间表现一致. 在重庆万州地区尤力克柠檬发生严重, 病情指数为18~30(待发表), 北京柠檬及纽荷尔脐橙零星发生[4]. 本研究结果显示, 尤力克柠檬病情指数为26.23, 北京柠檬为4.89, 纽荷尔脐橙为43.77, 可能是由于纽荷尔脐橙园区管理较规范造成田间发病较轻. 陈泉等[21]采用离体叶片针刺接菌法10 ℃保存28 d测量病斑直径和发病率, 对27个柑橘品种进行致病力测试发现, 北京柠檬较抗病, 尤力克柠檬、 奉节95-1脐橙对轮斑病较敏感, 与本研究结果一致; 岭南沙田柚免疫, 塔罗科血橙、 强德勒柚抗病, 温州蜜柑高感, 与本研究结果不一致. 不同来源的菌株致病力存在差异[22], 不同的接种方法及评价指标等也可能导致评价结果不同. 可以通过室内采用同一评价方法进行多菌株、 多品种评测, 并结合田间抗病性调查情况, 综合判断品种的抗病性[22].
柑橘轮斑病在我国局部发生, 但发生后对当地产业均造成严重威胁. 2009年至2019年, 柑橘轮斑病在陕西城固地区造成1.86万hm2的受害面积[9], 在重庆万州柑橘产区发病面积约达100 hm2[4]. 为防止其进一步扩散带来不可逆的损失, 柑橘轮斑病流行区域及高风险区域, 应合理布局种植品种, 建议种植北京柠檬、 少核默科特橘橙等高抗品种代替尤力克柠檬等易感病品种, 同时减少塔罗科血橙、 纽荷尔脐橙、 金橘、 金堂绿柚等感病品种的种植面积, 在柑橘轮斑病潜在威胁区应建立柑橘轮斑病预警和防控机制, 加强柑橘轮斑病的监测和综合防控.
根据筛选的抗性栽培品种, 分析其亲本是进行抗性育种设计的重要参考[16]. 集团分离分析法(BSA)技术已广泛用于植物抗病遗传区段定位[23-26]. 在已公布的柑橘基因组的基础上[27-28], 对评价的25份宽皮柑橘材料和20份柚子材料进行BSA分析抗性差异位点分析[29], 定位柑橘抗轮斑病菌关键遗传区段. 结合接菌前后尤力克柠檬和塔罗科血橙叶片组织的转录组数据分析发现[30], 抗性差异基因主要为NB-ARC. 本研究为柑橘抗轮斑病的遗传研究和抗病育种奠定了材料基础, 为进一步挖掘抗柑橘轮斑病基因提供了一定的思路.

