包埋硫铁生物填料的制备及自养反硝化性能
刘艳芳,刘晓帅,尹思婕,高 玮,张妙雨,韩严和,李再兴*
包埋硫铁生物填料的制备及自养反硝化性能
刘艳芳1,刘晓帅1,尹思婕1,高 玮2,张妙雨1,韩严和3,李再兴1*
(1.河北科技大学环境科学与工程学院,河北 石家庄 050018;2.河北科技大学建筑工程学院,河北 石家庄 050018;3.北京石油化工学院,环境工程系,北京 102617)
采用包埋固定化技术制备了包埋硫铁生物填料(ESI Filler),基于升流式自养反硝化反应器开展动态实验研究,通过改变水力停留时间(HRT)、pH值、溶解氧(DO)等运行条件,探究ESIFiller反应器的脱氮效果及微生物群落结构组成.结果表明,当进水硝酸盐氮(NO3--N)浓度为30mg/L,HRT为10h时,NO3--N去除率不断上升至99.80%.当HRT缩短为2.5h时,NO3--N去除率降至61.35%.ESIFiller反应器对pH值和DO的改变具有较高的稳定性,NO3--N平去除率可维持在82.5%以上.但对低温的耐受性较差,当温度从35℃降低至15℃时,NO3--N平均去除率由90.12%降低至68.80%.运行164d后,球体未出现破裂散落的现象,表现出较长的使用寿命.通过扫描电镜发现,填料表面疏松多孔,附着大量杆状细菌,已成为微生物的良好载体.高通量测序结果表明,包埋颗粒中优势菌属为典型的自养反硝化功能菌,丰度为80.79%.
硫自养反硝化;铁自养反硝化;包埋填料;脱氮稳定性;微生物特性
单质硫自养反硝化(SAD)工艺是利用硫自养反硝化菌以硫磺为电子供体,将硝酸盐(NO3-)还原为氮气(N2)过程.对于低C/N废水而言, SAD工艺因具有无需额外投加有机碳源、污泥产量少、成本低等优势而备受关注[1-4].但SAD过程会引起反应系统pH值降低,抑制反硝化进行,通常向系统中添加碱性缓冲物质,如石灰石、鸡蛋壳等来控制系统酸化,维持pH值的稳定,不过存在Ca2+的溶出造成出水硬度增高问题[5].此外, SAD过程中副产物SO42-也会对水质安全构成威胁.
单质铁(Fe0)被证明可以在缺氧条件作为唯一电子供体将NO3-还原为N2[6].有研究发现,在SAD系统中添加Fe0,铁自养反硝化可分担SAD过程部分NO3--N负荷,出水SO42-浓度较硫自养反硝化理论值相比最高可以减少73%,同时铁自养反硝化会产生碱度,可减缓SAD系统pH值的降低[3],与SAD系统相比,硫-铁协同脱氮系统具有一定优势.
但在实际运行过程中硫磺质软较轻,易随出水流出而降低硫源的利用率[8].包埋法作为一种新兴的固定化技术,可将微生物、硫磺等材料束缚在一定的空间之内,具有易于固液分离、剩余污泥量少、资源损耗小等优点[9-11].目前,研究多集中于异养型微生物包埋固定化.利用包埋异养反硝化菌进行脱氮,可加快反应器的启动时间,在15d TN去除率可达90%以上[12],同时包埋异养反硝化菌填料还可快速适应污水厂二级出水,具有良好的抗冲击性能[13].而目前有关自养反硝化微生物固定化技术研究却鲜有报道.
本研究以硫磺粉、单质铁粉、污泥等为原料,以聚乙烯醇-海藻酸钠为骨架材料,制备包埋硫铁生物填料,探究不同运行条件下反应器的脱氮性能,并结合扫描电镜(SEM)和微生物群落结构组成对其进行深入分析,旨在为自养微生物固定化技术在深度脱氮领域的应用提供参考.
1 材料与方法
1.1 实验用水与接种污泥
研究用水为实验室模拟废水,主要组分包含KNO3108.3~324.9mg/L、KH2PO4108.3~324.9mg/L和NaHCO3130.0~389.9mg/L.
污泥取自石家庄市某污水厂缺氧池,用自来水反复淘洗3次,测得MLSS为30g/L,MLVSS为10.2g/ L,用改良驯化培养基[14]进行为期40d的富集. 培养基组分为(g/L):Na2S2O3·5H2O 4.96;NaHCO32.52; KNO32.02;KH2PO42.00;NH4Cl 1.00; MgSO4·7H2O 0.80;FeSO4·7H2O 0.06;CaCl2·2H2O 0.01.
1.2 包埋硫铁生物填料(ESI Filler)的制备
将驯化污泥离心浓缩,与牡蛎壳粉以质量比为1:4混合,吸附20min,得到包埋体;将包埋体,硫磺粉/铁粉(=2:1)和质量分数为10%的聚乙烯醇、2%的海藻酸钠按质量比为1:1:1.2混合均匀制成粒径在6~8mm的球型颗粒,置于饱和硼酸及2%的氯化钙溶液下交联固定16h.然后在4℃下冷藏保存6h,得到ESIFiller,如图1放大部分所示,颜色偏黑,密度(1.17~1.62g/cm3)大于水,沉降性好.
1.3 实验装置
实验装置为有机玻璃制成的圆柱型升流式反应器,如图1所示.
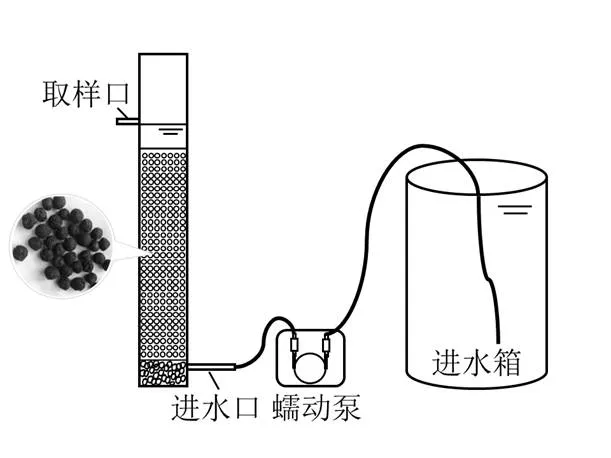
图1 ESI Filler反应器装置示意
反应器柱体尺寸为:高100cm,内径9cm,底部添加1.5~2.5cm厚的鹅卵石作为承托层,ESIFiller填充高度为75cm.进水由蠕动泵泵入反应器,在最高出水管流出.
1.4 实验方法
按表1参数运行反应器,探究ESIFiller反应器在不同运行条件下的脱氮性能.
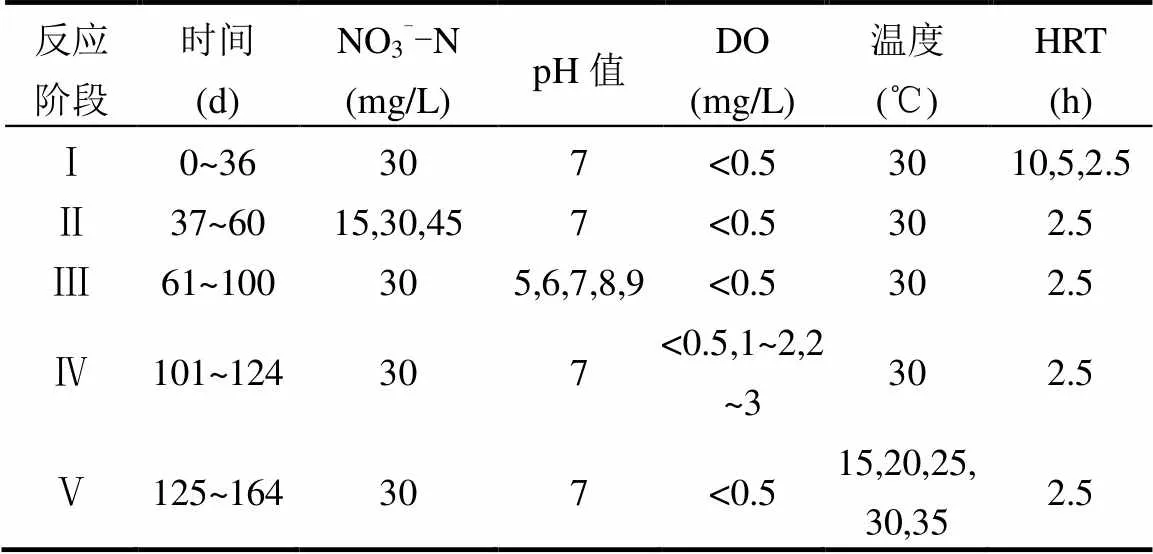
表1 反应器各阶段运行条件
1.5 微生物群落结构变化
取驯化污泥(样品A1)和运行模拟废水结束后的ESIFiller(样品A2,取自反应器中部位置)进行高通量测序,对比运行模拟废水对微生物群落结构的影响,使用正向引物338F(ACTCCTACGGG- AGGCAGCA)和反向引物806R(GGACTACHVGG- GTWTCTAAT)对细菌16S rRNA基因V3~V4区域进行PCR扩增,使用Quant-IT Pico Green双链DNA分析试剂盒(美国加利福尼亚州卡尔斯巴德Invitrogen)定量.在个体量化步骤后,以等量汇集扩增子,使用Illumina Nova Seq平台和Nova Seq 6000SP试剂盒进行双端测序,该工作委托上海派森诺生物科技有限公司完成.
1.6 水质分析方法
COD测定采用重铬酸钾法,NO3--N、NO2--N、NH4+-N和SO42-分别采用紫外分光光度法、N-(1-萘基)-乙二胺分光光度法、纳氏试剂分光光度法和铬酸钡光度法测定(UV-5100);pH值测定采用玻璃电极法(pH值S-2F),DO测定采用便携式溶氧仪法(JPB-607A).
1.7 SO42-理论生成量计算方法
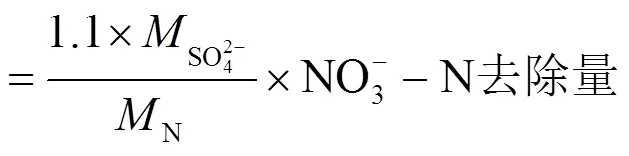
式中:为摩尔质量.
2 结果与讨论
2.1 填料中有机物质对反应器运行性能的影响
2.1.1 NO3--N的变化 由图2(b)可知,进水NO3-- N平均浓度为30.84mg/L,HRT为10h时,随着运行时间的增加,NO3--N去除率整体呈不断增高的趋势,去除率在第1d仅为34.63%,第12d增至99.80%,包埋微生物的活性得到较大提高,逐渐适应了反应器的运行环境.
Cui等[15]研究表明,采用异养启动的MBBR反应器比自养启动的MBBR反应器在启动时间、硫化物去除性能、生物量和生物活性方面具有更多优势,表明碳源对包埋填料中微生物的活性及生物量的提高具有促进作用.由于骨架材料聚乙烯醇是一种具有缓释性的有机物,部分可被微生物生长代谢利用.反应器在0~25d的释碳期为自养-异养协同脱氮系统.由图2(a)可知,出水COD呈先增高后降低的趋势,在第9d达到峰值945.0mg/L,当HRT缩短至5h时,NO3--N去除率仍可以维持在89.69%以上,表明反应器稳定性高.第25d后,将HRT从5h缩短至2.5h,碳源释放量逐渐趋于零,异养反硝化作用减弱直至消失,出水NO3--N浓度升高,NO3--N去除率降低至61.35%,达到了该系统的最大脱氮负荷.
2.1.2 NO2--N和NH4+-N的变化 如图2(c)所示,出水NO2--N浓度最高为0.6mg/L,无明显积累.HRT的缩短会导致污染物与微生物接触不足引起出水NO2--N升高,Wang等[16]将HRT由1h降为0.5h时, 出现NO2--N积累,为0.19mg/L.Fe0与NO3-的化学反应会生成NH4+-N[17],在HRT=10h时,出水中检测到少量的NH4+-N,平均浓度为0.96mg/L.但在HRT为5h、2.5h时,出水NH4+-N低于检出限,这是由于进水NO3--N浓度本身较低,随着微生物活性提高,与Fe0间的化学作用减弱[18],同时生成的微量NH+-N可作为SAD过程的一种营养物质,被微生物所消耗[19].
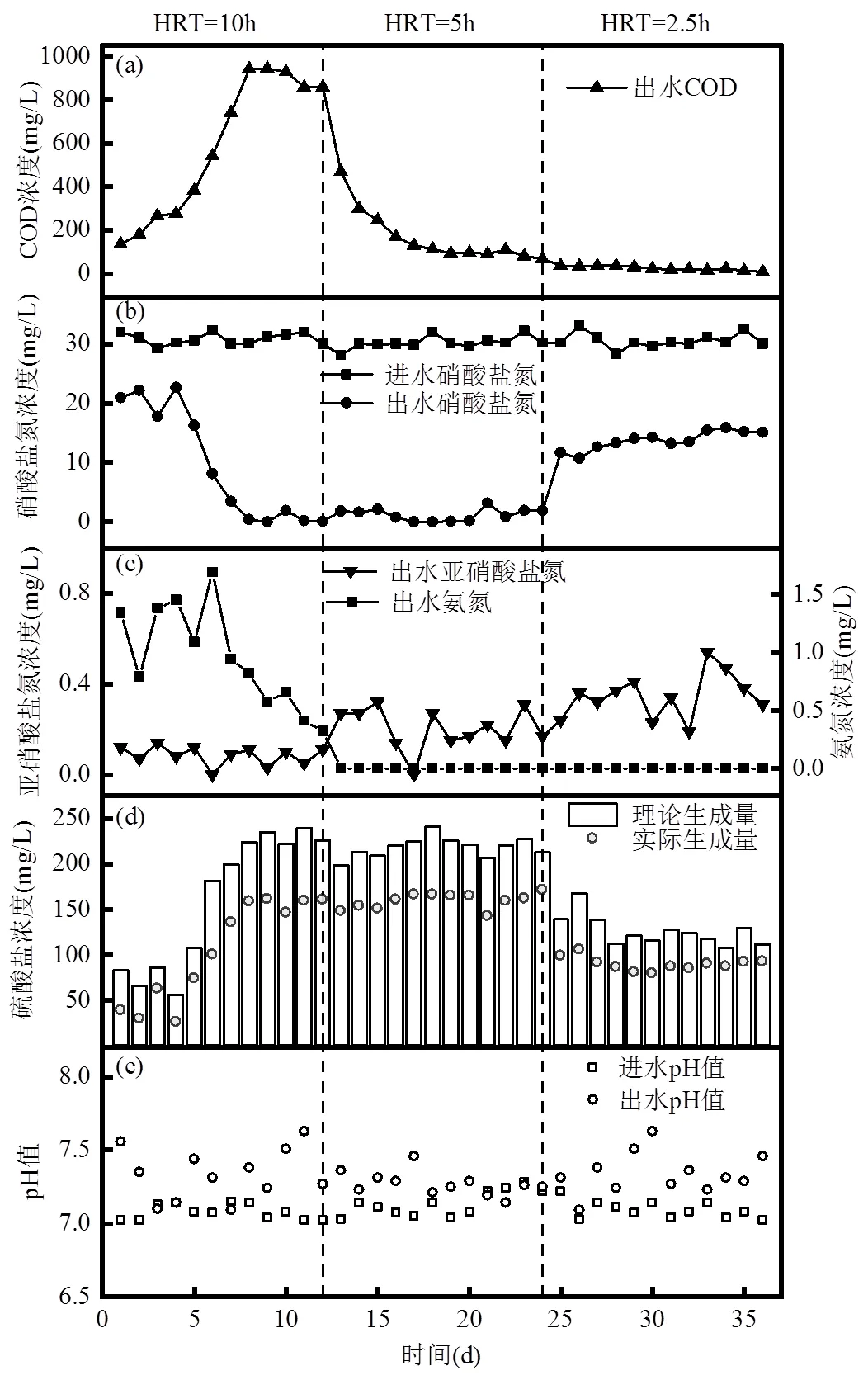
图2 有机物溶出对反应器运行效能的影响
(a)出水COD变化情况;(b)进出水硝酸盐氮变化情况;(c)出水亚硝酸盐氮、氨氮变化情况;(d)出水硫酸盐变化情况;(e)进出水pH值变化情况
2.1.3 SO42-的变化 SAD过程中会产生SO42-, Moon等[20]和Sahinkaya等[21]根据反应的化学计量得出的SO42-理论生成量与SAD过程实际生成量一致.由式(1)计算得出SAD过程理论SO42-产量为7.54mg/mg(以单位质量NO3--N计).如图2(d)所示,当HRT为10和5h时,SO42-实际生成量较理论生成量分别减少了28.32%~56.43%和19.57%~31.28%,而HRT为2.5h时主要由铁自养分担脱氮负荷,SO42-平均实际生成量较理论生成量减少了18.03%~ 37.42%,表明铁自养反硝化可承担一定量的NO3--N去除.经SO42-与NO3--N计量转换可得各阶段脱氮贡献占比.第1~24d(释碳期)反应系统内主要存在硫、铁自养和异养反硝化,其中硫自养脱氮负荷占比43.57%~80.43%,其余脱氮负荷由铁自养和异养反硝化承担.在反应第24~32d,反应系统主要为自养反硝化过程,其中硫自养脱氮负荷占比68.72%~ 81.97%,其余脱氮负荷由铁自养反硝化承担.
2.1.4 pH值的变化 反应体系pH值的稳定是维持脱氮效率的重要因素,其适宜pH值通常在6.8~8.2之间.任争鸣等[22]构建硫自养反硝化中试装置,在进水pH值为7.0时,出水pH值降低至6.0左右,pH值过低会抑制反硝化过程.如图2(e)可知,ESIFiller反应器的平均进水pH值为7.1,平均出水pH值为7.3,略有升高,无明显变化.这归因于铁自养反硝化产生的OH-可中和SAD过程产生的H+[23].因此与SAD工艺相比,硫-铁协同自养反硝化工艺可减少额外碱度的投加.
2.2 自养反硝化反应器运行效能探究
2.2.1 进水NO3--N浓度对反应器脱氮性能的影响 由图3可知,反应器进水NO3--N为15mg/L左右时,出水NO3--N浓度范围为1.44~3.45mg/L,平均去除率为85.8%.当进水NO3--N负荷提升至30,45mg/L左右时,平均去除率有所减小,但波动不大,分别为79.7%和72.1%.中间产物NO2--N的生成量较小,出水浓度在0.07~0.24mg/L之间波动,自养反硝化过程中NO2--N转换为N2的速率要快于NO3--N转换为NO2--N的速率,反应体系内一般不会存在较高的NO2--N积累[24].以上分析表明进水NO3--N负荷的提高对反应体系脱氮性能未造成较大影响,反应器稳定性高.
2.2.2 进水pH值对反应器脱氮性能的影响 由图4(a)可知,反应器进水pH值平均值为5.0、6.1、7.0、8.0和9.0的5个阶段,对应的出水pH值平均值分别为6.5、7.0、7.5、8.0和8.0.发现进水偏酸性时,反应器对pH值有良好的缓冲效果.当进水pH值提升至9.0时,出水pH值反而有所降低.这是由于进水pH值较高阻碍了填料内碱性缓冲材料的溶出,这也体现了SAD是一个产酸过程.
Liu等[25]通过批次实验发现pH值低于5.5时SAD过程受到严重抑制,而与其不同,ESIFiller反应器进水平均pH值由7.0降低至5.0左右时, NO3--N平均去除率仅降低2.7%.进水pH值的改变对ESIFiller反应器NO3--N去除率影响不大,平均去除率可以稳定在82.5%以上,如图4(b)所示.由于包埋使大量微生物固定在填料内部,可有效增加微生物与模拟废水之间的缓冲距离,提高微生物对环境的适应性.当进水pH值为8~9时,NO2--N积累最高.pH值会改变底物以及微生物酶的带点状态,从而对NO2--N的降解速率及NO2--N还原酶活性产生影响[26].
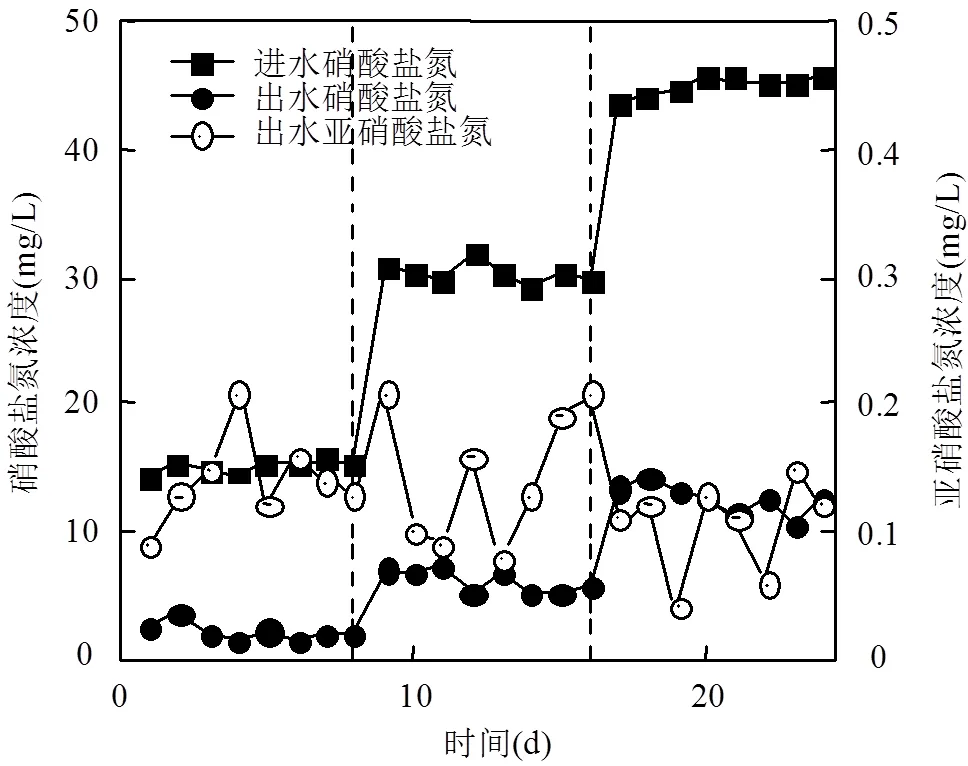
图3 进水NO3--N浓度对反应器脱氮性能的影响
2.2.3 进水DO浓度对反应器脱氮性能的影响 当进水O2浓度较高时,O2可以产生游离O2-,由于专性厌氧微生物不具备破坏O2-的超氧化物歧化酶(SOD)而被O2-杀死[27],导致反应系统失稳.Qambrani等[28]的研究表明,反应体系DO浓度从0.3mg/L升至7.19mg/L时,会抑制NO3--N去除.由图5(a)可知,当ESIFiller反应器将进水DO调节至1~2mg/L和3~4mg/L后,出水DO均低于0.5mg/L,Fe0可以吸收进水中的部分DO[29],降低DO对反硝化菌的毒害.另外,在进水DO较高时,O2较NO3--N或NO2--N更容易作为末端电子供体引起出水SO42-升高,因此提高反应器对DO的适应性是必要的.
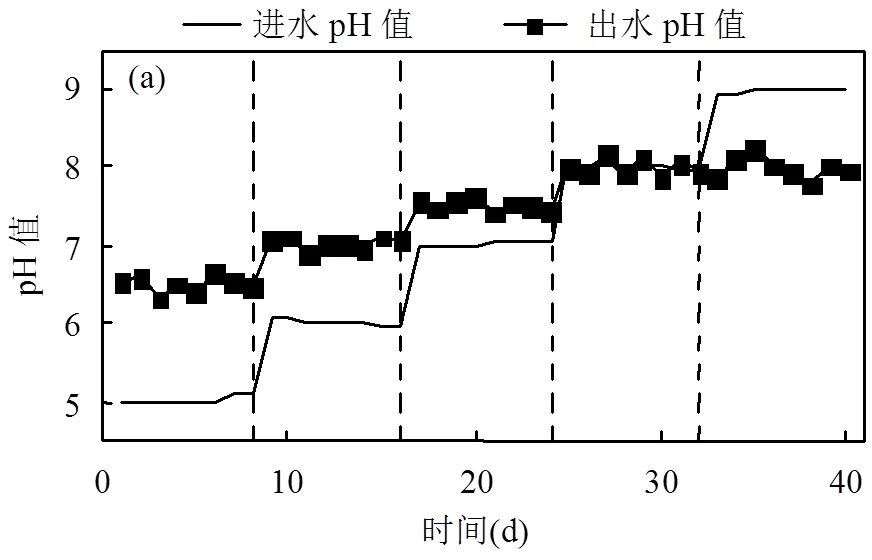
(a)进出水pH值变化情况;(b)进出水硝酸盐氮、亚硝酸盐氮变化情况
如图5(b)所示,进水NO3--N为30mg/L左右时,改变进水DO对反应器NO3--N去除效果影响不大,出水NO3--N平均去除率可保持在87.0%以上,出水NO2--N低于0.13mg/L.表明ESIFiller反应器对进水DO有较强的缓冲作用,稳定性较高.
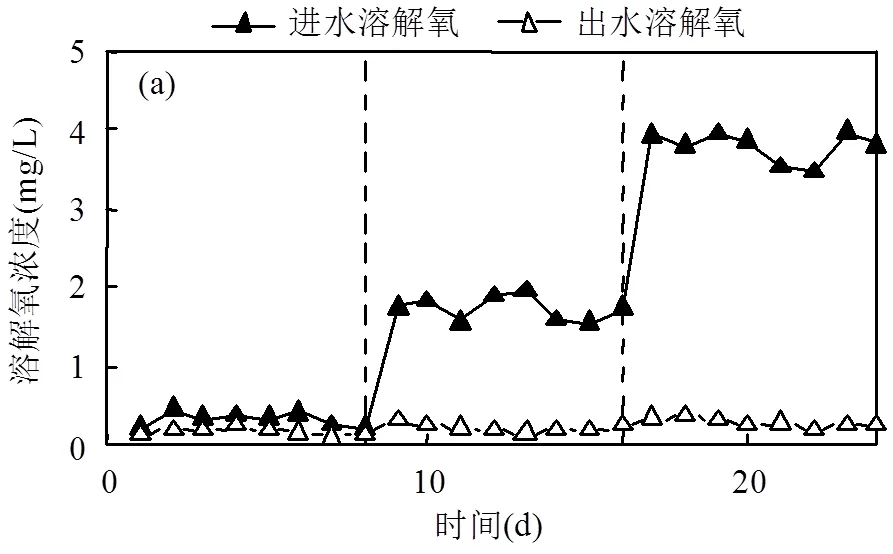
(a)进出水溶解氧变化情况;(b)进出水硝酸盐氮、亚硝酸盐氮变化情况
2.2.4 反应温度对反应器脱氮性能的影响 自养反硝化作为生物驱动的脱氮工艺,受温度的影响变化较大.由图6可知,在30和35℃时反应器脱氮效果最好,NO3--N平均去除率为89.16%和90.12%,出水NO2--N低于检出限,NO3--N可完全转换为N2. Fajardo等[30]以小瓶为反应装置,通过批次实验探究了不同温度下以S2-为电子供体的自养反硝化脱氮性能,温度为35℃时NO3--N去除率可达95.0%,与本实验最佳温度一致.温度降低至15℃后,微生物受低温的影响,脱氮效果较低,NO3--N平均去除率为68.80%,显然需要延长HRT才能达到相同的脱氮效果.低温时出水中有少量NO2--N积累,有研究表明亚硝酸盐还原菌较硝酸盐还原菌对低温的适应性要更差[31].
与改变pH值和DO不同,ESIFiller反应器对低温的抗冲击负荷性能稍有欠佳,以包埋微生物来提高反应系统对低温的适应性作用有限.ESIFiller反应器最佳运行温度应为30~35℃适宜自养反硝化微生物的生长繁殖,脱氮效率最高.
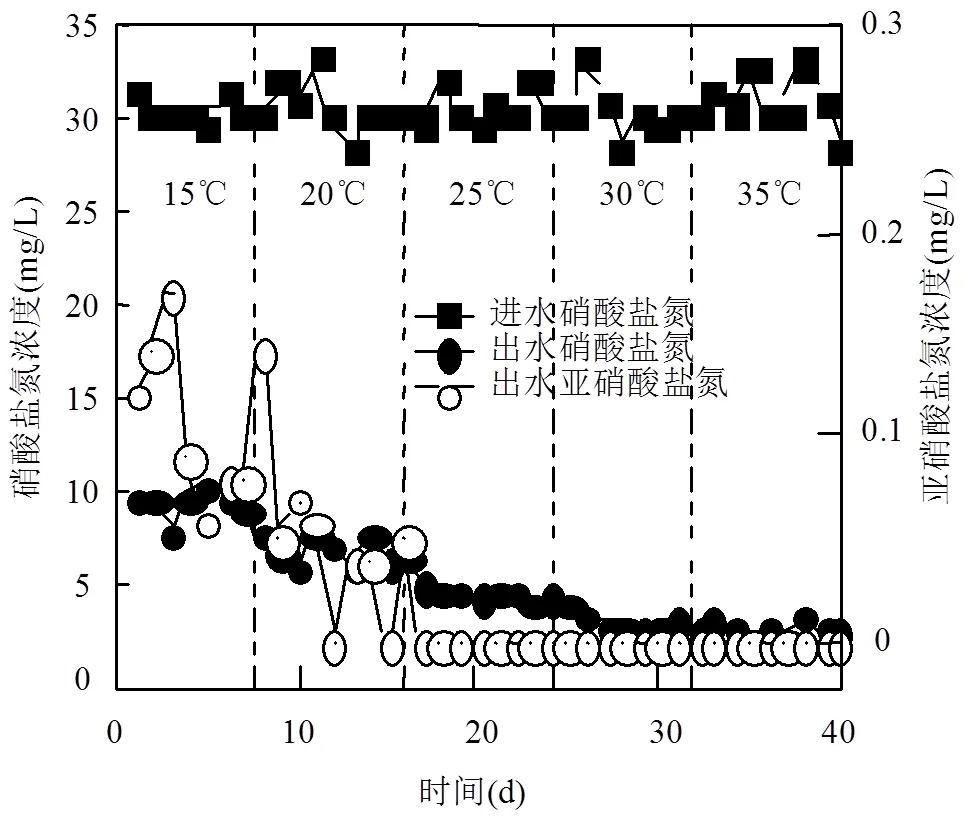
图6 温度对反应器脱氮性能的影响
2.3 微生物群落结构分析
2.3.1 SEM观察 在结束脱氮性能的探究试验后,取反应器内的填料进行电镜扫描.由图7(a)(b)可知,填料表面疏松多孔,以保证固-液两相之间的传质畅通,促进微生物的生长代谢,使其保持活性.并呈不规则的形状分布,为微生物在填料上生长繁殖提供附着点,可以看出其中包含了大量的杆状细菌,其大小为(0.1~0.3)μm×(0.6~1.0)μm.杆状细菌的大小和形态与自养反硝化优势菌属脱氮硫杆菌()的描述一致[32].图7(d)为运行164d后ESIFiller的照片,与初始的ESIFiller(图7(c))对比可看出,部分硫磺铁粉等物质被微生物消耗利用,包埋颗粒表面稍有缺失,但整体骨架结构未发生破碎、裂解等变化,表明ESIFiller具有较好的机械强度与稳定性,应用前景好.

图7 SEM表征结果及ESI Filler实物图
2.3.2 微生物群落结构组成分析 在对样品A1,样品A2中的微生物结构组成进行门水平上的分析,由图8(a)所示.在门水平上,Proteobacteria(变形菌门)占比最高,丰度分别为46.02%、94.72%.Zhang等[3]实验也证明了Proteobacteria是硫-铁协同自养反硝化体系的优势菌门.Proteobacteria为细菌中最大的一门,包含了大量具有NO3--N、NO2--N还原作用的相关细菌,属于革兰氏阴性菌[33-34].
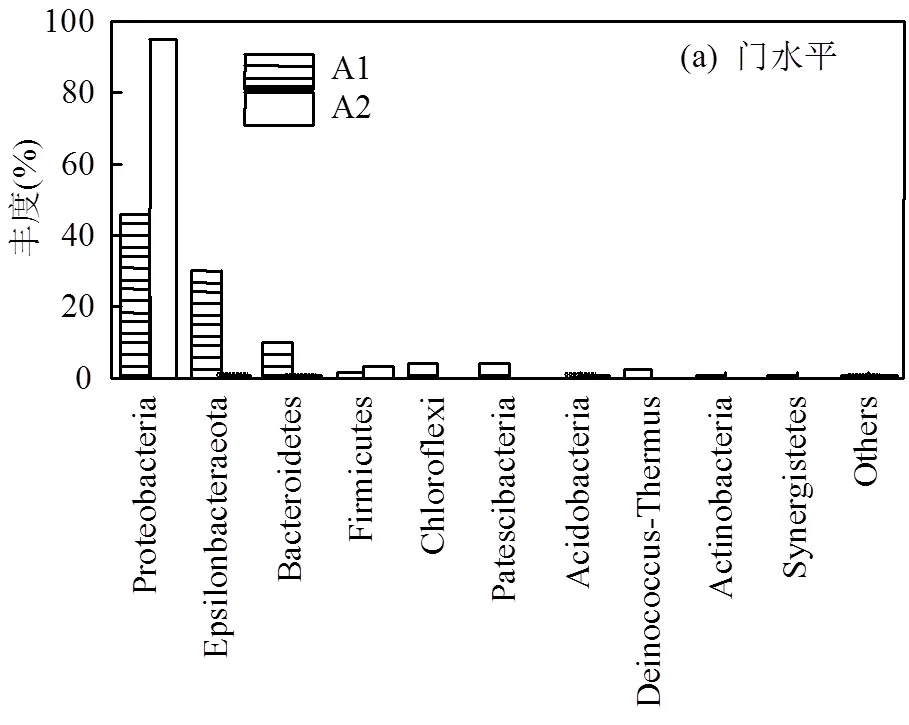
对A1、A2两种反应体系中的群落结构组成进一步进行属水平上的分析.由图8(b)可知,(硫杆菌属)在2个反应体系中均占比最高,分别可达40.55%、80.79%.ESIFiller反应器在运行模拟废水阶段结束后,丰度增加40.24%,这也证实了SEM电镜的观察结果.是较早被发现的具有自养反硝化功能的优势菌属,其中[35]属于专性无机化能自养型细菌,可以以还原性硫(S2-、S0、S2O32-等)为电子供体,NO3--N和NO2--N为电子受体,将其还原为N2,在地球的N、S循环中起着重要的作用.
(铁氧化菌属)具有氧化Fe2+还原NO3--N的特性,是铁自养反硝化中常见的一种菌属,也是以上2个反应体系中存在的主要铁自养反硝化菌之一[8].属中的反硝化硫单胞菌()也是一种典型的自养反硝化菌,除可以利用还原性硫外,还可利用H2还原NO3-[36].在驯化菌泥中含量较高,反应器运行阶段含量较少.这说明较更适合硫-铁协同自养反硝化系统.
3 结论
3.1 在ESIFiller反应器中,进水NO3--N浓度30mg/L时,HRT从10h缩短至2.5h后,出水NO3--N去除率由99.80%降低至61.35%.控制HRT为2.5h,进水NO3--N浓度由15mg/L升至45mg/L时,NO3--N去除率由85.8%变为72.1%,反应体系稳定性较高.
3.2 ESIFiller反应器SO42-的实际生成量整体上要低于硫自养反硝化理论值,表明铁自养反硝化可分担部分脱氮负荷.进水pH值和DO变化对反应器脱氮效果影响较小;温度对系统影响较大,当温度从35℃降低至15℃,NO3--N平均去除率由90.12%降低至68.80%.
3.3 对微生物群落组成进行分析,硫-铁自养反硝化动态实验结束后,主要功能菌的丰度较接种污泥相比增加了40.24%.
3.4 包埋填料经历164d的运行,球体未出现破裂散落的现象,表现出较长的使用寿命;结合扫描电镜分析,其结构有利于细菌在填料上正常生长代谢.
[1] 付炳炳,潘建新,马景德,等.采用含硫铁化学污泥作为反硝化电子供体进行焦化废水中总氮深度去除[J]. 环境科学, 2018,39(7):3262- 3270.
Fu B B, Pan J X, Ma J D, et al. Evaluation of advanced nitrogen removal from coking wastewater using sulfide iron-containing sludge as a denitrification electron donor [J]. Environmental Science, 2018, 39(7):3262-3270.
[2] 周彦卿,郝瑞霞,刘思远,等.新型硫铁复合填料强化再生水深度脱氮除磷[J]. 环境科学, 2017,38(10):4309-4315.
Zhou Y Q, Hao R X, Liu S Y, et al. improving nitrogen and phosphorus removal from reclaimed water using a novel sulfur / iron composite filler [J]. Environmental Science, 2017,38(10):4309-4315.
[3] Zhang L L, Song Y D, Zuo Y, et al. Integrated sulfur- and iron-based autotrophic denitrification process and microbial profiling in an anoxic fluidized-bed membrane bioreactor [J]. Chemosphere, 2019,221:375- 382.
[4] Vo T, Kang S, An S, et al. Exploring critical factors influencing on autotrophic denitrification by elemental sulfur-based carriers in upflow packed-bed bioreactors [J]. Journal of Water Process Engineering, 2021,101866.
[5] Xu Y X, Chen N, Feng C P, et al. Sulfur-based autotrophic denitrification with eggshell for nitrate-contaminated synthetic groundwater treatment [J]. Environmental Technology, 2016,37(21- 24):3094-3103.
[6] Shin K H, Cha D K. Microbial reduction of nitrate in the presence of nanoscale zero-valent iron [J]. Chemosphere, 2008,72(2):257-262.
[7] Peng L, Liu Y, Gao S H, et al. Evaluation on the nanoscale zero valent iron based microbial denitrification for nitrate removal from groundwater [J]. Scientific Reports, 2015,5:1-11.
[8] Wang J J, Huang B C, Li J, et al. Advances and challenges of sulfur-driven autotrophic denitrification (SDAD) for nitrogen removal [J]. Chinese Chemical Letters, 2020,31(10):2567-2574.
[9] 宋佳强,李 军,陈光辉,等.pH值对包埋固定化技术反硝化脱氮的影响[J]. 中国给水排水, 2019,35(3):78-82.
Song J Q, Li J, Chen G H, et al. Influence of pH on denitrification with embedded immobilized technology [J]. China Water & Wastewater, 2019,35(3):78-82.
[10] Lin Y H, Hwang S J, Wu J Y, et al. Simultaneous removal of carbon and nitrogen from swine wastewater using an immobilized-cell reactor [J]. Journal of Environmental Engineering, 2006,132(3):423-429.
[11] Sun S Y, Fan S L, Shen K X, et al. Laboratory assessment of bioleaching of shallow eutrophic sediment by immobilized pH值otosynthetic bacteria [J]. Environmental Science and Pollution Research International, 2017,24(28):22143-22151.
[12] 宋佳强,李 军,陈光辉,等.利用包埋固定化技术进行反硝化脱氮的研究[J]. 中国给水排水, 2018,34(23):105-110.
Song J Q, Li J, Chen G H, et al. Denitrification Using Embedded Immobilized Denitrifying Bacteria [J]. China Water & Wastewater, 2018,34(23):105-110.
[13] 周亚坤,杨 宏,王少伦,等.包埋反硝化填料强化二级出水深度脱氮性能研究及中试应用[J]. 环境科学, 2020,41(2):849-855.
Zhou Y K, Yang H, Wang S L, et al. Research on denitrification performance of enhanced secondary effluent by embedded denitrification filler and pilot application [J]. Environmental Science, 2020,41(2):849-855.
[14] Beller, Anaerobic H R. Nitrate-dependent oxidation of U(IV) oxide minerals by the chemolithoautotrophic bacterium thiobacillus denitrificans [J]. Applied & Environmental Microbiology, 2005,71(4): 2170-4.
[15] Cui Y X, Guo G G, Biswal B K, et al. Investigation on sulfide- oxidizing autotrophic denitrification in moving-bed biofilm reactors: an innovative approach and mechanism for the process start-up [J]. International Biodeterioration & Biodegradation, 2019,140:90-98.
[16] Wang Z, Fei X, He S B, et al. Effects of hydraulic retention time and S2O32-/NO3- ratio on thiosulfate-driven autotrophic denitrification for nitrate removal from micro-polluted surface water. [J]. Environmental technology, 2017,38(22):2835-2843.
[17] Deng S H, Li D S, Yang X, et al. Novel characteristics on micro- electrolysis mediated Fe(0)-oxidizing autotrophic denitrification with aeration: efficiency, iron-compounds transformation, N2O and NO2-accumulation, and microbial characteristics [J]. Chemical Engineering Journal, 2020,387:123409-123409.
[18] Zhang M, Zhangzhu G C, Wen S X, et al. Chemolithotrophic denitrification by nitrate-dependent anaerobic iron oxidizing (NAIO) process: insights into the evaluation of seeding sludge [J]. Chemical Engineering Journal, 2018,345:345-352.
[19] Baalsrud K S. Studies on thiobacillus denitrificans [J]. Archiv Fur Microbiologie, 1954,20(1):34-62.
[20] Moon H S, Shin D Y, Nam K, et al. A long-term performance test on an autotrophic denitrification column for application as a permeable reactive barrier [J]. Chemosphere, 2008,73(5):723-728.
[21] Sahinkaya E, Dursun N, Kilic A, et al. Simultaneous heterotrophic and sulfur-oxidizing autotrophic denitrification process for drinking water treatment: Control of sulfate production [J]. Water Research, 2011, 45(20):6661-6667.
[22] 任争鸣,刘雪洁,苏晓磊,等.硫自养反硝化深度脱氮中试研究[J]. 中国给水排水, 2016,32(19):31-35.
Ren Z M, Liu X J, Su X L, et al. Sulfur-based autotrophic denitrification process for advanced nitrogen removal [J]. China Water & Wastewater, 2016,32(19):31-35.
[23] 于 妍,刘 宁,廖祖刚,等.铁型反硝化脱氮技术研究进展 [J]. 中国环境科学, 2022,42(1):83-91.
Yu Y, Liu N, Liao Z G, et al. Research progress of iron-type denitrification removal technology [J]. China Environmental Science, 2022,42(1):83-91.
[24] Sahinkaya E, Dursun N, Kilic A, et al. Simultaneous heterotrophic and sulfur-oxidizing autotrophic denitrification process for drinking water treatment: Control of sulfate production [J]. Water Research, 2011, 45(20):6661-6667.
[25] Liu L, Koenig A. Use of limestone for pH control in autotrophic denitrification: batch experiments [J]. Process Biochemistry, 2002, 37(8):885-893.
[26] 许保玖,龙腾锐.当代给水与废水处理原理.第2版[M]. 北京:高等教育出版社, 2000:42-96.
Xu B J, Long T R. Contemporary principles of water and wastewater treatment. 3rd Edition [M]. Beijing: Higher Education Press, 2000: 42-96.
[27] 周群英,王士芬.环境工程微生物学.第3版[M]. 北京:高等教育出版社, 2008:109-224.
Zhou Q Y, Wang S F. Environmental engineering microbiology. 3rd Edition [M]. Beijing: Higher Education Press, 2008:109-224.
[28] Qambrani N A, Oh S E. Effect of dissolved oxygen tension and agitation rates on sulfur-utilizing autotrophic denitrification: batch tests [J]. Applied Biochemistry and Biotechnology, 2013,169(1):181- 91.
[29] 张 雯.以农业废弃物为基料的地下水反硝化缓释碳源材料研究及应用[D]. 南京:南京大学, 2017.
Zhang W. The research and application of sustainable long-release carbon material with agricultural waste [D]. Nanjing: Nanjing University, 2017.
[30] Fajardo C, Mora M, Fernández I, et al. Cross effect of temperature, pH and free ammonia on autotrophic denitrification process with sulphide as electron donor [J]. Chemosphere, 2014,97:10-15.
[31] Zhou W L, Liu X, Dong X J, et al. Sulfur-based autotrophic denitrification from the micro-polluted Water [J]. Journal of Environmental Sciences, 2016,44(6):180-188.
[32] 马潇然,郑照明,卞 伟,等.硫自养反硝化系统运行效能和微生物群落结构研究[J]. 中国环境科学, 2020,40(10):4335-4341.
Ma X R, Zheng Z M, Bian W, et al. Study on operation efficiency and microbial community structure of sulfur-based autotrophic denitrification system [J]. 2020,40(10):4335-4341.
[33] Xu X C, Zhang R, Jiang H B, et al. Sulphur-based autotrophic denitrification of wastewater obtained following graphite production: long-term performance, microbial communities involved, and functional gene analysis [J]. Bioresource Technology, 2020,306: 123117.
[34] 吕小梅,吴毅聪,陈桂连,等.硫自养反硝化颗粒表面与间隙微生物群落特征和基因分布[J]. 中国环境科学, 2022,42(6):2764-2770.
Lv X M, Wu Y C, Chen G L, et al. Community structure and gene distribution of the surface and interstitial biofilm in the particle sulfur autotrophic denitrification.
[35] Yu L P, Yuan Y, Chen S S, et al. Direct uptake of electrode electrons for autotrophic denitrification by thiobacillus denitrificans [J]. Electrochemistry Communications, 2015,60:126-130.
[36] Hu Q T, Wang S S, Lai Q L, et al. Sulfurimonas Indica sp. nov., a hydrogen- and sulfur-oxidizing chemolithoautotroph isolated from a hydrothermal sulfide chimney in the northwest indian ocean [J]. International Journal of Systematic and Evolutionary Microbiology, 2020,71(1):004575.
Preparation and autotrophic denitrification properties of embedded sulfur/iron biological filler.
LIU Yan-fang1, LIU Xiao-shuai1, YIN Si-jie1, GAO Wei2, ZHANG Miao-yu1, HAN Yan-he3, LI Zai-xing1*
(1.School of Environmental Science and Engineering, Hebei University of Science and Technology, Shijiazhuang 050018, China;2.School of Civil Engineering, Hebei University of Science and Technology, Shijiazhuang 050018,China;3.Department of Environmental Engineering, Beijing Institute of Petrochemical Technology, Beijing 102617, China)., 2022,42(11):5136~5143
The embedded sulfur/iron biological filler (ESI Filler) was prepared by embedding and immobilization technology, and dynamic experimental research was carried out based on the upflow autotrophic denitrification reactor. By changing hydraulic retention time (HRT), pH, dissolved oxygen (DO) and other operating conditions, the denitrification performance and microbial community structure composition of ESI Filler reactor were explored. When the influent nitrate nitrogen (NO3--N) concentration was 30mg/L and the HRT was 10h, the NO3--N removal rate increased continuously to 99.80%. When the HRT was shortened to 2.5h, the removal rate of NO3--N decreased to about 61.35%. ESI Filler reactor had high stability to the changes of pH and DO, and the average removal rate of NO3--N could be maintained above 82.5%. However, the tolerance to low temperature was poor. When the temperature was reduced from 35℃ to 15℃, the average removal rate of NO3--N decreased from 90.12% to 68.80%. After running for 164days, the spheres did not break and scatter, showing a long service life. It was found by scanning electron microscopy that the surface of the filler was loose and porous, and a large number of rod-shaped bacteria were attached, which had become a good carrier of microorganisms. The results of high-throughput sequencing showed that the dominant bacterial genus in the embedded granules was the typical autotrophic denitrifying bacteria, with an abundance of 80.79%.
sulfur autotrophic denitrification;iron autotrophic denitrification;embedding filler;denitrification stability;microbial properties
X703.1
A
1000-6923(2022)11-5136-08
刘艳芳(1984-),女,河北石家庄人,副教授,博士,主要从事水污染控制技术研究.发表论文20余篇.
2022-04-06
河北省重点研发计划项目(19273601D)
*责任作者, 教授, li_zaixing@163.com

