BN大鼠和RBL-2H3细胞作为茵栀黄注射液过敏反应模型的可行性研究
朱 昱,张军霞,周继春,李 展,李振国
(1. 河南省中医院药学部,河南 郑州 450053;2.河南省食品药品检验所药理室,河南 郑州 450003)
茵栀黄注射液是由传统中药名方茵陈蒿汤经现代工艺提取精制而成的中药注射剂,疗效确切,随着临床应用的增多,不良反应报道也不断增加,不良反应以过敏反应最多,也最严重。2016年9月1日国家药品监督管理局发布了《总局关于修订茵栀黄注射液说明书的公告(2016年第140号)》,修订公告第一条就要求“增加警示语:本品不良反应包括过敏性休克,应在有抢救条件的医疗机构使用”,但本品的现行标准为《卫生部药品标准》中药成方制剂(第14册)[1],标准中无过敏反应检查项目,本课题拟参照《药物刺激、过敏反应和溶血性研究技术指导原则》要求,通过主动全身过敏试验(active systemic anaphylaxis,ASA)[2]对茵栀黄注射液进行过敏性考察。现过敏反应检查法规定的受试对象为豚鼠[3],据文献报道,目前国内外均把BN大鼠作为常规食物过敏动物模型优选鼠系来进行进一步的免疫学研究[4,5],因此,对于中药注射剂的过敏反应,BN大鼠很可能是较豚鼠更为敏感的动物模型。已有学者[6-7]采用BN大鼠动物模型对双黄连注射液、清开灵注射液等中药注射剂展开研究,而对于过敏反应严重的茵栀黄注射液未见相关研究报道。茵栀黄注射液引起的过敏反应多为首次用药后即产生过敏反应症状,推测与类过敏反应有关,致敏机制可能主要为非IgE介导。我国目前尚无中药注射剂类过敏检测模型和指导原则,根据类过敏反应发生的机制,体外细胞模型需模拟肥大细胞(mast cell,MC)释放过敏介质,RBL-2H3大鼠嗜碱细胞性白血病细胞具有肥大细胞的许多生物学特性,是MC的理想替代模型,且可在体外稳定培养,现已广泛用于过敏反应、免疫反应等方面的研究[8-11 ]。本课题选择BN大鼠和RBL-2H3细胞进行茵栀黄注射液过敏反应的研究,并通过检测RBL-2H3细胞脱颗粒过程与Ca2+的相关性,从细胞脱颗粒的信号转导通路进一步阐明茵栀黄注射液可能的类过敏反应发生机制。
1 材料
1.1 仪器和主要试剂6470 Triple Quad LC/MS(Agilent Technologies公司);酶标仪(Molecular Devices公司,型号:FexStation3)(SoftMax Pro v5.2软件);电子天平(Mettler Toledo公司,型号:XPE205);大型离心机(Sigma公司,型号:3-30KSD);CO2培养箱(Thermo公司,型号:311);Alrstream II级A2生物安全柜(ESCO公司,型号:AC2-6S1);倒置显微镜(Olympus公司,型号:CKX41);黑色透明平底96孔板(Corning公司,型号:3603);Strata-X-C 33μm Polymeric Strong Cation固体萃取柱(phenomenex公司,60 mg/3 mL Tubes);Guinea Pig IgE ELISA KIT(R&D Systems公司,进口分装,双抗体一步夹心法,96T);RAT IgE ELISA KIT(R&D Systems公司,进口分装,双抗体一步夹心法,96T);磷酸组胺标准品(中国食品药品检定研究院,批号:150410-201313);乙腈(Merck公司,色谱级);甲醇(Merck公司,色谱级);氨水(烟台市双双化工有限公司,含量25%~28%,分析纯);盐酸(北京化工厂,含量36%~38%,分析纯);BSA(Solarbio公司,Cat.No.A8020,5 g/瓶);葡萄糖注射液(信合援生制药股份有限公司,批号:17010653,规格:100 mL:10 g);MEM(Invitrogen公司,货号:C11095500BT);PBS(Hyclone公司,货号:SH30256.01);FBS(Biological Industries公司,货号:06-002-1ACS);Non-essential Amino Acids(Invitrogen公司,货号:11140050,100×);Sodium Pyruvate 100 mmol·L-1Solution(Invitrogen公司,货号:11360070);Fluo 3-AM(同仁公司,货号:F026);0.25%Trypsin-EDTA(Gibco公司,货号:25200-056);Pluronic®F-127(同仁公司,货号:WPAI-5);DMSO(Sigma公司,货号:D2650);CCK-8(同仁公司,货号:CK04);His-rat酶鼠试剂盒(南京森贝伽公司,货号:SBJ-R0597);C48/80(Sigma公司,货号:C2313);HBSS(Gibco公司,货号:14025092);茵栀黄注射液(某药业集团有限公司,批号:170611D1,170612D2,170613D3,170613D2,170613D1,每支10 mL)。
1.2 实验动物与分组SPF级BN大鼠,♂,体质量(160±20)g,购自北京维通利华实验动物有限公司,许可证号:SCXK (京)2016-0011;清洁级Hartley豚鼠,♂,体质量(300±50)g,购自华兰生物疫苗有限公司,许可证号:SCXK (豫)2015-0001。BN大鼠和Hartley豚鼠分别随机分为阴性对照组(10%葡萄糖注射液)、阳性对照组(0.5%BSA)、茵栀黄注射液低剂量组(YZHL)和高剂量组(YZHH),每组均12只,空白组6只。
1.3 细胞株RBL-2H3大鼠嗜碱细胞性白血病细胞株,购自中国科学院细胞库。
2 方法
2.1 茵栀黄注射液对BN大鼠和豚鼠ASA试验的比较研究
2.1.1ASA致敏试验 设高、低致敏剂量组,分别为人临床用量的2倍和等倍,依据《药理实验方法学》(第四版)不同种类受试对象剂量换算得出,BN大鼠高、低剂量分别为3.96 mL·kg-1和 1.98 mL·kg-1;豚鼠高、低剂量分别为3.38 mL·kg-1和1.69 mL·kg-1,腹腔注射,注射容积按《药理实验方法学》(第四版)动物体质量与标准体质量相差不到20%,按同一公斤体质量剂量用药,隔日1次,连续3次。致敏期间每日观察各组动物反应,与空白组比较。
2.1.2ASA攻击试验 BN大鼠和豚鼠各组动物均采用2倍致敏剂量进行攻击,BN大鼠采用尾静脉快速推注,豚鼠为耳缘静脉快速推注,除空白组外每组6只分别于致敏后d 14和d 21攻击1次,攻击后即刻观察各组动物过敏反应30 min,按主动全身过敏试验评价标准分级(同时出现多种反应的动物以最强的过敏反应级别计)。主动全身过敏试验评价标准为“-”:过敏反应阴性(正常);“+”:过敏反应弱阳性(躁动、竖毛、颤抖、搔鼻);“”:过敏反应阳性(喷嚏、咳嗽、呼吸急促、排尿、排粪、流泪);“”:过敏反应强阳性(呼吸困难、哮鸣音、紫癜、步态不稳、跳跃、喘息、痉挛、旋转、潮式呼吸);“”:过敏反应极强阳性(死亡)。
2.1.3血清制备 于观察过敏反应症状30 min后采血(死亡动物除外,即刻釆血),BN大鼠眼眶采血,豚鼠心包取血,静置3 h左右,将全血于3 000 r·min-1,4 ℃离心15 min,取血清,分装,-80 ℃冻存。
2.1.4ELISA法血清IgE水平测定 用方法2.1.3项中的动物血清,采用IgE ELISA试剂盒(双抗体一步夹心法)进行血清IgE水平测定。
2.1.5LC/MS法测定血清组胺水平测定 用方法2.1.3项中的动物血清,采用建立的LC/MS法进行血清组胺水平测定。
2.1.5.1检测条件 色谱条件:Agilent C18(2.1 mm×50 mm,1.8 μm)色谱柱,乙腈-0.1%甲酸水(30 ∶70)为流动相,流速:0.4 mL·min-1,柱温:35.0 ℃,进样量:10 μL。质谱条件:电喷雾离子源(ESI),正离子模式扫描,质谱多反应检测(MRM)定量,干燥气温度为340 ℃,干燥气流速10 L·min-1,雾化器压力45 psi,鞘气温380 ℃,鞘气流速12 L·min-1,毛细管电压4 000 V(+)3 500 V(-),喷嘴电压500 V(+)500 V(-),室电流0.41 μA,检测离子对:m/z112.0>95.1,碰撞能量13 V,m/z112.0>68.0,碰撞能量23 V。
2.1.5.2样品前处理 配制30%乙腈水(0.1%甲酸)为萃取液,配制1%NH4OH甲醇溶液为洗脱液。每个血清样品取60 μL与3 mL萃取液混匀,10 000 r·min-1高速离心,取上清3 mL待过固体萃取柱,先用1 mL甲醇活化固体萃取柱,再1 mL 0.1%甲酸平衡萃取柱,然后将3 mL样品上清每次1 mL分3次过柱,弃滤液,用1 mL 0.1 mol·L-1HCL水溶液淋洗,弃滤液,再用1 mL 0.1 mol·L-1HCL甲醇溶液淋洗,弃滤液,用6 mL洗脱液每次2 mL,分3次洗脱,收集每个血清样品洗脱液,标记,室温下进行氮吹,用2 mL 30%乙腈水复溶,过0.22 μm滤膜后供测定,每个血清样品均照此处理。
2.2 茵栀黄注射液对RBL-2H3细胞类过敏反应的研究
2.2.1CCK-8法测定茵栀黄注射液对RBL-2H3细胞生长的影响 实验分设溶剂空白组(无细胞,Ab)、正常细胞组(Ac)、阳性对照组(C48/80为30 mg·L-1)、药物处理组(茵栀黄注射液浓度分别为4.16、8.33、16.67、33.33、66.67 mL·L-1),各设5个复孔,将对数期生长的RBL-2H3细胞混悬液接种于培养板,接种浓度为1.0×108个·L-1,每孔接种100 μL。将培养板置于37 ℃,5% CO2培养箱内培养过夜,次日实验组(As)分别加入5个浓度的茵栀黄注射液和C48/80,Ab和Ac组加入同体积的完全培养液,混匀后继续培养。48 h后取出培养板,小心吸弃孔内用培养上清,并用PBS小心清洗,各孔换100 μL新鲜培养液,镜下观察不同浓度药物刺激下细胞状态的差异,每孔加10 μL CCK-8溶液,37 ℃培养箱内孵育2 h,用酶标仪测定450 nm处各孔的吸光度,按以下公式计算细胞抑制率:抑制率/% =[(Ac-As)/(Ac-Ab)] ×100%。
2.2.2ELISA法测定细胞上清中组胺释放量 根据2.2.1方法得到的IC50,用完全培养液稀释成0.25倍IC50、0.5倍IC50和IC50三个加药浓度作为实验浓度。依次设阴性对照组、阳性对照组和3个浓度的药物处理组,各组设5个复孔,将对数期生长的RBL-2H3细胞混悬液接种于96孔板中,接种密度为3×108个·L-1,每孔接种100 μL,置于37 ℃,5%CO2培养箱中过夜,次日阴性对照组加培养液,药物处理组分别加3个浓度的茵栀黄注射液,阳性对照组加C48/80(30 mg·L-1),各10 μL,37 ℃,5%CO2培养箱内继续孵育1 h后终止反应,小心吸取各孔反应液置1.5 mL离心管,4 ℃,3 000 r·min-1离心25 min,小心吸取离心后上清分装200 μL离心管中,置4 ℃冰箱当天进行组胺检测。按照大鼠组胺ELISA试剂盒的方法依法操作,测定450 nm处各孔吸光度,绘制标准曲线,计算细胞上清中组胺释放量。
2.2.3细胞内Ca2+荧光强度的测定 RBL-2H3细胞除去上清液,用HBSS液小心清洗细胞3次,每孔各加含0.5% Pluronic® F-127的Fluo 3-AM新鲜工作液80 μL,37 ℃培养箱孵育30 min,小心吸弃Fluo 3-AM工作液,HBSS液小心清洗细胞3次,每孔各加HBSS溶液100 μL,37 ℃培养箱再孵育30 min。用多功能酶标仪终点法检测各孔荧光值,读板方式设为底读,激发波长488 nm,发射波长530 nm。

3 结果
3.1 茵栀黄注射液攻击后,BN大鼠和豚鼠过敏反应分级比较茵栀黄注射液攻击后,BN大鼠过敏反应症状主要包括搔鼻、躁动、排尿、步态不稳、静卧等,多发生在攻击10 min之内,数分钟后缓解;BSA攻击后,BN大鼠和豚鼠均出现不同数量的死亡。过敏反应分级比较(见Tab 1~3),两次攻击后,BN大鼠高剂量组较阴性对照组差异均有显著性(P<0.05),豚鼠高、低剂量组与阴性对照组差异均无显著性,表明给与高剂量茵栀黄注射液时,BN大鼠较豚鼠更敏感。

Tab 1 ASA symptom rating of attacking BN rats and guinea pigs on day 14
*P<0.05vsguinea pig;△P<0.05,△△P<0.01vsnegative control

Tab 2 ASA symptom rating of attacking BN rats and guinea pigs on day 21

Tab 3 Total symptom rating of BN rats and guinea pigs after two attacks
3.2 BN大鼠和豚鼠血清中IgE、组胺水平
3.2.1血清IgE水平比较(ELISA法) 对检测的结果经统计分析(见Tab 4),两次攻击后同种属动物各剂量组血清IgE水平差异无显著性。
3.2.2血清组胺水平比较(LC/MS法)
3.2.2.1组胺标准品及典型血清样品中组胺的色谱图,见Fig 1。
3.2.2.2组胺的特征质谱图,见Fig 2。
3.2.2.3线性关系与定量下限 精密称取组胺标准品,以BN大鼠阴性对照组血清配制浓度分别为10、50、100、250、500 μg·L-1,按2.1.5.2方法处理后以2.1.5.1检测条件检测,以组胺的浓度(X,μg·L-1)对其峰面积Y进行线性回归分析,得组胺的标准曲线方程为Y=2 980.73X-23 452.46,r=0.997 7,表明组胺的浓度在10 ~500 μg·L-1范围内与其峰面积呈良好的线性关系,定量下限为10 μg·L-1(S/N>10)。

Tab 4 IgE levels in serum after attacking in each group of animals n=6)
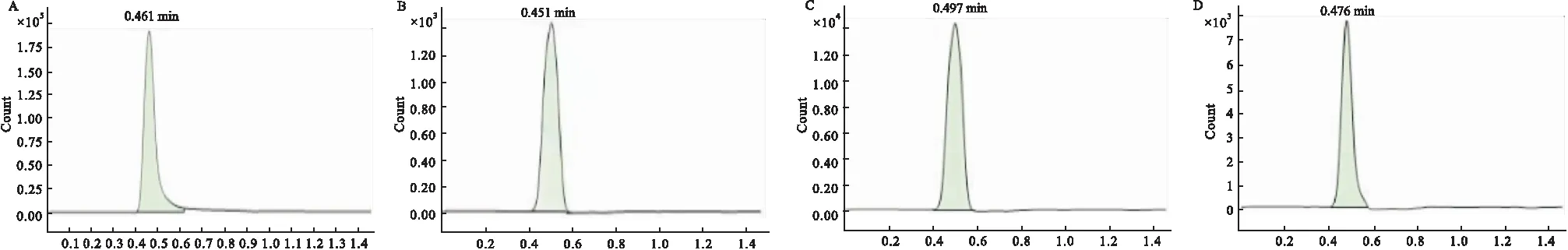
Fig 1 Typical chromatogram of histamine standard and serum sample

Fig 2 Mass spectrum of histamine in positive ion modeA: Characteristic ion pair; B: Relative abundance
3.2.2.4回收率、准确度、精密度及血清样本的稳定性考察 以标准曲线方程计算实测血清样本组胺的质量浓度,得到50、250、500 μg·L-13个加标水平的提取回收率在51.72%~64.33%范围内,方法的日内和日间的精密度的RSD值均小于6.4%,表明本方法符合生物样品的分析要求;将上述样本于-80 ℃冰箱冷冻3 d,常温解冻后,再次检测,冷冻前后色谱峰面积的RSD值分别为4.6%、3.7%、3.2%,表明-80 ℃的存放条件稳定性良好。
3.2.2.5BN大鼠和豚鼠血清组胺水平及增长率比较 经统计分析(见Fig 3),两次攻击后,BN大鼠的高、低剂量组均较阴性对照组的血清组胺水平差异具有显著性(P<0.01,P<0.05),而豚鼠仅高剂量组血清组胺水平较阴性对照组差异有显著性(P<0.05),进一步从血清学指标反映BN大鼠较豚鼠对茵栀黄注射液更敏感。

Fig 3 Serum histamine levels and growth rates n=6)
3.3 茵栀黄注射液对RBL-2H3细胞类过敏反应的影响
3.3.1CCK-8法对RBL-2H3细胞生长的影响 根据各孔所测吸光度,按公式[(Ac-As)/(Ac-Ab)]×100%计算细胞抑制率(%),以加药浓度为自变量X,细胞抑制率为因变量Y,拟合回归曲线,得茵栀黄注射液对RBL-2H3细胞的IC50为21.02 mL·L-1,见Fig 4。
3.3.2RBL-2H3细胞上清组胺释放量 根据各孔所测吸光度,以组胺浓度为横坐标X,OD值为纵坐标Y,绘制组胺的标准曲线,得到直线回归方程Y=0.221 9X-0.005 3,r=0.995 4,计算组胺释放量,经统计学分析,阳性对照组、药物处理组组胺含量与阴性对照组相比较差异均呈显著性(P<0.01),且药物处理组组胺释放量与加药浓度呈正相关趋势,见Fig 5。
3.3.3细胞Ca2+荧光强度测定 经统计学分析(见Fig 6~7),阳性对照组和各浓度药物处理组的细胞Ca2+荧光强度均与阴性对照组差异具有显著性(P<0.01);各浓度药物作用RBL-2H3细胞后Ca2+荧光强度的对数与加药浓度的对数呈正相关,同组胺释放量与加药浓度正相关的趋势相一致,考虑茵栀黄注射液致RBL-2H3细胞脱颗粒的过程与细胞内Ca2+具有相关性,发生机制可能是依赖Ca2+的颗粒与质膜融合释放过程。

Fig 4 Relationship between dosing concentration and inhibitory rate

Fig 5 Histamine release level in RBL-2H3 cell

Fig 6 RBL-2H3 cells Ca2+ fluorescence intensity n=5)

Fig 7 Relationship between Fluorescence intensity logarithm and dosing concentration logarithm
4 讨论
中药注射液用现行的过敏反应动物模型评价致敏性常为阴性,但临床上却仍有较多的过敏反应病例发生,本研究试图寻找更敏感的评价中药注射液过敏反应的动物模型和体外细胞模型,为临床安全用药提供临床前的数据支撑。
本研究进行的ASA试验,以茵栀黄注射液为致敏原,同等试验条件下BN大鼠反应相较于豚鼠更为敏感。在过敏反应症状分级时发现,BN大鼠过敏反应中出现了瘫软无力和静卧症状,这些症状在豚鼠症状评级中并未出现,豚鼠过敏反应出现的紫癜症状对BN大鼠而言因其毛色呈黑褐色而无法观察,因此,建立BN大鼠过敏模型时,需要进一步制定针对BN大鼠特征过敏反应症状的评价标准。
本试验条件下,两种动物模型的血清IgE水平存在明显的种间差异,但每次攻击给药组IgE水平较阴性组均未出现显著性差异,考虑茵栀黄注射液不需要免疫系统产生IgE即导致了过敏介质的释放,其过敏反应的机制可能与类过敏反应有关,正如易艳等[12-14]对舒血宁注射液、清开灵注射液、双黄连注射液等中药注射剂过敏反应的机制研究,认为这些中药注射剂引起的过敏反应属于类过敏反应。
血清组胺水平多作为判断致敏原诱发过敏反应的直接依据,本研究建立了LC/MS检测血清组胺的方法,该法灵敏度高、检出限低,既能定性又能定量。该法检测的血清组胺结果较动物体征的过敏反应分级更灵敏,检测到BN大鼠的高、低剂量组和豚鼠的高剂量组血清组胺水平均较阴性组差异有显著性,而动物体征的过敏反应分级判断仅BN大鼠高剂量组较阴性组差异均有显著性。
用药物直接刺激RBL-2H3细胞进行类过敏研究发现,低于IC50的加药浓度能明显引起RBL-2H3细胞释放组胺,可以看出RBL-2H3细胞释放组胺等生物活性介质并非茵栀黄注射液对细胞的毒性导致而是生物学效应引发。目前研究的观点一致认为肥大细胞或嗜碱性细胞脱颗粒的过程主要分两个过程[15-16],(1)依赖钙离子的颗粒与质膜融合释放过程;(2)非依赖钙离子的颗粒迁移过程。茵栀黄注射液通过哪条途径引起RBL-2H3细胞脱颗粒未见报道,本研究采用FexStation3多功能酶标仪测定RBL-2H3细胞内Ca2+荧光强度,结果显示茵栀黄注射液作用RBL-2H3细胞后Ca2+荧光强度增加,细胞脱颗粒的发生机制可能是依赖钙离子的颗粒与质膜融合释放过程。
本研究的结果提示,从动物模型上,以BN大鼠替代豚鼠进行过敏反应检查,以组胺血清学指标检测能够更灵敏的反映动物的过敏反应;从实验动物保护的“3R”原则考虑,可选用RBL-2H3体外细胞模型替代动物试验,由于茵栀黄注射液致RBL-2H3细胞脱颗粒与Ca2+的相关性,可考虑直接进行监控Ca2+荧光信号作为检查中药注射剂过敏反应的检测手段,该方法更为简便、快捷,同时也省去动物和组胺试剂盒的检测成本,要使方法标准化,还有很多工作要做,有待进一步研究。