松脂醇二葡萄糖苷对青年大鼠骨代谢的影响
谢高倩,高玉海,魏 朋,何玥颖,柏 鑫 ,陈 卓,秦 昆,郭建魁,陈克明,牛廷献
(1. 联勤保障部队第九四〇医院基础医学实验室,2. 甘肃省干细胞与基因药物重点实验室,3. 联勤保障部队第九四〇医院科训科,甘肃 兰州 730050)
骨质疏松症(osteoporosis,OP)是一种随年龄增长而发病率逐渐增加的疾病,人口老龄化现象将导致世界人口中OP和脆性骨折的比例逐年增加[1]。骨形成和骨吸收之间的平衡对于保持骨骼健康至关重要[2],骨吸收量高于骨形成量的骨代谢失衡是导致OP的重要原因之一,因此,抑制骨吸收是预防和治疗OP的重要手段。例如双膦酸盐是目前公认疗效较为理想的抗骨吸收一线药物[3],但其缺点是对消化道有刺激损伤作用,而且长期使用存在导致下颌骨坏死的风险[4]。近年来的研究表明,提高峰值骨量(peak bone mass,PBM)可以降低晚年发生OP及脆性骨折的风险,通过增加峰值骨量来预防OP是一种有效且可靠的策略[5]。所谓PBM是指人或脊椎动物一生所能达到的最高骨量,主要由遗传因素决定,但也可能受到营养和生活方式等因素的影响[6]。本课题组最先报道淫羊藿苷可提高大鼠峰值骨量,是淫羊藿苷可能用作抗骨质疏松药物的重要机制之一[7]。杜仲又称“思仲”、“木棉”、“思仙”,味甘,性温,归肝、肾经,具有补肝肾、强筋骨、安胎之效,是我国传统中草药[8]。已有研究表明,杜仲提取物能有效改善实验大鼠的骨代谢,起到抗骨质疏松的作用[9-11],但发挥作用的有效成分至今尚无定论。松脂醇二葡萄糖苷(pinoresinol diglucoside,PDG)是杜仲皮中的一种木脂素类物质,也是杜仲药材的质量控制指标。吴思敏等[12]曾报道,PDG能体外促进大鼠颅骨成骨细胞的增殖与分化,但有关PDG的抗骨质疏松体内实验鲜有报道。
本文报道PDG对青年大鼠骨代谢的影响,以提供PDG是否为杜仲主要抗骨质疏松有效成分的实验依据,为开发源自杜仲的抗骨质疏松新药奠定基础。
1 材料与方法
1.1 材料
1.1.1实验动物 选取体质量在100 g左右的1月龄SPF级SD雌性大鼠30只,许可证编号:SYXK(军)2017-0047,伦理审核编号:2021KYLL112,饲养于联勤保障部队第九四〇医院SPF级动物实验中心。饲养温度为(25±2)℃,湿度60%~70%,自由摄水与进食,所有实验操作均严格按照“3R”原则进行,尽可能减少对实验动物的伤害。
1.1.2主要试剂与仪器 PDG购于成都仪睿生物科技有限公司(产品批号:YRS003-210301);4%多聚甲醛中性组织固定液购于武汉塞维尔生物科技有限公司;四环素购于日本TCI公司,钙黄绿素购于德国Sigma公司;OPG、RANKL定量检测试剂盒购于泉州睿信生物科技有限公司;一抗:Runx-2和RANKL购于英国Abcam公司,OPG购于美国Santa Cruz公司,BMP-2、Osterix和β-actin购于美国Affinity公司;二抗:Goat Anti-Rabbit IgG H&L (HRP)购于英国Abcam公司;Micro CT购于平生医疗科技(昆山)有限公司(型号:NMC-100);双能X线骨密度仪购于美国GE公司(型号:Prodigy);荧光显微镜购于日本奥林巴斯公司(型号:BX51+DP71);硬组织切片机购于德国LEICA公司(型号:锯式Leioa sp1600);电泳仪和电转膜仪购于美国Bio-Rad公司。
1.2 方法
1.2.1动物分组与给药 将实验大鼠采用随机数字表法分为3组,每组10只,分别为Control组、PDG-25组和PDG-50组。低剂量给药组(PDG-25)灌胃25 mg·kg-1PDG,高剂量给药组(PDG-50)灌胃50 mg·kg-1PDG,对照组(Control)灌胃等体积蒸馏水。每周周一到周六上午灌胃,周日不灌胃。持续灌胃6周后,取材并开展各项指标检测。
1.2.2组织病理学检测 大鼠处死后,取出心、肝、脾、肺、肾及子宫,剥离周围的脂肪组织并迅速固定于4%多聚甲醛固定液中。将各器官固定2周后取出,进行包埋、切片与HE染色,在显微镜下观察各器官有无明显病理学改变。
1.2.3离体骨密度检测 处死大鼠后剥离得到椎骨和右侧股骨,整齐且方向统一的摆放于双能X线骨密度仪上检测离体骨密度。
1.2.4Micro CT分析 从每组新鲜剥离的左侧股骨中随机取5根固定在4%的多聚甲醛中。Micro CT扫描条件:电压70 kV,电流200 μA,分辨率为中度。用Cruiser软件扫描获得原始图像并得到纵截面最大剖面图,选择骨骺线下1.5~3.5 mm区域通过Avatar系统重建,得到骨小梁立体图以及松质骨的骨形态参数。
1.2.5血清骨代谢生化指标检测 腹腔注射水合氯醛麻醉大鼠后,采用腹主动脉采血法抽取血样,4 000 r·min-1离心15 min,取上清,-80 ℃保存。采用ELISA检测450 nm处的OD值,按照试剂盒说明说绘制标准曲线并计算出大鼠骨保护素OPG和RANKL的含量,结果表示为ng·L-1。
1.2.6双荧光标记与不脱钙切片制作 大鼠处死前13、14 d皮下注射四环素,剂量为30 mg·kg-1;处死前3、4 d皮下注射钙黄绿色,剂量为5 mg·kg-1;处死取材时分离出左侧胫骨保存于70%的酒精中,脱水处理后进行不脱钙塑料包埋。包埋完成后使其固定于切片机上,切片厚度为7~10 μm,经1 500~2 000目的砂纸打磨后,在显微镜下观察双荧光标记的结果。
1.2.7Western blot检测 从左侧股骨中随机取5根并剔除周围肌肉等组织,剪碎后放于组织匀浆仪中研磨,研磨完成后加入高效组织蛋白裂解液,取上清用BCA蛋白浓度测定试剂盒测蛋白浓度,以最低浓度进行稀释并加入蛋白上样缓冲液,98 ℃变性15 min待恢复室温后,-80 ℃保存。取蛋白样品,配制10%SDS-PAGE分离胶分离蛋白,110 V电转90 min至PVDF膜上,放于5%脱脂奶粉中封闭2 h,分别置于装有一抗的自封袋中4 ℃孵育过夜,TBST缓冲液洗膜后,二抗孵育1.5 h,清洗后曝光检测蛋白信号。
2 结果
2.1 给药安全性分析自实验开始的第1周至第6周,给药组大鼠和对照组大鼠的进食量和饮水量无明显差别,体质量差异无显著性(P<0.05),且均精神状态良好。各组大鼠主要脏器的组织病理学观察均未发现明显病变(Fig 1)。这些结果提示,本实验所采用的两种剂量的PDG对青年大鼠无明显毒副作用。
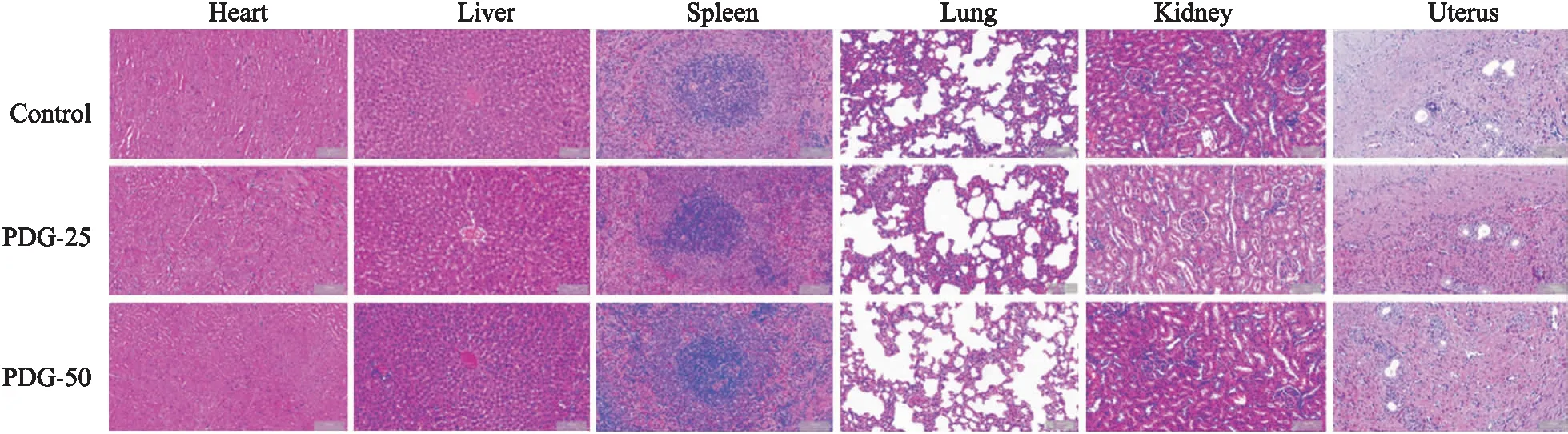
Fig 1 Histopathological examination results of main organs of rats in each group (HE,scale bar=100 μm)
2.2 离体骨密度检测灌胃6周后处死所有大鼠检测离体骨密度。如Fig 2所示,PDG-25组的股骨骨密度和椎骨骨密度均明显高于Control组(P<0.05),PDG-50组明显高于Control组(P<0.01)。PDG-50组虽高于PDG-25组,但两组间差异无统计学意义。以上结果说明,PDG能明显提高青年大鼠骨密度。
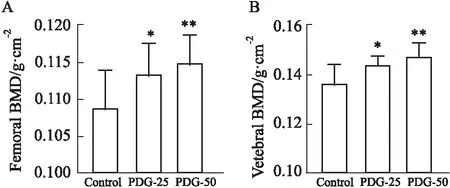
Fig 2 Results of bone mineral density in different of rats in each *P<0.05,**P<0.01 vs control
2.3 股骨Micro CT成像分析股骨Micro CT分析得到的最大剖面图显示,PDG-25组和PDG-50组松质骨骨小梁数量明显增多(Fig 3)。重建得到的3D效果图可以看出,PDG-25组和PDG-50组骨小梁更加密集且骨小梁间距更小(Fig 4)。如Fig 5所示,PDG-50组骨体积分数(BS/TV)和骨小梁数(Tb.N)明显高于Control组(P<0.01)、骨小梁厚度(Tb.Th)明显高于Control组(P<0.05),且骨小梁分离度(Tb.Sp)极明显低于Control组(P<0.01)。结果提示PDG可促进青年大鼠骨形成从而增强骨微结构。
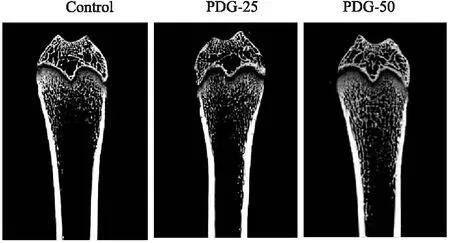
Fig 3 Maximum profile of micro CT imaging analysis of femur in each group
2.4 血清骨代谢生化指标结果如Fig 6所示,PDG-25组血清OPG含量显著高于Control组(P<0.05),PDG-50组OPG含量明显高于Control组(P<0.01);PDG-50组RANKL含量显著低于Control组(P<0.01)。说明PDG促进青年大鼠骨形成的同时也能抑制骨吸收作用。

Fig 4 3D reconstruction map of Micro CT imaging analysis of femur in each group

Fig 5 Quantitative analysis of Micro CT indexes of femoral cancellous bone in each *P<0.05,**P<0.01 vs control
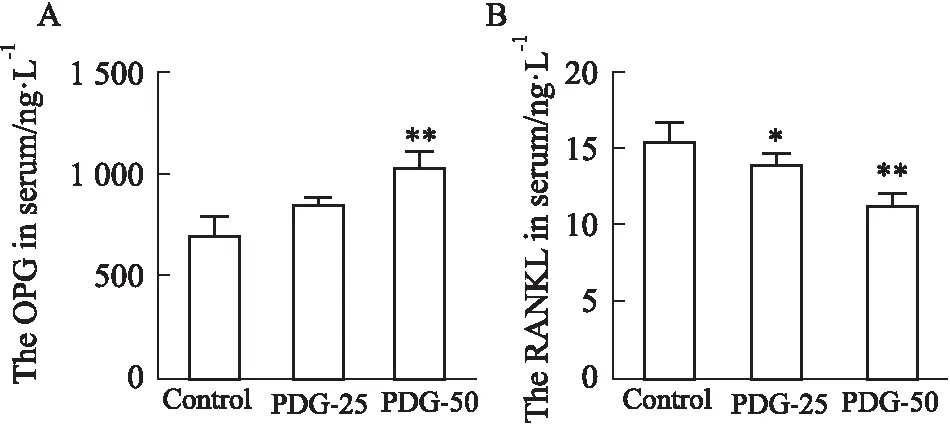
Fig 6 Content of OPG and RANKL in serum *P<0.05,**P<0.01 vs control
2.5 胫骨双荧光标记结果如Fig 7、8所示,黄色为四环素标记,绿色为钙黄绿素标记,双荧光间的间距代表10 d内骨的生长。PDG-25组和PDG-50组四环素和钙黄绿素之间的标记均明显大于Control组,且PDG-50组的间距大于PDG-25组。说明在相同时间内,给药组的骨形成作用有明显提高。
2.6 骨形成与骨吸收相关蛋白表达情况如Fig 9所示,PDG-25组和PDG-50组BMP2、Runx-2、OSX和OPG的蛋白表达量均明显高于Control组,RANKL的蛋白表达量明显低于Control组,此结果与血清骨代谢指标检测结果相一致。提示PDG可能通过上调BMP2、Runx-2、OSX和OPG的表达,下调RANKL的表达,来提高青年大鼠的骨形成。
3 讨论
OP常常在第一次骨折发生之前没有症状,被认为是一种无声的慢性疾病,其特征是骨微结构破坏和骨骼强度降低[12]。在全球范围内,OP每年导致890万起骨折,平均每3 s就会发生一次骨质疏松性骨折。骨质疏松症及其相关并发症也是老年人发病和死亡的常见原因[13]。因此,向所有健康的青少年、成年人提供预防OP的措施迫在眉睫。PBM被定义为生命中最高的骨密度值[14]。有研究显示,青春期PBM的增加可以降低晚年OP和骨折的发生率[15]。因此,OP的预防可以从提高PBM的角度展开研究。
杜仲是我国的传统中药材,其主要化学成分有木脂素类、黄酮类、环烯醚萜类、酚酸类、萜类、甾体类和多糖类等,其中木脂素类大多是以PDG为代表的苷类化合物[16]。传统观点认为,木脂素是一种植物雌激素,具有类雌激素作用,在促进骨形成的同时又避免了雌激素可能带来的各种不良反应[17]。本实验首次研究了PDG对青年大鼠骨代谢的影响,结果提示PDG可能通过促进骨形成与抑制骨吸收来提高青年大鼠骨质量与骨强度。
本次实验结果显示,25 mg·kg-1、50 mg·kg-1的PDG都能提高生长期大鼠离体股骨骨密度和离体椎骨骨密度,且高剂量给药组比低剂量给药组的作用效果更好,提示PDG提高青年大鼠离体骨密度可能具有剂量依赖性;Micro CT成像分析直观反映了骨微结构,骨微结构的好坏与骨质量的高低密切相关。Micro CT量化结果显示,25 mg·kg-1、50 mg·kg-1的PDG均能增加骨体积分数、骨小梁数量以及骨小梁厚度,并减小骨小梁间距,且高剂量组的效果更为明显,最大剖面图和3D重建图也反映了与之一致的趋势;血清骨代谢生化指标直接反映了骨转换率,血清骨形成指标OPG和骨吸收指标RANKL作为重要的骨转换标志物,反映了体内骨形成和骨吸收的状态。血清检测显示,50 mg·kg-1的PDG具有促骨形成和抗骨吸收的双重作用,25 mg·kg-1促骨形成作用明显但抗骨吸收作用并不明显;胫骨双荧光标记中双荧光间的距离能从动态的角度反映骨微结构的变化,结果显示25 mg·kg-1、50 mg·kg-1的PDG能明显增加大青年大鼠胫骨中段双荧光间的距离,且高剂量给药组双荧光间的间距大于低剂量给药组。说明给药组的骨矿盐沉积增长速度相比于对照组而言有所提高,且高剂量给药组的骨矿盐沉积增长速度高于低剂量给药组,提示了PDG对青年大鼠的骨形成有促进作用;BMP-2/Runx-2/OSX信号途径与骨形成密切相关,参与调控成骨细胞的分化,OPG/RANKL信号途径也是骨代谢过程中重要的信号途径之一。Western blot检测结果提示,25 mg·kg-1、50 mg·kg-1均能上调BMP-2、Runx-2、OSX与OPG的表达量,降低RANKL的表达量,这与血清的检测结果一致。骨形成相关蛋白表达量的增加与骨吸收相关蛋白表达量的降低提示,PDG可能通过刺激骨形成与抑制骨吸收来调节骨代谢,提高青年大鼠骨质量。

Fig 7 Double fluorescent labeling of cortical bone in middle tibia fluorescent markers in each group (200×)

Fig 8 Comparison of distance between double fluorescent markers**P<0.01 vs control
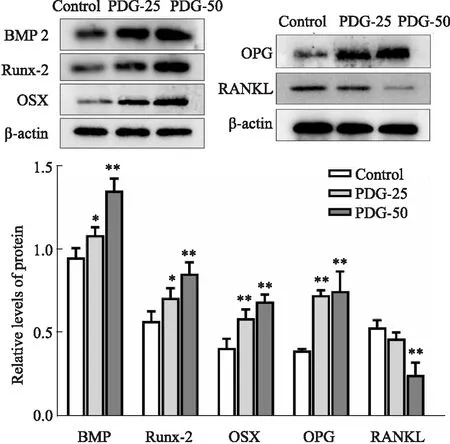
Fig 9 The protein levels of BMP2,Runx-2,OSX,OPG and RANKL in each group*P<0.05,**P<0.01 vs control
综上所述,本实验结果初步显示,PDG可明显提高青年大鼠的骨密度,因而有可能通过提高峰值骨量而预防大鼠骨质疏松,且其作用机制可能与影响骨形成和骨吸收有关。这些结果表明,PDG很可能是杜仲抗骨质疏松的有效成分,应具有开发为抗骨质疏松药物的潜力。但此种作用与其他已报道能提高峰值骨密度的天然产物或药物相比有何优势?PDG对于由切除卵巢引起的绝经后骨质疏松有无预防或治疗作用?其作用机制如何?与其他药物相比有何优势?本课题组接下来将对这些问题予以研究。