小麦赤霉病病情指数与毒素积累量关系探究及全基因组关联分析
陈 璨, 余宁静, 单新宇, 卢 杰, 张海萍, 司红起, 马传喜
(安徽农业大学农学院/农业部黄淮南部小麦生物学与遗传育种重点实验室,安徽合肥 230036)
小麦赤霉病(Fusariumhead blight,简称FHB)在我国乃至世界各地普遍发生,是温暖湿润和半湿润麦区的重要病害之一。在大流行年份,赤霉病病穗率为50%~100%,产量损失超过80%,甚至绝收[1]。赤霉病主要是由禾谷镰刀菌(Fusariumgraminearum)侵染引起的真菌性病害,镰刀菌侵染小麦后,不仅严重影响了小麦的品质和产量,其产生的各种真菌毒素,雪腐镰刀菌烯醇(nivalenol,简称NIV)和脱氧雪腐镰刀菌烯醇(deoxynivalenol,简称DON)等难以降解,会使小麦籽粒及其加工制品受到污染,进入食物链对人畜健康造成危害。Schroeder等首次将小麦赤霉病抗性分为抗侵染(TypeⅠ)和抗扩展(TypeⅡ)2类[2];Mesterhazy等在此基础上提出了3种新抗性类型,分别为抗毒素积累(TypeⅢ)、籽粒抗感染性(Type Ⅳ)和耐病性(TypeⅤ)[3]。TypeⅠ型体现小麦抵抗病原菌初侵染的能力,一般采用自然发病或孢子弥雾接种条件下的病穗率或病情指数(disease index,简称DI)表示;Type Ⅱ型指小麦抵御病原菌沿穗轴扩展的能力,一般在小麦扬花期采用人工单花滴注接种下的病小穗率为指标;Type Ⅲ型抗性指小麦抑制毒素积累或降解真菌毒素的能力,一般用籽粒中毒素积累量进行评估;Type Ⅳ型可以用感病籽粒的比例进行衡量;Type Ⅴ型利用在一定发病程度下的小麦产量损失进行评价[4]。
全基因组关联分析(genome wide association study,简称GWAS)是以连锁不平衡(linkage disequilibrium,简称LD)为基础,以自然群体为研究对象,通过目标性状与分子标记之间的关联关系,从而得到关联位点的分析方法,现已广泛应用于小麦、玉米、水稻等多种农作物当中[5]。国内外研究者们对小麦赤霉病抗性展开了大量研究,目前已定位400多个数量性状基因座(quantitative trait locus,简称QTL),分布在小麦的21条染色体上[6]。已发现的小麦赤霉病抗病基因有Fhb1~Fhb7[7],其中位于3BS染色体上的Fhb1最早在我国小麦品种苏麦3号中被发现,其在各种环境和遗传背景下都较稳定,现已在育种工作中得到广泛应用。Arruda等对273份美国冬小麦品种进行GWAS分析,在4A、6A、7A、1D、4D、7D染色体上发现了与赤霉病抗性显著关联的单核苷酸多态性(single nucleotide polymorphism,简称SNP)以及多个与Fhb1关联的标记[8]。Wang等通过对PNW和CIMMYT地区的170份春小麦材料进行赤霉病综合评价,鉴定出一些与苏麦3号有相似抗性的优质品系,在1B、2B、4B、5A、5B、6A 染色体上关联到了显著SNP位点,其中位于5BS上的QTL可能是一个新的抗DON积累位点[9]。朱展望通过全基因组关联分析,在自然群体中发现5个较为稳定的抗赤霉病位点,可解释5.0%~10.3%的表型变异率,在扬麦16/中麦895群体中检测到7个稳定的位点,并开发连锁标记[10]。
5种抗性类型遗传和作用机制各不相同,它们协同作用可提高小麦对赤霉病的整体抗性[11],研究抗性类型间的关系利于更好地利用小麦的遗传抗性。绝大多小麦抗赤霉病遗传研究集中在抗扩展(TypeⅡ)类型,然而应用最为广泛的抗赤霉病扩展基因Fhb1不能降低籽粒的抗毒素累积能力[12]。小麦抗性机制复杂,我国抗赤霉病育种实践多采用病情指数或病小穗率作为抗性鉴定指标,但后期感染或品种的主动解毒机制会导致DI与毒素累积量低相关甚至无相关性。由于检测技术和成本等原因,很多育种家们在研究小麦赤霉病抗性时并没有测量籽粒中真菌毒素的含量,然而随着赤霉病毒素污染问题的日益严重,我们应该加强对此类问题的重视。本研究通过对91份小麦品种(系)构建的自然群体进行田间病情指数调查,并对籽粒中DON、NIV含量进行测定,探究小麦赤霉病抗侵染和抗毒素积累之间的关系;并结合90K SNP芯片,利用全基因组关联分析获得与小麦赤霉病病情指数和毒素积累量显著关联的位点,发掘相关候选基因,以期为小麦赤霉病分子标记辅助选择提供信息。
1 材料与方法
1.1 供试材料
供试小麦品种(系)共91份,包含66份黄淮南片冬小麦区品种、13份长江中下游品种、7份西南麦区品种、1份北方麦区品种以及4份国外品种。分别于2019—2020年、2020—2021年种植于安徽省合肥市郭河安徽农业大学皖中试验站小麦赤霉病自然发病鉴定区。
1.2 小麦赤霉病田间病情指数调查
种植材料的乳熟中后期,从每份小麦品种中随机选取50穗,对91份小麦赤霉病的发病情况进行调查并统计数据结果。病情指数计算公式如下:

病情分级标准采用国家标准GB/T 15796—2011《小麦赤霉病测报技术规范》[13]。0级:无病穗;1级:感病小穗占全部小穗25%以下;2级:感病小穗占全部小穗25%~50%;3级:感病小穗占全部小穗50%~75%;4级:感病小穗占全部小穗75%以上。
1.3 超高效液相色谱(UPLC)法测定小麦真菌毒素
1.3.1 标准溶液的配制及样品前处理 分别取 1 mg DON标准品、1 mg NIV标准品,用甲醇溶液溶解成100 μg/mL标准液。再分别取等量100 μg/mL 标准液混合成50 μg/mL 混合标准液置于-20 ℃冰箱备用。选用流动相水 ∶乙腈(体积比50 ∶50)稀释 50 μg/mL 混合标准液10.00、8.00、5.00、2.00、1.00、0.50 μg/mL的混合工作液,经0.22 μm有机滤膜过滤后得到标准曲线溶液。
将待测的小麦籽粒样品磨碎混匀,称取25.0 g样品置于250 mL锥形瓶中,加入100 mL乙腈 ∶水(体积比84 ∶16)混合溶剂,35 ℃超声萃取 30 min,静置后用定量滤纸进行过滤,随之吸取8 mL滤液于试管中,并加入80 μL乙酸,经Mycosep#226多功能净化柱净化,吸取4 mL流出液,于 55 ℃氮吹至干。在底物中加入1 mL流动相(水 ∶乙腈体积比 50 ∶50)溶解,超声后过0.22 μm有机滤膜待上机检测。
1.3.2 色谱条件 选取的色谱条件如下:色谱柱:C18柱,2.1 mm×100 mm,1.8 μm;检测波长:λ=240 nm;机器检测流动相为A相超纯水(含0.1%乙酸)、B相乙腈;柱温:35 ℃;进样量:2 μL;流速:0.2 mL/min;梯度洗脱程序见表1。DON、NIV含量用安捷伦高效液相色谱自带工作站分析,根据保留时间定性,用峰面积外标法定量,最终结果取重复测量3次后的平均值。
1.4 表型数据统计、群体结构与关联分析
表型数据采用SPSS 24.0及Excel 2019进行相关统计分析,用R语言计算3种性状的广义遗传力(h2),计算公式为h2=σg2/(σg2+σe2)[14],其中:σg2表示遗传方差,σe2表示环境方差。利用90K SNP芯片对91份小麦品种进行基因型分型,去除缺失率>15%,最小等位基因频率<5%的SNP标记。
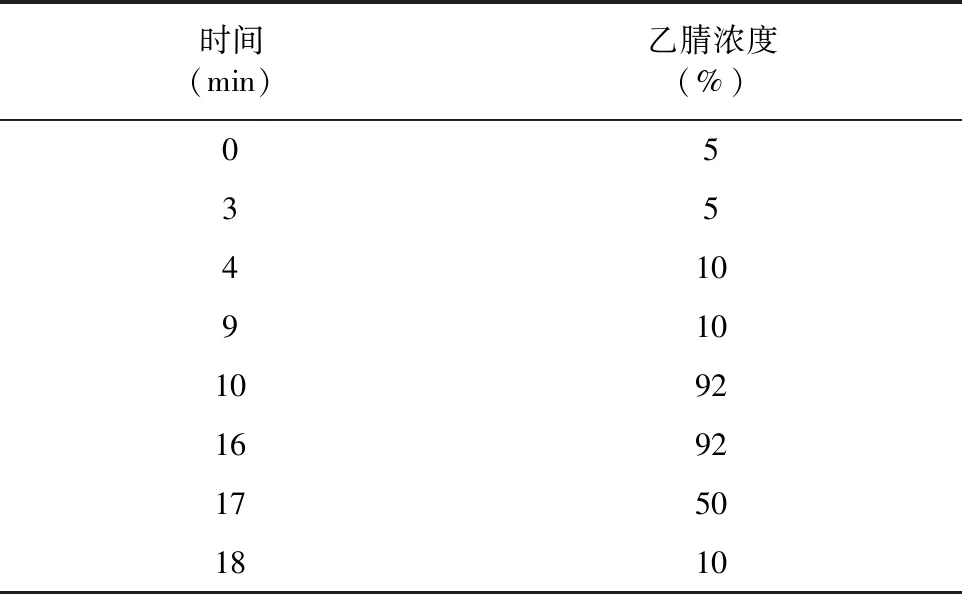
表1 梯度洗脱程序
用 Structure 2.3.4 软件对91份小麦材料进行群体结构分析,设置模拟迭代循环次数为50 000,运行迭代参数为100 000,群体参数K为1~11,每个K独立运行6次,选取最大ΔK对应的K值作为最佳亚群数量。
用Tassel 5.0软件中的混合线性模型(mixed linear model,简称MLM),以群体结构分析后的Q值和亲缘关系K值作为协变量,结合相关的表型数据和SNP位点的基因型数据进行关联分析,在一定程度上控制遗传背景的影响,避免产生假阳性。当标记的-lgP>3,即P<0.001时认为性状与标记存在显著关联。
2 结果与分析
2.1 表型数据分析
由91份小麦品种(系)的表型数据统计分析结果(图1、表2)可知,病情指数变幅为2.0~90.5,DON含量范围为34.0~2 997.7 μg/kg,NIV含量范围为 48.0~1 293.5 μg/kg,变异系数范围为23.07%~69.31%,说明该自然群体的性状变异范围广,选择潜力较大,赤霉病抗性在不同小麦品种中差异显著。广义遗传力结果表明,3个性状的遗传力均大于60%,表明赤霉病抗性受遗传变异的影响较大,环境对其影响较小。
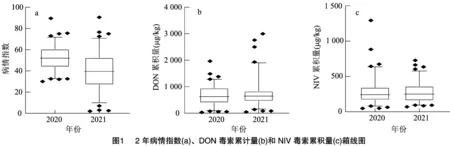
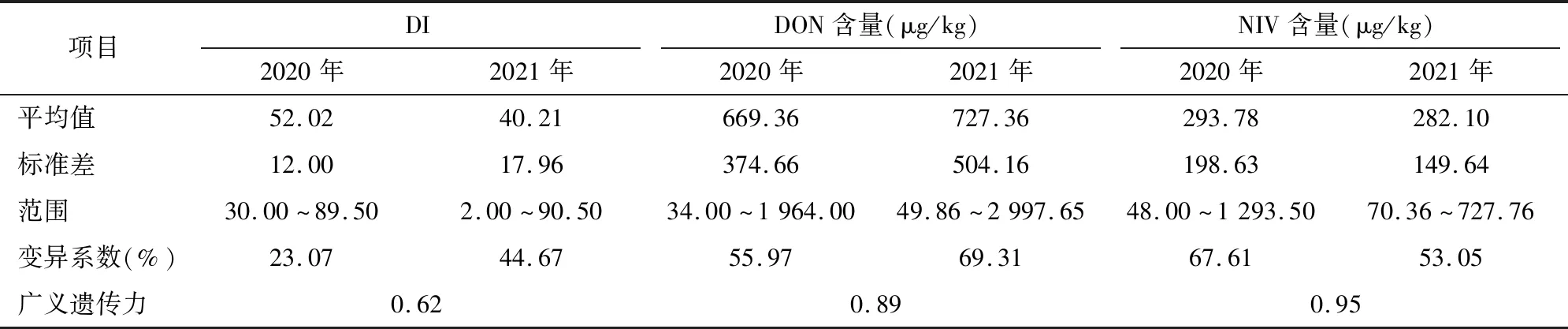
表2 表型数据基本统计信息
2.2 不同抗性指标的相关性分析
病情指数和籽粒中DON、NIV含量分别作为品种籽粒抗侵染和抗毒素积累的指标。通过对2年内小麦病情指数和DON、NIV含量的相关性分析(图2)可知,在毒素积累量上,NIV含量与DON含量呈显著正相关。在毒素含量和病情指数的关系中,2020年的DON含量与病情指数没有显著的相关性,2021年的DON含量与病情指数呈显著正相关。2年的NIV含量与病情指数均呈显著正相关。在病情指数相同的情况下,毒素含量可能不同,病情指数高的品种,毒素含量却不一定高,如Glenlen、皖52、川麦42等。毒素含量高的品种,病情指数可能不高,如荔高6号、皖麦38等。综上表明,赤霉病病情指数与毒素含量之间存在一定的相关性,具有各自的遗传特征。

2.3 标记分布与群体结构分析
分型质控后的21 968个SNP标记分布在小麦的21条染色体上。标记在A、B、D基因组间分布不均匀,其中B基因组的标记数最多,占总标记数的44.10%,D基因组的标记数最少,占总标记数的16.85%。物理图谱总长度为14 043.9 Mb,标记密度为0.639 Mb/marker。群体结构分析结果使用Structure Harvest在线工具进行计算,当K=2时,运行结果最接近真实值,即这91份种质材料可大致被分为2个亚群,群体结构较为简单。
2.4 全基因组关联分析
将91份供试小麦材料的病情指数、DON含量和NIV含量与21 968个SNP标记进行全基因组关联分析(图3),在P<0.001时,认为该位置的标记与性状存在显著关联。GWAS结果共检测到128个显著SNP标记,分布在除1D、4D外的19条染色体上。其中,检测到与病情指数显著关联的标记有30个,可解释11.32%~18.90%的表型变异。与DON积累量显著关联的标记共56个,可解释11.89%~22.29%的表型变异。与NIV显著关联的标记有42个,表型变异贡献率为13.03%~34.11%。将在物理图谱上前后3 Mb区间内的标记认为1个候选位点,在2个及以上环境中关联到的稳定位点有11个(表3),其中仅与毒素稳定关联的位点有6个,分别在1A、4A、6A、6B、6D染色体上,可解释11.96%~30.50%的表型变异。与毒素和病情指数都稳定关联的位点有4个,分别位于2A、2B、4B、5D染色体上,可解释12.21%~34.11%的表型变异。
2.5 候选基因预测
参考中国春小麦品种的基因组信息,对稳定的位点对应区段内基因进行分析,结合相关生物信息挖掘候选基因。通过对应的区段基因注释,筛选得到15个与小麦赤霉病抗性相关的候选基因(表4)。其中TraesCS2A01G633200LC和TraesCS6D01G380900编码谷胱甘肽S-转移酶T3(glutathioneS-transferase T3),TraesCS2A01G474700等3个基因编码糖基转移酶(glycosyltransferase),TraesCS2A01G476500等5个基因编码病程相关蛋白(pathogenesis-related protein 1,简称PR1),TraesCS2B01G040000编码 12-氧代植物二烯酸还原酶(12-oxophytodienoate reductase-like protein),TraesCS6D01G383000编码葡聚糖内切-1,3-β-葡萄糖苷酶(glucan endo-1,3-beta-glucosidase),TraesCS6D01G383700编码受体激酶蛋白(receptor-like kinase,简称RLK)。


表3 稳定关联的位点信息
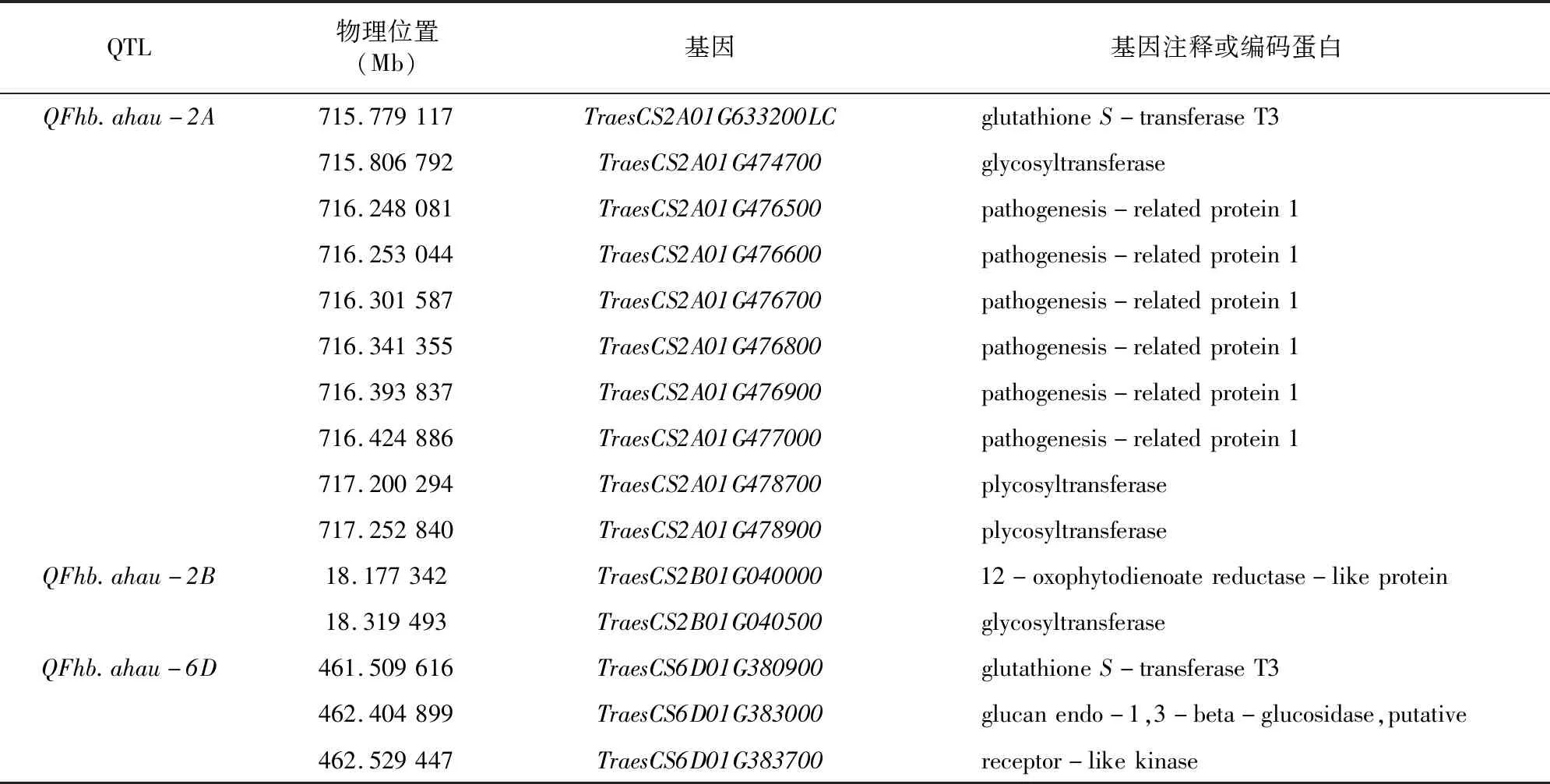
表4 筛选获得的与小麦赤霉病抗性相关的候选基因信息
3 讨论与结论
近年来,受秸秆还田、轮作制度和极端天气影响,赤霉病对我国小麦主产区的威胁逐渐北移。小麦赤霉病的发生不仅影响其产量和品质,一旦毒素累积量超标丧失商品价值等于绝收,严重威胁人民生命健康和国家粮食安全。抗毒素积累在很多欧美国家的小麦赤霉病育种中越发受到重视,在加拿大用于评估赤霉病抗性品种的公式中,DON含量已经占据了最高的权重[15],然而在我国还没有引起足够的重视。小麦的病情指数与籽粒毒素累积量分别是抗扩展(TypeⅡ)和抗毒素累积(Type Ⅲ)抗性的评价指标,本研究结果表明二者存在一定的相关性,但又有各自的遗传特征。徐飞等的研究表明,不同小麦品种的平均病害严重度与籽粒中毒素含量存在极显著正相关[16]。陈怀谷等研究认为,病小穗率和毒素含量具有一定的相关性,但在不同年度间表现不同,也初步证明二者可能不是由同种基因所控制的[17]。巩性涛等发现,小麦中赤霉病粒含量和DON含量不存在完全对应的线性关系,不能以赤霉病粒含量的多少来预测籽粒中DON含量[18]。在我国的西北地区气候干燥,赤霉病很少发生,但2018年的一项调查表明,在这些地区82.9%的小麦样品被DON污染,平均浓度为0.5 mg/kg,10%的样品DON含量高于我国规定的限量值[19]。有些小麦的毒素含量高可能是存在晚期感染的可能性,有研究表明,晚期感染通常不会引起明显的赤霉病症状,但会导致DON的高积累量[20]。
小麦的基因组较为庞大,以往关联分析多采用简单重复序列(SSR)标记,随着高通量测序技术的发展,SNP标记的分布更广且定位精度较好,逐渐成为QTL定位的主流。本研究将亲缘关系纳入到混合线性模型中,采用MLM+Q+K相结合的方法,即使群体的数量不大,也可以表现出较好的关联能力,增加了关联结果的准确性。小麦赤霉病抗性由主效基因和微效基因共同控制,是极为复杂的数量性状。本研究在2年间定位到的位点不完全一致,可能存在环境条件的影响,一些抗性基因在特定的情况下能够表达,同时还会受到关联群体大小、分子标记密度等多种因素影响。本研究中,关于病情指数共检测到30个显著相关的SNP位点,其中2D染色体上的QFhb.ahau-2D在2年被重复检测到,且表型贡献率达16.82%~17.47%;关于DON累积量的显著关联位点56个,其中QFhb.ahau-1A-2、QFhb.ahau-4A、QFhb.ahau-6A和QFhb.ahau-6B位点在2年中均被检测到。Semagn等在染色体1AL、1BL、6BS和7AL上发现了与赤霉病抗性相关的QTL,同时还可以减少DON的含量,其中1AL上的标记位置与本研究的QFhb.ahau-1A-1位置较为接近[21]。Fhb.ahau-2A在3个性状中都能关联到,与郑彤整理的高置信度一致性数量性状位点(meta quantitative trait loci,简称MQTL)区间hcMQTL-12属同一位置[22],且该位点也与TypeⅡ和TypeⅢ抗性关联。He等在3BL和3DL染色体上发现了2个对减少DON含量有显著作用的QTL[15],前者对TypeⅡ和Type Ⅳ型抗性影响较小,后者则没有影响;虽然全球范围内关于赤霉病抗性QTL的研究较多,但由于试验材料和研究方法的不同,共同定位的标记较少且不稳定,因此挖掘和鉴定QTL在目前的条件下仍然是必要的。
本研究根据中国春参考基因组注释信息,预测了稳定关联位点区段内的候选基因。其中TraesCS2A01G633200LC和TraesCS6D01G380900编码谷胱甘肽S-转移酶T3,它在生物体的防御机制中具有解毒的功效[23]。Fhb7编码的蛋白能使DON的环氧基团打开,并催化其形成谷胱甘肽加合物(DON-GSH),从而产生解毒效应[24-25]。编码糖基转移酶的TraesCS2A01G474700等3个基因可能在毒素解毒和赤霉病抗性中发挥关键作用[26]。Li等研究发现,在大麦中表达的UDP-葡萄糖基转移酶HvUGT13248当在转基因小麦中表达时,可以使DON、NIV解毒且明显提高了NIV的抗性,提出可以将该基因作为抗赤霉病的候选基因[27]。TraesCS2B01G040000编码的12-氧代植物二烯酸还原酶可能参与信号分子氧化脂质的合成与代谢。植物氧化脂质中的茉莉酸对禾谷镰刀菌的生长有抑制作用,其启动相应的防卫反应,从而提高小麦赤霉病抗性[28]。TraesCS6D01G383700编码受体激酶蛋白,在识别病原体相关分子模式和调节植物入侵真菌的免疫反应(包括谷物对真菌疾病的防御)中发挥重要作用,据报道可以响应DON以及抗赤霉病扩展[29]。TraesCS2A01G476500等基因编码病程相关蛋白PR1,AtNPR1在易感病小麦中表达时,调节系统获得抗性的激活,可以提高小麦抗赤霉病扩展能力[30]。TraesCS6D01G383000编码的葡聚糖内切-1,3-β-葡萄糖苷酶在温室和大田条件下均能增强小麦对赤霉病的抗性并减少DON积累量[31]。防卫素以及其他一些富含半胱氨酸的蛋白可以与磷脂质和鞘脂互相作用,破坏真菌的细胞膜[32],阻止病原菌入侵。

