水通道蛋白MRI 在前列腺癌风险评估中的价值及其与水通道蛋白1 的相关性研究
刘昀松,陈丽华,张钦和,王楠,武志刚,孙鹏,王家正,刘爱连,3
(1.大连医科大学附属第一医院放射科,辽宁 大连 116011;2.飞利浦医疗,北京 100016;3.大连市医学影像人工智能工程技术研究中心,辽宁 大连 116011)
前列腺癌(Prostate cancer,PCa)是男性第二大常见的恶性肿瘤[1],其死亡率占男性泌尿生殖系统肿瘤性疾病的97%以上[2]。近年来,我国PCa 的发病率呈逐年上升的趋势[3]。Gleason 评分是预测PCa 进展和预后的重要指标之一,对治疗方式的选择起决定性作用[4]。根据2014 年国际泌尿病理学会指南,将PCa 分为高风险组(Gleason 评分≥4+3=7)和低风险组(Gleason 评分≤3+4=7)[5]。本研究拟采用基于多个超高b 值的水通道蛋白(AQP)MRI 序列对PCa 的风险进行评估,并探讨其与水通道蛋白1(AQP1)的相关性。
1 资料与方法
1.1 研究对象
本研究获得医院伦理委员会批准(批件号:PJKS-XJS-2021-20)。回顾性收集我院行3.0T MRI 检查的可疑PCa 患者,依据Gleason 评分分为低风险组(Gleason 评分≤3+4=7)和高风险组(Gleason 评分≥4+3=7)。纳入标准:①术后病理证实为PCa 者;②术前4 周内行前列腺MRI 检查者。排除标准:①MRI 检查前接受过前列腺手术、穿刺活检或其他治疗者;②MRI 图像质量不佳(信噪比低)或伪影重,影响观察者;③切片免疫组化染色不满意者。最后入组:PCa 患者43例,年龄为56~87岁,平均(71.07±7.20)岁。其中高风险组26例,年龄61~87岁,平均(72.62±6.63)岁;低风险组17例,年龄56~79岁,平均(68.71±7.58)岁。出入组流程见图1。记录临床资料,详见表1。
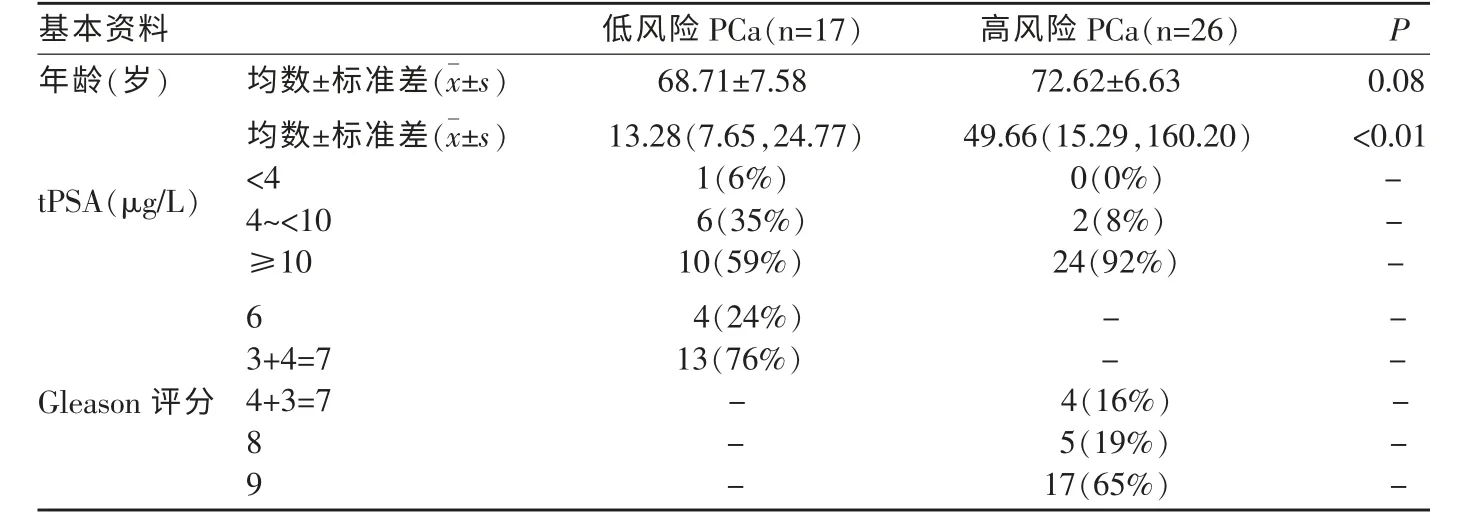
表1 基本临床资料
1.2 MRI 扫描
使用3.0T MR(Signa HDxt,GE Medical Systems,USA)扫描仪,采用16 通道腹部线圈。检查前禁食禁水4 h。MRI 序列包括:常规轴位T1WI、T2WI、DWI(b=0、1 000 s/mm2)及超高b 值DWI(b=2 000 s/mm2、3 000 s/mm2、4 000 s/mm2)序列(AQP MRI),具体扫描参数见表2。
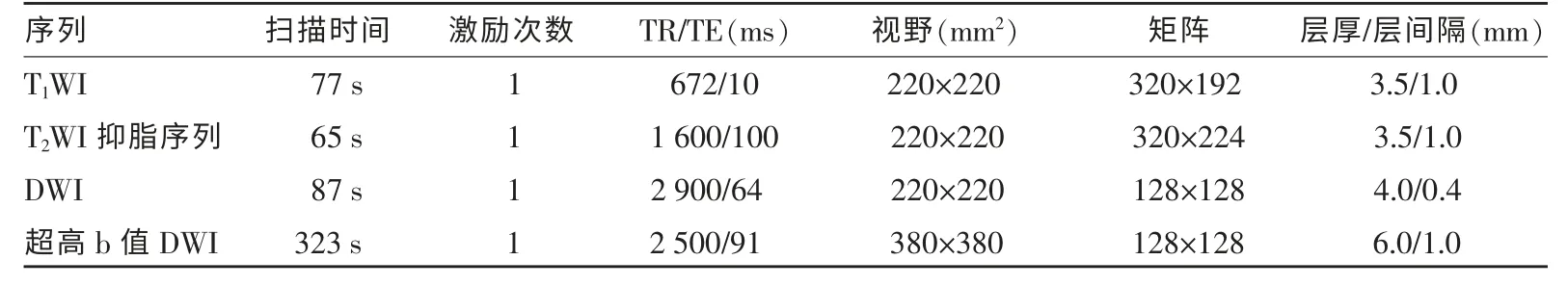
表2 各序列扫描参数
1.3 AQP 检测
1 名有1 年免疫组化实验经验的研究生采用AQP1 抗体等试剂,对纳入的PCa 组织的石蜡切片(由1 名具有10 年病理蜡块切片经验的病理科医师制成4 μm 切片)进行AQP1 检测。
1.4 图像处理
扫描后图像导入Philips ISP V10 工作站,通过后处理将DWI(0、1 000 s/mm2)生成ADC 图、超高b值DWI(2 000 s/mm2、3 000 s/mm2、4 000 s/mm2)图像拟合得到AQP-ADC 图。DWI 及超高b 值DWI 成像公式分别为[6]:S/S0=exp(-b×ADC),b=0、1 000 s/mm2;S/S0=exp(-b×ADC),b≥2 000 s/mm2。
由2 名观察者(分别具有6 年及2 年前列腺MRI 阅片经验)独立进行测量。参照T2WI 及DWI 图像确定病灶的最大层面,在DWI、超高b 值DWI 图像上沿病灶边缘勾画感兴趣区(Region of interest,ROI),同时避开出血、坏死、囊变区,使ROI 面积覆盖病灶实性区域,ROI 自动匹配于同一层面的ADC图及AQP-ADC 图上,得到平均ADC 值、AQP-ADC值(图2)。
显微镜下观察PCa 组织的AQP1 染色情况,放大倍数选择200 倍镜(图3)。随后运用ImageJ 图像分析软件,计算PCa 组织的AQP1-平均光密度(AOD)值(积分光密度值与视野下阳性部分面积的比值)。
1.5 统计学分析
采用SPSS 25.0 软件、MedCalc 软件和Graph-Pad Prism 8 软件进行统计学分析。采用组内相关系数(Intra-class correlation coefficients,ICC)评价两名观察者间测量数据的一致性,ICC<0.40 为一致性差,0.40~<0.75 为一致性中等,≥0.75 为一致性好。一致性好,取两名观察者测量值的平均值进行后续统计学分析。服从正态分布的数据以均数±标准差()表示,否则用中位数(四分位数间距)(M(P25,P75))进行表示,方差为标准差的平方(s2),反映数据的稳定性。采用独立样本t 检验或非参数Mann-Whitney U 检验对两组间数据的差异性进行分析;并计算方差评估数据与其平均值的离散程度。采用线性回归分析分别计算回归系数β(即相关系数r)及决定系数R2,用于评估ADC 值、AQP-ADC 值与AQP1-AOD 值之间的相关性及模型拟合程度,0~<0.2为相关性极弱,0.2~<0.4 为相关性弱,0.4~<0.6 为相关性中等,0.6~<0.8 为相关性强,0.8~1.0 为相关性极强。采用Cocor 分析比较相关性间的差异性[7]。采用多因素Logistic 回归分析探讨总前列腺特异性抗原(Total prostate specific antigen,tPSA)、AQP-ADC 和ADC 对高风险PCa 的影响。另外,采用受试者工作特征(Receiver operator characteristic,ROC)曲线分析ADC 值、AQP-ADC 值及AQP1-AOD 值对PCa 风险性评估的效能。采用Delong 检验比较ROC 曲线下面积(Area under the curve,AUC)的差异。采用最大约登指数计算各参数评估高风险PCa 的阈值及特异度、敏感度;并采用配对卡方检验比较ADC 值、AQP-ADC 值的敏感度、特异度的差异性。P<0.05 为差异具有统计学意义。
2 结果
2.1 临床资料结果
高、低风险组年龄间差异无统计学意义(P=0.08)。高风险组tPSA 显著高于低风险组,差异有统计学意义(P<0.01)(表1)。
2.2 不同风险组PCa 的AQP1-AOD 值比较
高风险组的AQP1-AOD 值((0.33±0.03)mm2/s)高于低风险组((0.29±0.02)mm2/s),差异具有统计学意义(P<0.01)(图4)。
2.3 两名观察者间数据测量的一致性
两名观察者对两组病灶的ADC 值、AQP-ADC值测量的一致性好(ICC>0.75,P<0.01)(表3)。
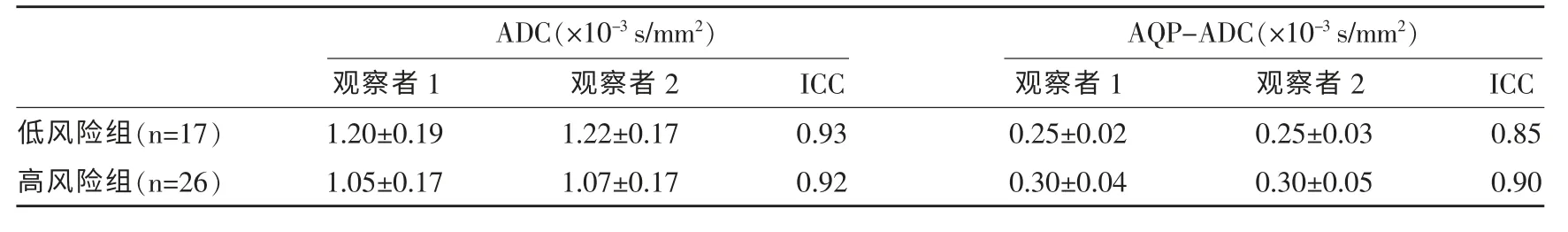
表3 两名观察者间测量数值的一致性检验
2.4 不同风险组PCa 的ADC 值、AQP-ADC 值比较
高风险组的AQP-ADC 值高于低风险组,ADC值低于低风险组,差异均有统计学意义(P<0.01),AQP-ADC 值的方差明显小于ADC 值的方差,AQPADC 值离散程度更小(表4 及图5)。

表4 两组ADC 值、AQP-ADC 值比较
2.5 ADC 值、AQP-ADC 值与AQP1-AOD 值的相关性分析
ADC 值、AQP-ADC 值与AQP1-AOD 值的相关系数分别为-0.34 和0.44(P 均<0.01),决定系数R2分别为0.11 和0.20(图6);ADC 值、AQP1-AOD 值间的相关系数与AQP-ADC 值、AQP1-AOD 值间的相关系数的差异无统计学意义(P=0.60),但AQPADC 值与AQP1-AOD 值的模型拟合度优于ADC 值与AQP1-AOD 值的模型拟合度。
2.6 多因素Logistic 回归分析
ADC 值、AQP-ADC 值是高风险PCa 的独立危险因素(P<0.05),tPSA 不是高风险PCa 独立危险因素(P=0.20)(表5)。
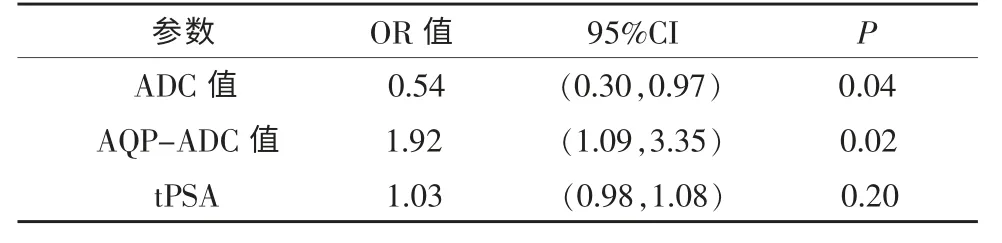
表5 多因素Logistic 回归分析高风险PCa 的影响因素
2.7 ADC 值、AQP-ADC 值及AQP1-AOD 值评估PCa风险性的效能分析
AQP-ADC 值的AUC 大于ADC 值的AUC,差异无统计学意义(P=0.29)。AQP-ADC 值在评估PCa高低风险组中的敏感度、特异度均高于ADC值,差异无统计学意义(均为P=1,χ2=0)(表6,图7)。
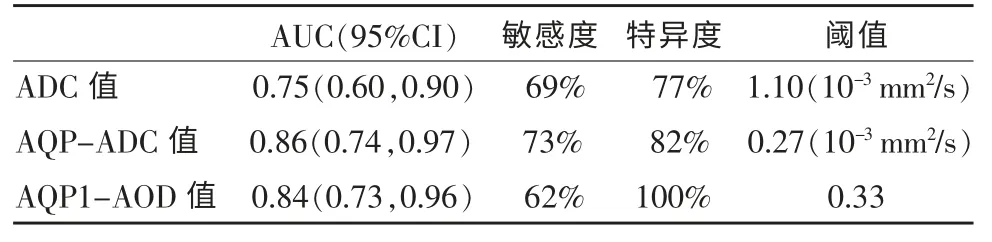
表6 ADC 值、AQP-ADC 值及AQP1-AOD 值评估高风险PCa 的诊断效能
3 讨论
PCa 的诊断主要依靠直肠超声(TRUS)引导下的前列腺穿刺活检,但其准确率仅为40%,漏诊的风险较高[8]。而活检是有创性的,且往往由于取材局限导致Gleason 评分不够准确[9-10]。MRI 具有较高的软组织分辨率,能够实现多方位、多序列成像,随着MRI 技术的发展,其在前列腺病变的诊断中发挥着越来越重要的作用。
在Gleason 评分为3+4=7 与4+3=7 的疾病中,具有小范围(<5%)和更大范围模式4 的癌症可能需要不同的治疗方式,而Gleason 评分=3+3=6 与Gleason 评分=3+4=7 的患者的预后相近,且明显优于Gleason 评分≥4+3=7 的患者[11],故本研究根据Gleason 评分将PCa 分为低风险组(Gleason 评分≤3+4=7)和高风险组(Gleason 评分≥4+3=7),并对其进行定量评估。
除此之外,年龄和tPSA 也可能与PCa 的风险性有关。王功伟等[12]研究发现,随着年龄的增加,Gleason 评分呈上升趋势;Billis等[13]则认为年龄与Gleason 评分间没有明确的相关性。血清tPSA 是临床上进行PCa 筛查时常用的化验指标。有研究[14-16]发现,PCa 患者的Gleason 评分与tPSA 值呈显著正相关。本研究中tPSA 在不同PCa 风险组的水平差异具有统计学意义,但并不是高风险PCa 的独立影响因素。
随着Gleason 评分的增大,前列腺的正常腺体破坏、水分减少,肿瘤细胞越密集,水分子扩散越受限,ADC 值降低[17],理论上可以据此来评估PCa 的Gleason 评分。Boesen等[18]研究显示ADC 对评估PCa的Gleason 评分具有一定的价值。但温茹等[19]研究显示不同Gleason 评分PCa 的ADC 值间存在着一定的重叠。传统DWI 序列在Gleason 评分中仍有一定的局限性。
Agre等[20]于1993 年发现了AQP,证明了水分子通过细胞膜主动转运的方式进出细胞。AQP 广泛存在于人体组织细胞中,参与水分子的跨膜转运。前列腺作为男性特有的性腺器官,有较为丰富的AQP分布。本研究通过免疫组化证明高风险PCa 组的AQP1-AOD 值高于低风险PCa组,说明高风险PCa组的AQP1 较低风险组过表达,盛华均等[21]在高、低级别星形细胞瘤的研究中得到了类似结果。因此,AQP1 可能成为评估PCa 高、低风险潜在的生物学标志物。寻找到一种无创、准确反映前列腺AQP1 表达水平的技术,对PCa 风险性的评估具有重要的临床意义。
郭启勇等[22]通过对富含AQP 的红细胞进行实验研究,验证了超高b 值(1 700 s/mm2、2 000 s/mm2、2 500 s/mm2、3 000 s/mm2、3 500 s/mm2、4 000 s/mm2、4 500 s/mm2)成像对于分子水平AQP 检测的可能性。该团队的研究结果显示,低b 值(0~200 s/mm2)下的ADC 值主要反映组织微循环的灌注,中b 值(300~1 500 s/mm2)下的ADC 值则主要反映的是组织细胞外间隙、细胞内水分子的扩散运动,高b 值(≥1 700 s/mm2)下的ADC 值很可能反映的是细胞AQP 分子的表达水平,也就是跨膜转运这一部分水分子的弥散水平。
本研究中,常规DWI 包含了b 值为0,主要反映了单指数模型下组织微循环灌注及传统意义的水分子弥散水平,而超高b 值DWI 序列则未包括b 值为0 及传统高b 值部分,剔除了微循环灌注及细胞内外水分子弥散的贡献。本文专门对超高b 值区间(b=2 000 s/mm2、3 000 s/mm2、4 000 s/mm2)模型即水分子跨膜转运进行研究。
AQP-ADC 值和AQP1-AOD 值间的相关系数与ADC 值和AQP1-AOD 值间的相关系数无差异,但AQP-ADC 值与AQP1-AOD 值的线性相关模型中决定系数R2值更大,显示两者的拟合度更好,说明AQP-ADC 更能反映AQP1 的表达。高风险PCa的AQP1 表达水平高,导致水分子跨膜转运效率高,而AQP-ADC 反映了水分子的跨膜转运能力[6],AQP-ADC 值也就更高,因此AQP1 与AQP-ADC 值之间呈正相关。高风险PCa 的AQP1 表达水平更高,跨膜转运的水分子增多,此部分水分子的跨膜转运传统DWI 序列不能检出,但由于更多跨膜到细胞外的水分子扩散受限减轻,导致ADC 值降低,故ADC值与AQP1 表达呈负相关。
本研究结果显示高风险组的AQP-ADC 值高于低风险组,ADC 值低于低风险组,两者评估PCa 风险性的效能无差异。但AQP-ADC 值较ADC 值的方差明显小,说明其数据的离散程度更小,能够对PCa风险性进行更稳定的评估。
本研究的局限性:①本文属于回顾性研究,样本量较小,未能应用最新的Gleason 5 级评分系统(Gleason 评分≤6、Gleason 评分=3+4=7、Gleason 评分=4+3=7、Gleason 评分=8 和Gleason 评分=9~10)[23]进行分组,有待扩大样本量后进行更加细致的研究;②目前的AQP MRI 仅能非特异性的反映AQP 的表达水平,不能针对特定的AQP 亚型进行成像。
综上所述,基于多个超高b 值的AQP MRI 能够较好地评估PCa 的风险性,AQP-ADC 值较ADC值能更好地反映AQP1 的表达,为PCa 的风险评估提供了一个新思路。

