欧洲花楸无性快繁体系的建立研究
沙 岩
(黑龙江省林口县林业和草原局,黑龙江 林口 157600)
欧洲花楸(SorbusaucupariaL.)原产亚洲和欧洲,为落叶乔木,树冠较窄呈圆锥形,枝条呈平直状,树皮浅灰色、光滑,羽状复叶。花白色,复伞房花序、浓密、多花;果实扁球形,颜色橙、红色,冬季宿存。欧洲花楸属于阳性或半耐荫树种,能适应不同立地条件。多散生或混生在一些林分之中,较少营造成片纯林,且树体高度有限、竞争力相对较小,混交株数比例随着树木年龄增加和树体增大而迅速减少,因此,不会出现无法控制的生物入侵现象。
1 材料选取
选取欧洲花楸US-05-01作为实验材料。
2 试验方法
2.1 培养条件
培养基采用常规的配制方法,按要求添加不同的激素。继代培养时,光源采用日光灯,光强为3000lx,光照10h/黑暗14h。培养温度为24~28℃。
2.2 外植体选择
1)选择欧洲花楸US-05-01的健壮休眠枝条,浸泡催芽,两天换一次清水,在20~25℃,7d左右开始萌芽;腋芽萌发后,分别选取叶片、带芽茎段做为供试材料进行外植体诱导;将供试外植体冲洗干净,用75%乙醇消毒30s,再用0.1%氯化汞间断灭菌4min。
2)外植体为带芽茎段。剪取长约0.5cm带芽茎段,接种于MS+6-BA1.5mg/L+NAA0.05mg/L +蔗糖25g/L+日产琼脂粉6g/L的培养基中,pH值调至5.8;外植体为叶片。选取2~5节叶片,在叶片远轴面中脉处横切两刀,切成0.5cm×0.5cm小块,把叶片远轴面接种到培养基上。
3)每种外植体接种10瓶,每瓶5个处理,30d后调查各供试外植体的诱导情况。
2.3 外植体灭菌
剪取欧洲花楸US-05-01一年生枝条,洗去浮土,剪成1.5~2.0cm带腋芽幼茎并冲洗干净。按以下几种方法灭菌:①75%乙醇灭菌20s;②75%乙醇灭菌30s;③75%乙醇灭菌40s;④75%乙醇灭菌30s+0.1%氯化汞连续灭菌2min;⑤75%乙醇灭菌30s+0.1%氯化汞连续灭菌4min;⑥75%乙醇灭菌30s+0.1%氯化汞间断灭菌4min;⑦饱和浓度次氯酸钠灭菌5min;⑧饱和浓度次氯酸钠灭菌10min;⑨饱和浓度次氯酸钠灭菌15min。每个处理10个茎段,2周后观察效果。
2.4 基本培养基的选择
灭菌后接种于以下4种基本培养基进行培养:①N6;②MS;③WPM;④H。与上述2.1相同,待培养20天调查其生长指标。
2.5 欧洲花楸诱导与增殖培养
欧洲花楸芽诱导培养基为:MS+6-BA1.5mg/L+NAA0.05mg/L,将外植体接种于此诱导培养基中培养,待茎段的腋芽萌发后转接到以MS为基本培养基,分别添加:①6-BA0.5mg/L+NAA0.1mg/L、②6-BA1.0mg/L+NAA0.1mg/L、③6-BA2.0mg/L+NAA0.1mg/L、④6-BA3.0mg/L+NAA0.1mg/L、⑤6-BA2.0mg/L+NAA0.05mg/L、⑥6-BA2.0mg/L+NAA0.2mg/L、⑦6-BA2.0mg/L+NAA0.4mg/L的培养基上进行继代增殖培养。每个处理接种10瓶,每瓶5个单芽茎段,3次重复,培养30d后调查增殖效果。
2.6 欧洲花楸生根培养
1)剪取高2.0cm左右的分化苗,分别按梯度(0.1、0.5、1.0、1.5、2.0)mg/L接种于MS+IAA;MS+NAA;MS+IBAmg/L;MS+NAA0.01mg/L+IBA;MS+NAA0.03mg/L+IBA;MS+NAA0.05mg/L+IBA;MS+NAA0.10mg/L+IBA的培养基中进行生根培养。
2)以上培养基均加蔗糖20g/L,琼脂5.5g/L,pH为5.8。每个处理接种10瓶,培养50d后调查生根状况。
2.7 欧洲花楸生根苗移栽
将约4cm的欧洲花楸生根苗置于温室,逐渐揭开瓶盖炼苗5-7d,洗去培养基,用0.1%多菌灵溶液浸泡10min,洗净后分别移栽到基质中。每种处理移栽生根苗100棵。移栽后每两周浇灌1/2倍大量元素培养液1次,喷杀菌剂1次。
2.8 数据统计方法
所得数据采用Excel软件和SPSS13.0分析软件,进行方差分析及多重比较分析。
3 结果与分析
3.1 最佳外植体的选择
在培养30d后,茎段的诱导率较高,褐化率相对较低;叶片的褐化率较高,茎段为欧洲花楸组培的最佳外植体(表1)。

表1 不同外植体对芽苗生长的影响Tab.1 Effects of Different Explants on the Growth of Buds and Seedlings
3.2 不同灭菌剂与方法的灭菌效果
经灭菌后发现,灭菌不彻底的茎段开始出现污染,污染率最高的处理方法是75%乙醇灭菌20s;处理4为75%乙醇灭菌30s+0.1%氯化汞灭菌2min方法污染率也很高;处理5污染率最低;处理6污染率较低,且没有褐变现象。说明茎段采用75%酒精灭菌30s,再用0.1%氯化汞间断灭菌4min的灭菌方法效果最好(表2-6)。
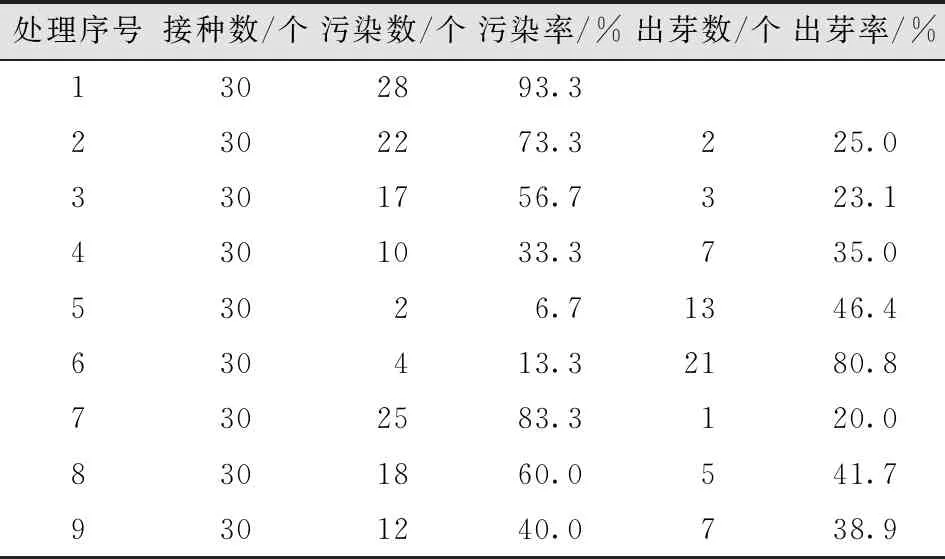
表2 不同灭菌剂与方法的灭菌效果Tab.2 Sterilization Effect of Different Sterilization Agents and Methods
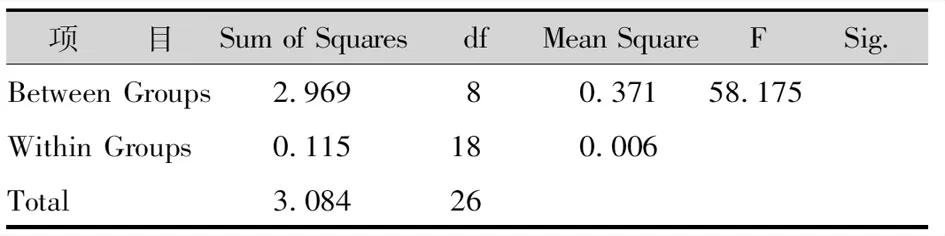
表3 不同灭菌剂与方法污染率方差分析Tab.3 Analysis of Variance of Contamination Rate of Different Disinfectants and Methods
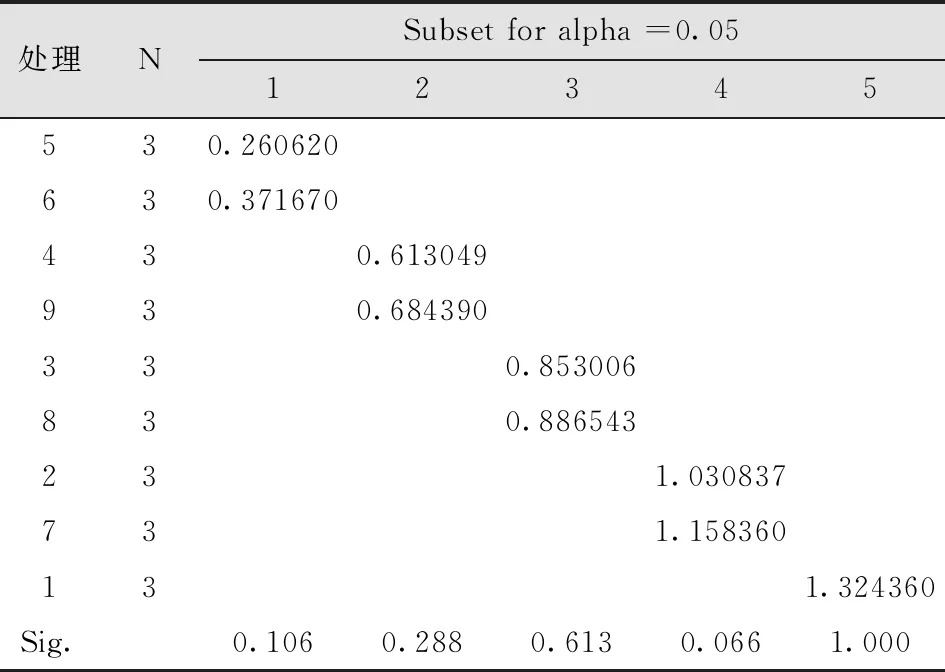
表4 不同灭菌剂与方法污染率多重比较Tab.4 Multiple Comparisons of Contamination Rates of Different Disinfectants and Methods Duncan
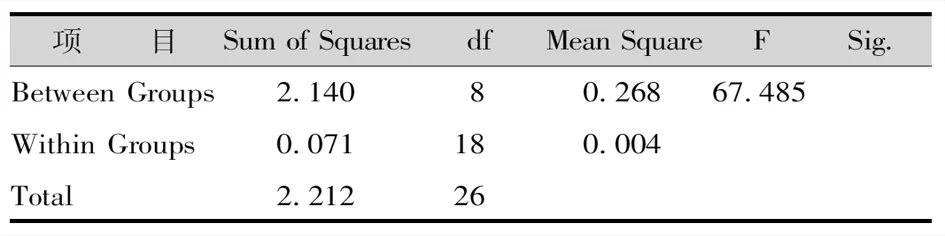
表5 不同灭菌剂与方法出芽率方差分析Tab.5 Variance Analysis of Buding Rate of Different Sterilizers and Methods
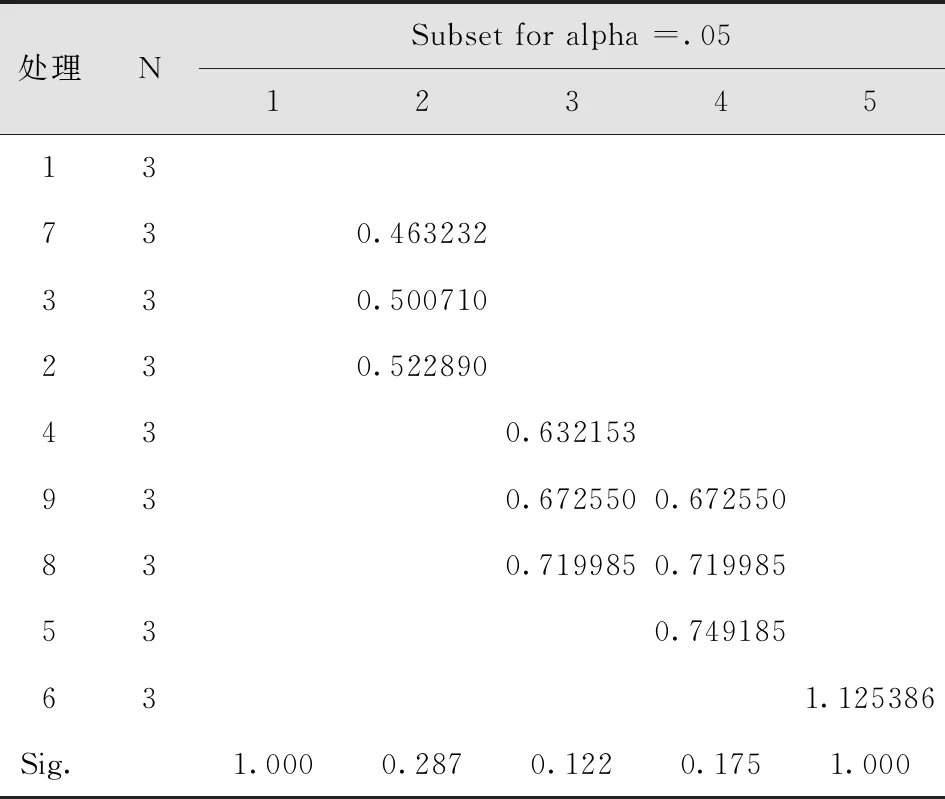
表6 不同灭菌剂与方法出芽率多重比较Tab.6 Multiple Comparison of Germination Rate of Different Disinfectants and Methods
3.3 基本培养基的筛选
将芽苗培养20d,表现各不相同(表7)。MS培养基生长较快,可观察到明显的茎尖伸长,生长状况最好;在N6培养基中植株生长较差;在WPM培养基上生长慢,叶片有黄化死亡现象;在H培养基中生长的植株生长最差。所以选用MS为基本培养基。
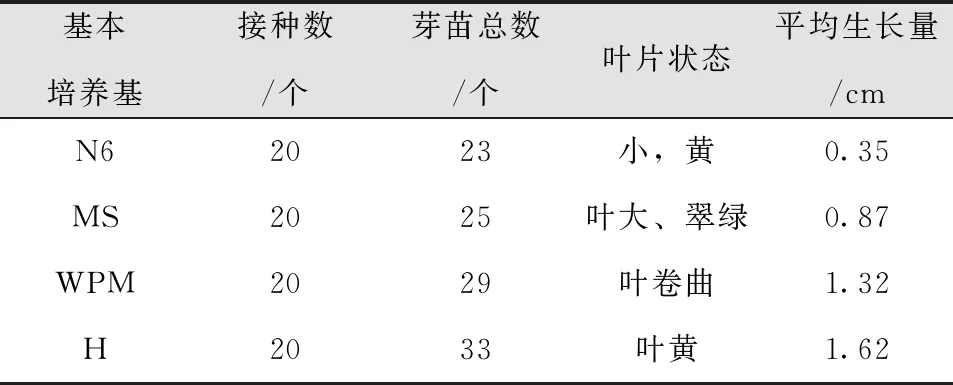
表7 不同种类基本培养基试管苗生长状况Tab.7 Growth of Plantlets in Vitro on Different Basic Media
3.4 增殖培养结果
经过30d增殖培养后,均有不同程度的增殖。组合2增殖效果最好,且苗木粗壮;组合3相对增殖率也较高,生长较旺盛。综合试验结果,最适增殖培养基应为处理2,可达到最佳培养效果(表8-10)。

表8 不同培养基的芽增殖倍数Tab.8 Bud Multiplication Times of Different Media
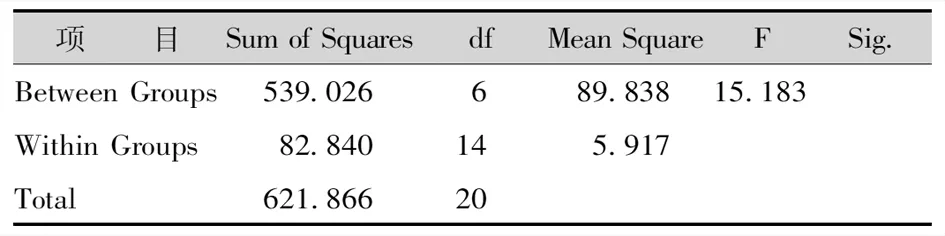
表9 不同培养基的芽增殖系数方差分析Tab.9 Variance Analysis of Bud Multiplication Coefficient in Different Media
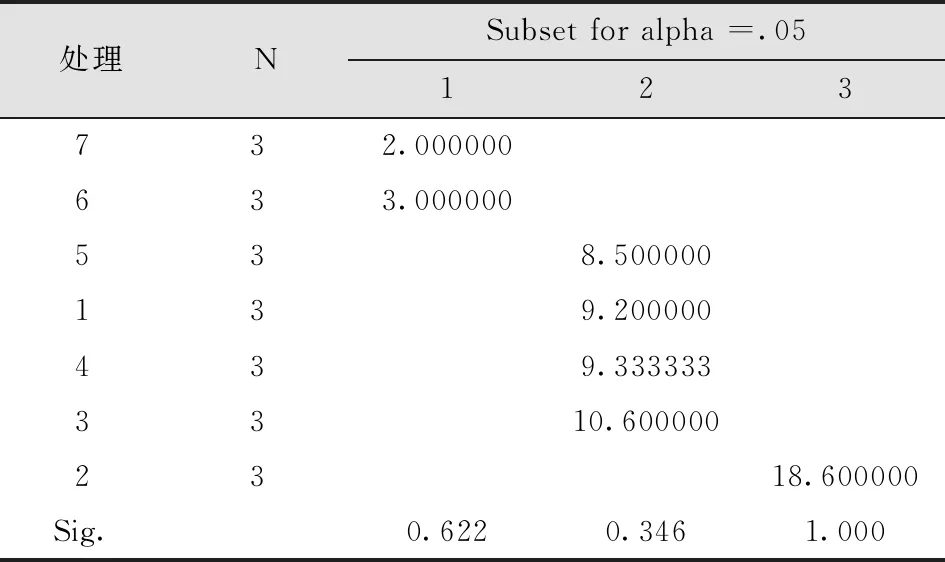
表10 不同培养基的芽增殖系数多重比较Tab.10 Multiple Comparison of Bud Multiplication Coefficients in Different Media Duncan
3.5 生根培养结果
试管苗经过生根培养,50d后调查其生根率。结果显示:单一添加生长素IBA时,生根率明显高于单一添加IAA、NAA的生根率,单一添加1.5mg/LIBA的生根率为单一激素最高;激素组合为NAA0.05mg/L+IBA1.5 mg/L的生根率最高。添加不同激素组合的生根率均明显高于添加单一激素的生根率。最适生根培养基为MS+IBA1.5mg/L+NAA0.05 mg/L(表11-12)。
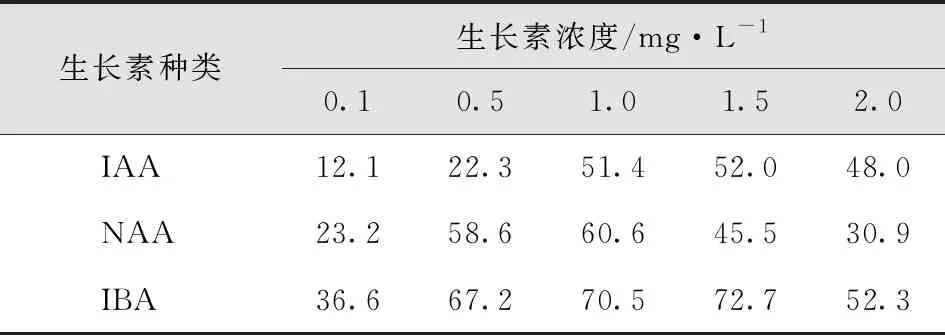
表11 单一激素不同浓度对欧洲花楸生根率影响Tab.11 Effect of Different Concentrations of Single Hormone on Rooting Rate of Sorbus Europaea
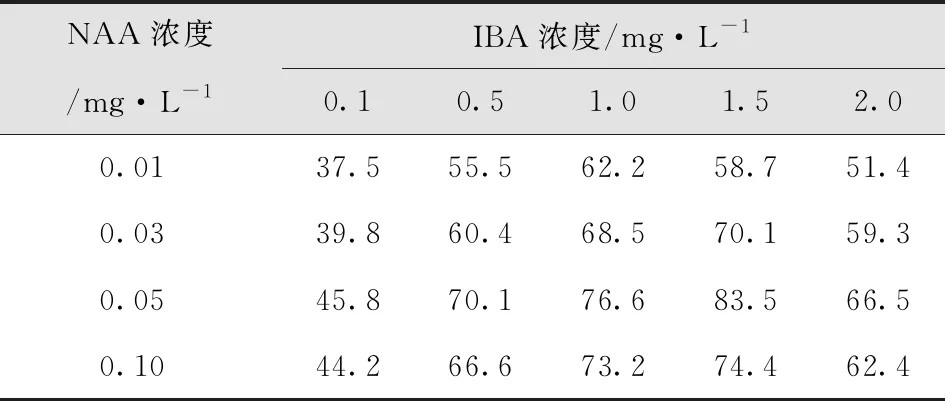
表12 不同激素组合对欧洲花楸生根率影响Tab.12 Effect of Different Hormone Combinations on Rooting Rate of Sorbus Europaea
3.6 生根苗移栽
3.6.1 试管苗生根培养天数对移栽成活率的影响
随机抽取生根培养少于30d、30-40d、多于40d的试管苗各50瓶(5株/瓶),相同培养基质、不同生根培养天数,移栽成活率相差较大。其中生根培养30-40d移栽效果最好(表13-14)。
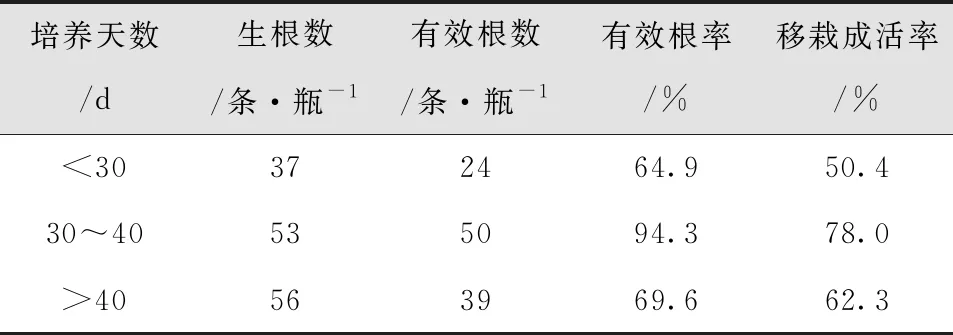
表13 不同生根培养天数试管苗移栽成活率比较结果Tab.13 Comparison of Survival Rate of Test Tube Plantlets Transplanted in Different Rooting Culture Days
表14 不同生根培养天数试管苗移栽成活率方差分析Tab.14 Variance Analysis of Survival Rate of Test Tube Plantlets Transplanted in Different Rooting Culture Days
3.6.2 不同配比基质对移栽成活率的影响
以珍珠岩+草炭土(1∶1)、腐殖土+珍珠岩+蛭石(1∶1∶1)、蛭石+草炭土(1∶1)作为移栽基质,移栽基质不同,移栽成活率相差很大。随机抽取生根培养30-40d试管苗为样本,结果得出腐殖土+珍珠岩+蛭石(1∶1∶1)配比基质中移栽苗的每瓶生根数、移栽成活率均高于其他基质配比,且移栽后苗木生长状况更好(表15-17)。
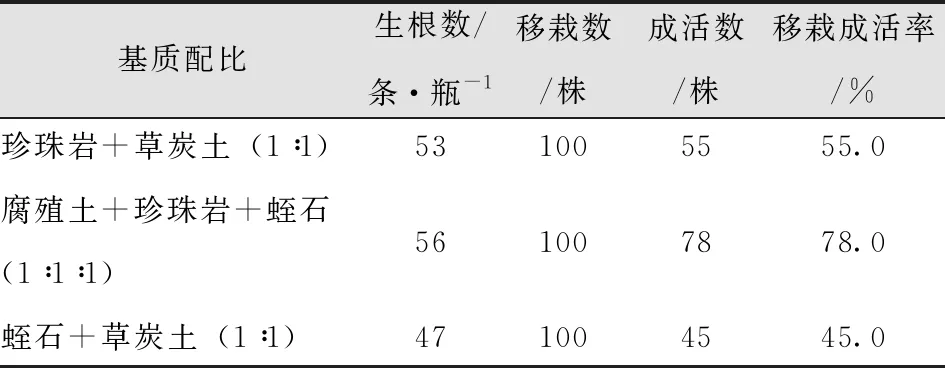
表15 不同基质试管苗移栽成活情况Tab.15 Transplantation Survival of Test Tube Plantlets from Different Substrates
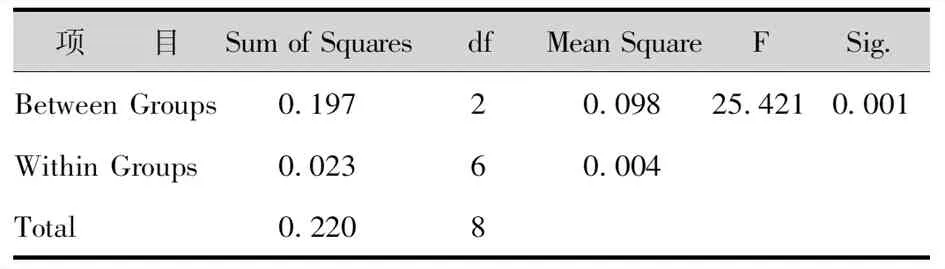
表16 不同基质试管苗移栽成活率方差分析Tab.16 Variance Analysis of Transplanting Survival Rate of Test tube Seedlings in Different Substrates
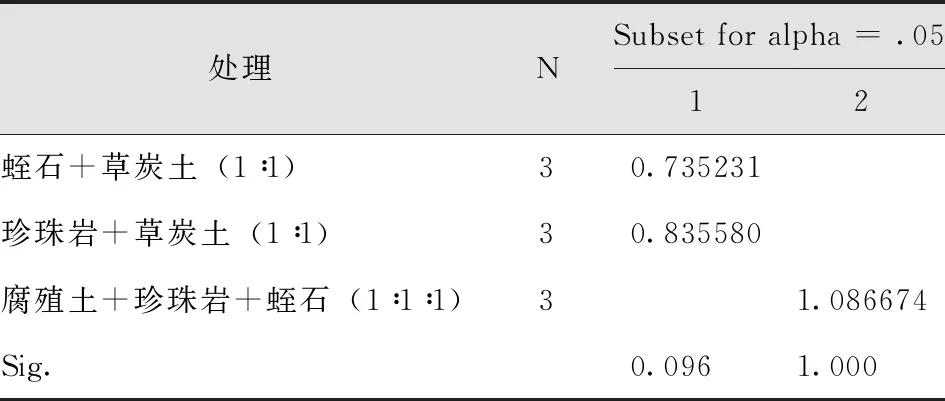
表17 不同基质试管苗移栽成活率多重比较Tab.17 Multiple Comparison of Survival Rate of Transplanting Test Tube Plantlets from Different Substrates Duncan
3.6.3 不同根系状况对移栽成活率的影响
试验观察发现,根系正常、根系污染、根少、仅有愈伤组织而无根4种根系状况的试管苗,移栽成活率相差较大。根系正常的试管苗,移栽成活率最高;根系污染但苗木长势良好的,通过多菌灵处理可以成活近50%以上;根系较少的,通过细致地培育管理,其成活率可能超过污染苗的成活率;而无根苗移栽成活率最低(表18-20)。
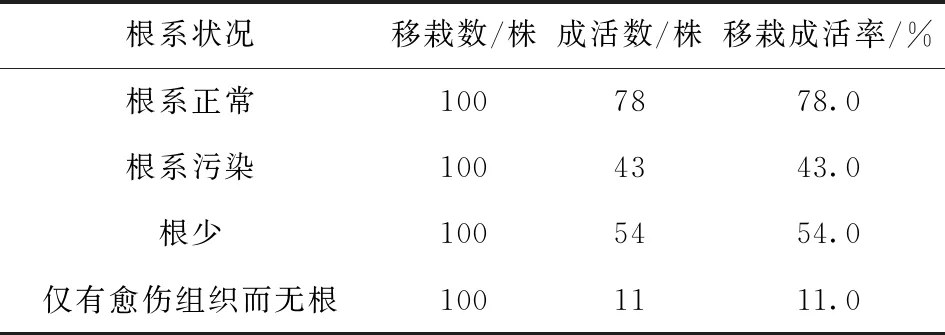
表18 不同根系状况试管苗移栽成活情况Tab.18 Transplantation Survival of Test Tube Seedlings under Different Root Conditions
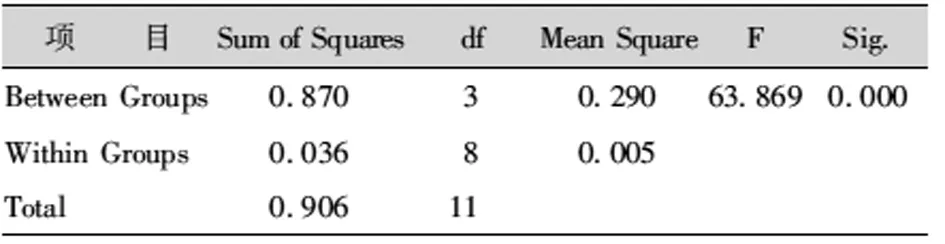
表19 不同根系状况试管苗移栽成活率方差分析Tab.19 Variance Analysis of Transplanting Survival Rate of Test Tube Seedlings under Different Root Conditions
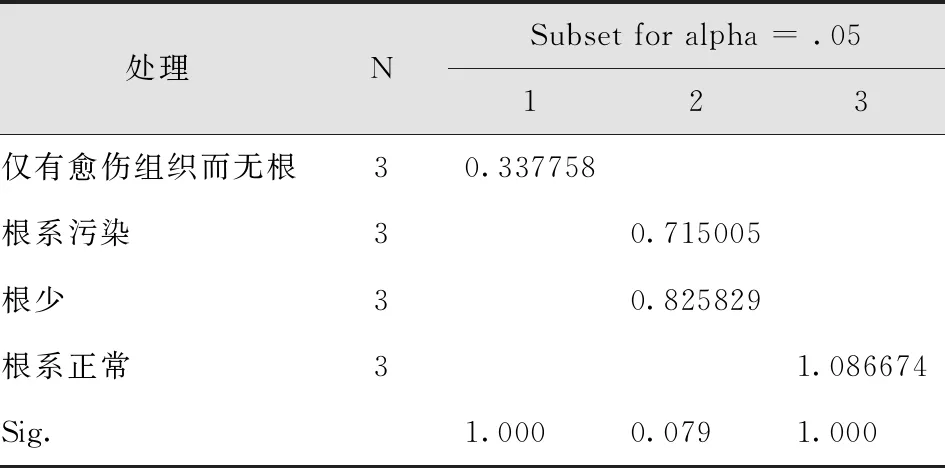
表20 不同根系状况试管苗移栽成活率多重比较Tab.20 Multiple Comparison of Survival Rate of Transplanting Test Tube Seedlings under Different Root Conditions Duncan
3.6.4 不同温度对移栽成活率的影响
试管苗其生长环境与自然条件相差较大。因此,温湿度和光照条件对移栽成活率的影响更明显。以腐殖土+珍珠岩+蛭石(1∶1∶1)为基质,生根培养30-40d且根系正常的试管苗在不同温度条件下的生长状况不同(表21)。
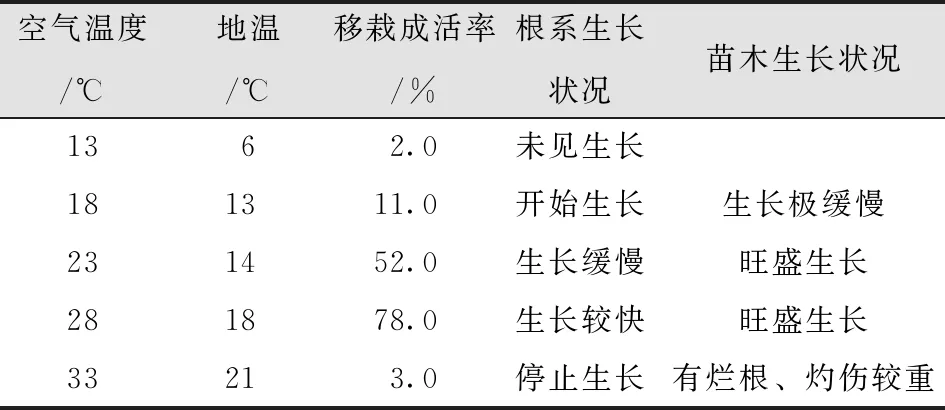
表21 不同温度条件下试管苗生长状况Tab.21 Growth of Plantlets in Vitro at Different Temperatures
3.6.5 移栽过程中温湿度及光照条件的控制
1)试验发现,通过控水、减肥、增光、降温等措施,可使其逐渐适应外界环境条件。移栽后,应给予较高的空气湿度在90%以上;温度控制在18~20℃;保证弱光照射。
2)小苗开始生长后温度最好在25~28℃,湿度则保持在75%左右。经过这些过程使试管苗逐渐适应自然条件,便可顺利完成移栽。
4 结论
1)带腋芽茎段为优良品系欧洲花楸US-05的最佳外植体,冲洗干净后,用75%酒精灭菌30s,再用0.1%氯化汞间断灭菌4min的灭菌方法效果最好。利用植物组织培养方法,以优良欧洲花楸品系的优良单株US-05-01的带芽茎段作为外植体,不仅可以节省供试材料,而且不受条件的限制,诱导率高、褐化率低,能在较短的时间内培育出大量的优质种苗。掌握外植体的灭菌时间是获得无菌芽苗的基础,采集时期、材料的幼嫩程度不同,对灭菌剂的耐受力也不尽相同。消毒时间太短灭菌不彻底,易造成污染;时间过长则可能导致生长受阻,甚至死亡。
2)MS培养基是腋芽生长最适基本培养基。培养基除了向植物提供无机盐,必要的维生素和氨基酸等营养,还具有维持植物细胞的渗透压,酸碱度和供给水分等作用。试验结果表明,以高浓度的NO3-N存在的MS类型培养基比较适合培养欧洲花楸。
3)欧洲花楸最适增殖培养基为MS+6-BA1.0mg/L+NAA0.1mg/L,增殖率为85%,增殖系数为18.60,且苗木粗壮、生长旺盛。
4)添加不同激素组合的生根率均明显高于添加单一激素的生根率。生长素类型与生长素浓度交互效应是显著的。最适生根培养基为MS+IBA1.5mg/L+NAA0.05 mg/L。
5)欧洲花楸组培生根苗移栽的关键是选取适宜的基质类型和控制好环境的温湿度。经试验,欧洲花楸生根苗移栽的最适条件为:生根培养30-40d的生根苗;移栽基质为腐殖土+珍珠岩+蛭石(1∶1∶1),环境温度控制在28℃,湿度控制在75%,此时欧洲花楸生根苗移栽成活率最高。

