尼妥珠单抗辅助治疗中晚期宫颈癌患者的疗效及其对外周血NLR、PLR的影响
王丹丹,李云龙,尤嵘
1洛阳市妇幼保健院妇科,洛阳 471000;2河南省肿瘤医院药剂科,郑州 450000
宫颈癌是一种女性生殖道恶性肿瘤,其最主要的致病因素为人乳头状瘤病毒(human papillomavirus,HPV)感染。针对宫颈癌的高发病率与致死率,目前临床可采取注射疫苗和定期体检筛查等方式来控制[1]。近年来,随着健康教育的不断加强与医疗水平的快速进步,宫颈癌的发病率与致死率均明显下降,但统计发现,该疾病患者正呈年轻化趋势[2]。宫颈癌在早期治愈率较高,预后也相对良好,但大部分患者确诊时疾病已发展至中晚期,导致预后差、生存期短[3]。超过85%的宫颈癌患者表皮生长因子受体(epidermal growth factor receptor,EGFR)蛋白异常表达[4]。有研究表明,恶性肿瘤预后质量与EGFR的表达有相关性,可以通过EGFR通路靶向治疗宫颈癌[5]。尼妥珠单抗是一种抗EGFR IgG1单克隆抗体,对晚期宫颈癌的疗效较佳,但其对晚期宫颈癌患者外周血的影响却鲜见报道[6-7]。因此,本研究探讨了尼妥珠单抗对晚期宫颈癌患者外周血中性粒细胞-淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)、血小板-淋巴细胞比值(plateletlymphocyte ratio,PLR)的影响,现报道如下。
1 资料与方法
1.1 一般资料
选择2016年8月~2018年10月本院收治的84例宫颈癌(ⅡB~ⅣA期)患者为研究对象,根据治疗方案的不同分为对照组(n=40)与观察组(n=44)。对照组:年龄29~74岁,平均年龄(54.92±6.75)岁;国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期[8]为Ⅱ期18例,Ⅲ期14例,Ⅳ期8例;病理类型为鳞癌34例,腺癌5例,腺鳞癌1例。观察组:年龄34~78岁,平均年龄(56.23±7.89)岁;FIGO分期为Ⅱ期19例,Ⅲ期17例,Ⅳ期8例;病理类型为鳞癌35例,腺癌7例,腺鳞癌2例。两组年龄、肿瘤分期和病理类型等一般资料比较无统计学差异(P>0.05)。本研究经本院医学伦理委员会批准(伦理批号:201608124)。
纳入标准:①符合FIGO相关标准[8]、经病理学检查确诊为宫颈癌且肿瘤均无法通过手术切除者。②FIGO分期为ⅡB~ⅣA期者。③通过影像学确认无远端转移者。④对本研究知情同意且已签署知情同意书者。排除标准:①对放射治疗和化疗治疗不耐受者。②伴严重脏器功能障碍者。③预计生存期<6个月者。④依从性不高者。
1.2 治疗方法
对照组接受化疗治疗与放射治疗。化疗治疗:紫杉醇注射液(上海创诺制药有限公司,国药准字H20103297,规格 5ml∶30mg)80mg/m2和顺铂注射液(云南生物谷药业股份有限公司,国药准字H20043889,规格2ml∶10mg)80mg/m2静脉滴注。在化疗过程中给予患者常规预防药物以镇吐,同时给予解毒、保肝等治疗,若出现严重不良反应,则停止化疗。化疗1次/周,共治疗5周。放射治疗:采用调强放射治疗,盆腔及淋巴引流计划靶区照射量45Gy;转移淋巴结外放10mm照射量50~55Gy;腔内后装治疗采用192Ir 高剂量率,A点剂量500cGy/次,且总量≥85Gy。放射治疗5次/周,共治疗5周。
观察组在对照组治疗基础上加用尼妥珠单抗[百泰生物药业有限公司,国药准字S20080001,规格50mg/瓶(10ml)],开始治疗后,于放射治疗前静脉滴注氯化钠注射液(石家庄四药有限公司,国药准字H130233201,规格250ml∶2.25g)250ml和尼妥珠单抗50mg,1次/周,共治疗5周。
1.3 观察指标
①临床疗效。参照WHO实体瘤疗效评价标准[9], 完 全 缓 解(complete remission,CR):肿瘤消失时间>1个月;部分缓解(partial relief,PR):肿瘤缩小>30%且持续超过1个月;稳定(stable disease,SD):肿瘤在缩小30%与增大20%之间,且持续超过1个月;进展(progress disease,PD):肿瘤增大>20%。治疗总有效率=(CR+PR+SD)例数/总例数×100%。②肿瘤退缩情况:分别于治疗前、治疗2周后和治疗5周后采用CT扫描,根据肿瘤长度、宽度和深度,计算患者实体肿瘤体积。③血清指标。分别于治疗前与治疗后,晨起采取患者空腹静脉血6ml置于乙二胺四乙酸二钾(EDTA-K2)抗凝管中送检。中性粒细胞计数、淋巴细胞计数、血小板计数采用SC-H90全自动血细胞分析仪(深圳开立生物医疗科技股份有限公司)检测,并计算NLR、PLR。④不良反应。记录治疗期间不良反应发生情况,包括白细胞减少、恶心呕吐、放射性直肠炎和膀胱炎等。⑤生存率。通过微信、电话以及医院就诊系统等方式对患者进行为期3年的随访,了解患者生存情况。
1.4 统计学方法
2 结果
2.1 临床疗效
治疗后,观察组治疗总有效率(97.73%)高于对照组(85.00%,P<0.05)。见表1。
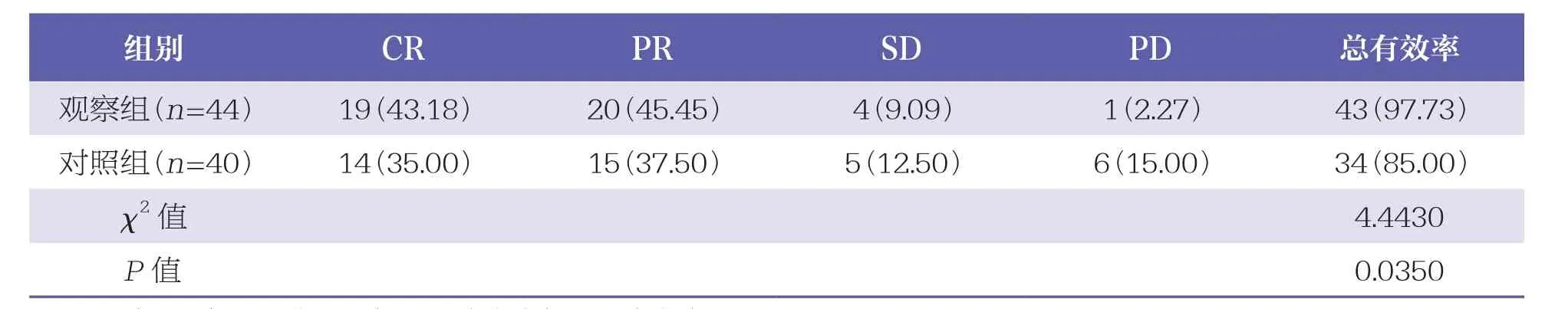
表1 两组临床疗效比较 n(%)
2.2 肿瘤退缩情况
重复测量方差分析显示,两组在不同治疗时间的肿瘤体积存在统计学差异(P<0.05),组别之间肿瘤体积也存在统计学差异(P<0.05),两组患者肿瘤体积变化趋势存在统计学差异(P<0.05)。见表2。
表2 两组肿瘤体积比较 ±s,cm3
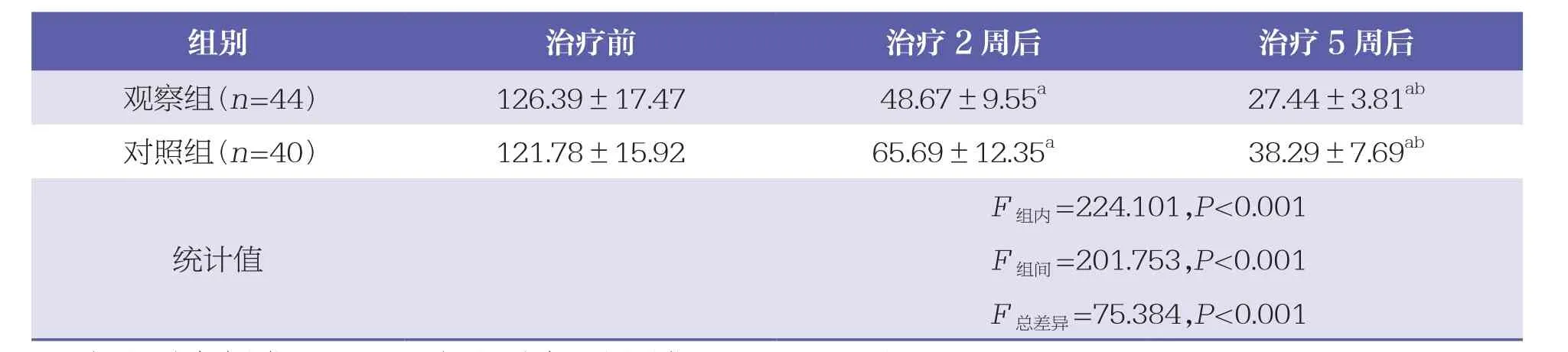
表2 两组肿瘤体积比较 ±s,cm3
与同组治疗前比较,a:P<0.05;与同组治疗2周后比较,b:P<0.05。下同
组别 治疗前 治疗2周后 治疗5周后观察组(n=4 4) 1 2 6.3 9±1 7.4 7 4 8.6 7±9.5 5 a 2 7.4 4±3.8 1 ab对照组(n=4 0) 1 2 1.7 8±1 5.9 2 6 5.6 9±1 2.3 5 a 3 8.2 9±7.6 9 ab F组内=2 2 4.1 0 1,P<0.0 0 1 F组间=2 0 1.7 5 3,P<0.0 0 1 F总差异=7 5.3 8 4,P<0.0 0 1统计值
2.3 血清指标
治疗前两组NLR、PLR水平均无统计学差异(P>0.05);治疗后两组NLR、PLR水平均明显降低,且观察组低于对照组(P<0.05)。见表3。
表3 两组NLR、PLR水平比较 ±s
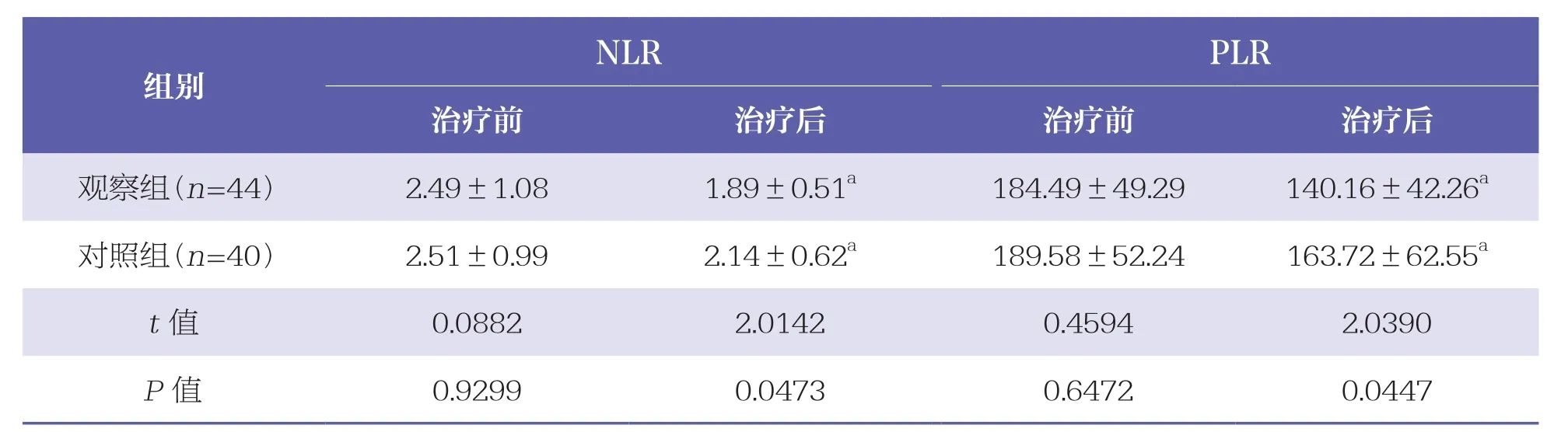
表3 两组NLR、PLR水平比较 ±s
NLR:中性粒细胞-淋巴细胞比组;PLR:血小板-淋巴细胞比组
N L R P L R治疗前 治疗后 治疗前 治疗后观察组(n=4 4) 2.4 9±1.0 8 1.8 9±0.5 1 a 1 8 4.4 9±4 9.2 9 1 4 0.1 6±4 2.2 6 a对照组(n=4 0) 2.5 1±0.9 9 2.1 4±0.6 2 a 1 8 9.5 8±5 2.2 4 1 6 3.7 2±6 2.5 5 a t值 0.0 8 8 2 2.0 1 4 2 0.4 5 9 4 2.0 3 9 0 P值 0.9 2 9 9 0.0 4 7 3 0.6 4 7 2 0.0 4 4 7组别
2.4 不良反应发生情况
治疗期间两组均发生了白细胞减少、恶心呕吐、放射性直肠炎和膀胱炎等不良反应,但两组比较无统计学差异(P>0.05)。见表4。
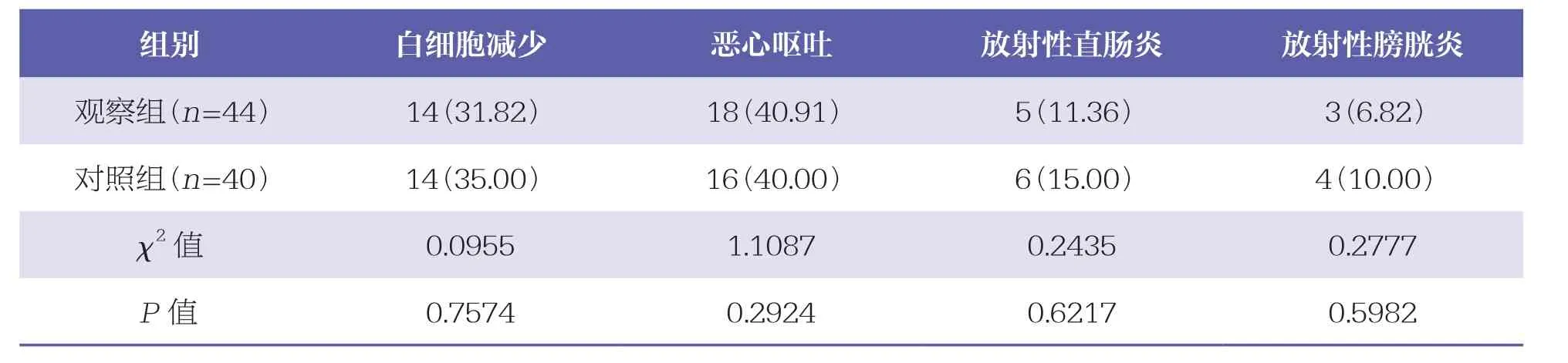
表4 两组不良反应发生情况比较 n(%)
2.5 生存情况
为期3年的随访结果显示,观察组1年、2年、3年生存率分别为95.45%、86.36%、77.27%,对照组1年、2年、3年生存率分别为90.00%、77.50%、62.50%。两组3年内生存率比较均无统计学差异(P>0.05),生存曲线见图1。
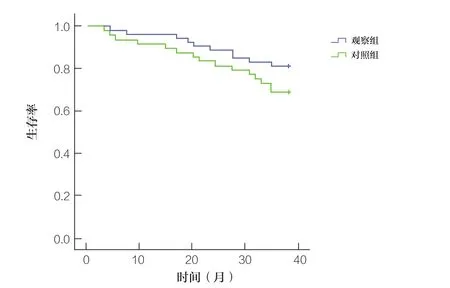
图1 两组生存曲线比较
3 讨论
宫颈癌有多种病理类型,其中鳞癌占比最大,其次为腺癌、腺鳞癌等,而透明细胞癌和小细胞癌等占比很小[10]。临床治疗宫颈癌的方案较多,一般结合患者身体状况、疾病进程以及生育需求等来综合选择治疗方案[11]。早期宫颈癌患者多选择手术治疗;基于鳞癌对放射线具有高敏感性,临床上治疗鳞癌大多采用放射治疗方案。一些化学药物能够抑制肿瘤细胞增殖、发展,同时与放射治疗有协同作用,因此中晚期宫颈癌治疗一般采用放射治疗结合化疗的方案[12]。宫颈癌的复发转移率仍然居高不下,这是宫颈癌致死率高的首要原因[13]。随着对基因学等的深入研究,宫颈癌的靶向治疗取得了较大突破,但其研究多针对复发转移患者,而对晚期宫颈癌患者的研究相对空缺。研究表明,EGFR在不同实体瘤患者中的表达水平不同,其表达水平与宫颈鳞癌的发病密切相关[14]。作为肿瘤治疗的一个重要靶点,EGFR及其抗体用于治疗肿瘤患者的研究已经被广泛报道[15]。尼妥珠单抗可通过与EGFR靶向结合,阻断EGFR与配体的结合,同时阻断相应的下游信号通路,从而使肿瘤停止发展。同时,尼妥珠单抗能够提高肿瘤细胞对放射治疗的敏感性,提升放射治疗效果[16]。此外,由于尼妥珠单抗是纯人源化抗体,安全性和亲和力良好,大剂量应用时不仅能特异性封闭EGFR,还可有效避免损伤机体正常细胞和组织[17-18]。
本研究以本院收治的晚期宫颈癌患者为对象,分析尼妥珠单抗的疗效及对患者外周血的影响。结果显示,经过5周的治疗,观察组临床疗效更佳,表明尼妥珠单抗辅助治疗晚期宫颈癌患者能有效提高近期疗效,这可能与尼妥珠单抗对EGFR的封闭性、对肿瘤细胞具有放射治疗增敏作用有关。通过监测患者肿瘤退缩情况发现,治疗前观察组和对照组平均肿瘤体积之间无统计学差异,治疗2周后和治疗5周后两组肿瘤体积均明显缩小,且同一时间点观察组肿瘤体积均小于对照组,提示尼妥珠单抗辅助治疗能有效改善晚期宫颈癌患者的肿瘤退缩情况,加速肿瘤细胞凋亡。NLR与PLR为全身性炎症指标,其测定、计算均简单、便捷,易于在临床中应用。有研究表明,NLR在晚期宫颈癌患者机体内表达水平高于早期患者,其与患者年龄、初潮以及宫颈癌分期关系密切,且对宫颈癌的分期与预后均有预测作用[19-20]。PLR在宫颈癌患者中的表达水平高于鳞状上皮内病变患者,表明PLR的表达水平可在一定程度上反映宫颈癌患者预后[21]。本研究中,治疗前两组NLR、PLR水平均无统计学差异,治疗后两组NLR、PLR均明显降低,且观察组低于对照组,提示尼妥珠单抗辅助治疗能有效减轻晚期宫颈癌患者的全身性炎症反应,改善预后。在治疗期间,两组均发生了白细胞减少、恶心呕吐、放射性直肠炎和膀胱炎等不良反应,但两组比较无统计学差异,表明尼妥珠单抗辅助治疗晚期宫颈癌的安全性良好,血清毒性以及胃肠道反应发生风险等较低,不会对患者身体造成负担。随访结果显示,观察组3年内生存率均高于对照组,但两组比较无统计学差异,其原因可能是本试验样本量过小。
综上所述,尼妥珠单抗辅助治疗中晚期宫颈癌患者能有效提高近期疗效,加速肿瘤细胞凋亡、使肿瘤退缩,还可使患者外周血NLR、PLR下降,且安全性良好。但本试验的分组方法在一定程度上依赖患者个人选择,可能造成选择偏倚,且随访时间长,人力物力耗费高,实施存在一定困难。同时,由于本研究样本量不足,因此对于尼妥珠单抗辅助治疗中晚期宫颈癌能否改善长期预后还需要扩大样本量进一步研究证实。

