群体感应淬灭酶对MBR-CANON工艺脱氮性能及污泥特性的影响
张肖静,张红丽,张楠,位登辉,马冰冰,张涵,杨浩洁
郑州轻工业大学 环境污染治理与生态修复河南省协同创新中心,河南 郑州 450001
0 引言
全程自养脱氮(Completely Autotrophic Nitrogen Removal Over Nitrite, CANON)工艺是近年来广受关注的新型脱氮技术,其脱氮过程能耗低、物耗少,是可持续污水处理技术的主要组成单元,也是实现污水处理碳中和的重要步骤[1-3]。然而,该工艺的高效稳定运行依赖高质量浓度的微生物量。近年来的研究[4-6]表明,膜生物反应器(Membrane Bioreactors, MBR)既能截留所有微生物,也能分开控制污泥停留时间和水力停留时间(Hydraulic Retention Time, HRT),可获得较高的微生物量且有利于CANON工艺中功能微生物好氧氨氧化菌(Aerobic Ammonia-oxidizing Bacteria, AOB)和厌氧氨氧化菌(Anaerobic Ammonia-oxidizing Bacteria, AAOB)的生长,因此被公认为是一种能实现自养脱氮工艺的高效反应器。然而,在MBR运行过程中,微生物会附着在膜表面并以生物膜形式生长,这会使膜组件的通量严重下降,导致膜污染。膜污染不仅增加了维护和运行成本,也严重限制了MBR的发展及应用[7]。为了控制或减缓膜污染,研究者们[8-9]提出了多种物理或化学方法,包括低通量操作、周期性反冲洗、间歇进水、膜改性、添加膜污染控制剂等。然而,这些控制手段不仅成本高,还存在引入次生污染物的风险。
群体感应是微生物之间的一种通讯机制,微生物产生并识别信号分子从而调控自身行为,酰基高丝氨酸内酯(Acyl-Homoserine-Lactones,AHLs)就是其中一种常见的信号分子[10]。群体感应淬灭酶可以通过催化降解AHLs调节细菌行为,如可溶性微生物产物(Soluble Microbial Products, SMP)和胞外聚合物(Extracellular Polymeric Substance, EPS)的产生、细胞外酶的分泌、生物膜的形成等,这一发现为控制MBR系统中细菌行为及膜污染开辟了一条新的途径[11]。根据催化降解AHLs机制的不同,可将群体感应淬灭酶分为3类:AHLs内酯酶、AHLs酰基转移酶和AHLs氧化还原酶。其中关于AHLs酰基转移酶的研究较为深入[12]。近年来的研究[13-14]证明,AHLs酰基转移酶可有效减缓膜污染,延长MBR运行周期。然而,CANON工艺的功能微生物AAOB对环境条件非常敏感,如将AHLs酰基转移酶用于控制MBR-CANON工艺的膜污染,其势必将对反应器的脱氮性能、微生物活性、关键酶活及功能微生物组成造成影响。鉴于此,本文探索性地研究了AHLs酰基转移酶对MBR-CANON工艺运行性能及微生物特征的影响,以期解决MBR-CANON工艺的膜污染问题并推动该工艺的发展及应用。
1 材料与方法
1.1 主要材料与仪器
主要材料:(NH4)2SO4、NaHCO3、MgSO4、CaCl2和KH2PO4,均为化学纯,甲醇(优级纯),均为阿拉丁试剂有限公司产;实验用淬灭酶为AHLs酰基转移酶Ⅰ,酶活力为500~1500 U/mg,美国Sigma公司产。
主要仪器:TU-1810型紫外分光光度计,北京普析通用仪器有限责任公司产;Muti3430型便携式水质参数测定仪,德国WTW公司产。
1.2 实验设置
本实验采用圆柱形MBR反应器,由有机玻璃制成,有效体积约为4.8 L。实验采用人工配水,配水中氨氮质量浓度约为200 mg/L,碱度约为1600 mg/L,同时含有微量元素及矿物质元素。运行过程中维持HRT为18 h,温度控制在18~22 ℃。实验共包含3个阶段,分别记为P0、P1和P2,其中P0不添加淬灭酶,P1和P2阶段分别加入0.1 mg/L和0.5 mg/L的淬灭酶。各阶段末从反应器内部取悬浮态的污泥样品进行EPS、SMP、关键酶活及功能微生物组成的测定,样品以各阶段标记命名。其中,P1和P2阶段结束时,由于膜丝表面明显附着有生物膜,同时采集了膜丝表面的生物膜样品,分别记为MP1和MP2。
1.3 分析方法
采用纳氏试剂分光光度法测定氨氮质量浓度,波长为420 nm;采用N-1-萘基乙二胺分光光度法测定亚硝酸盐氮质量浓度,波长为540 nm;采用紫外分光光度法测定硝酸盐氮质量浓度,波长为220 nm和275 nm。氨氮去除率和总氮去除率按照式①和②计算,其中C指物质的质量浓度/(mg·L-1)。泥样经8000 r/min离心后,上清液用于测定SMP的含量,剩余泥样中加入缓冲溶液,经加热提取得到的溶液用于测定EPS的含量。其中,EPS和SMP中的多糖含量采用蒽酮法测定,蛋白质含量采用福林-酚法测定。

①

②
基于文献[15-16]的方法,羟氨氧化还原酶(Hydroxylamine Oxidoreductase,HAO)的活性以铁氰化钾催化羟胺为反应基质进行测定,氨氮加氧酶(Ammonia Monooxygenase,AMO)活性通过硫酸铵氧化生成亚硝酸盐氮的速率来反映,亚硝酸盐还原酶(Nitrite Reductase,NIR)的活性则通过以甲基紫晶为电子供体还原亚硝酸盐氮的速率来反映。
1.4 高通量测序
每次取泥样时,均从反应器3个不同位置分别取样,混合后作为样品用于测定。从反应器内部和膜丝表面取样后,采用E.Z.N.ATM Mag-Bind试剂盒提取DNA。提取得到的合格DNA进行PCR扩增,扩增引物为341F/805R(341F:CCTACGGGNGGCWGCAG; 805R:GACTACHVGGGTATCTAATCC),得到的扩增产物在Miseq平台上进行高通量测序。测序结果与Silva数据库中的序列进行比对,并进行微生物分类。OTU定义为相似度大于97%,多样性指数Shannon和Simpson通过Mothur软件(Mothur v1.30.1)进行分析。
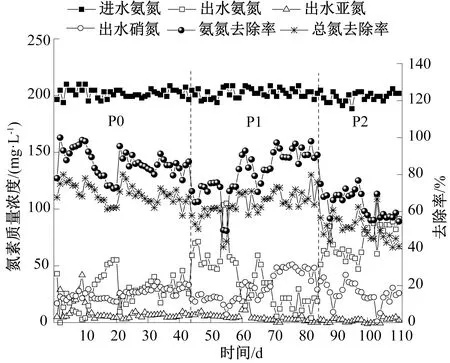
图1 反应器在不同阶段的脱氮效果Fig.1 Nitrogen removal performance of the reactor in each stage
2 结果与讨论
2.1 淬灭酶对反应器性能的影响
反应器在不同阶段的脱氮效果如图1所示。由图1可知,P0阶段前期,在进水氨氮质量浓度为200 mg/L左右的条件下,出水氨氮质量浓度逐渐下降,至第10 d时,出水氨氮质量浓度降为4.0 mg/L,但亚硝酸盐氮和硝酸盐氮分别剩余17.4 mg/L和25.7 mg/L。这说明,AOB的活性较好,能够及时将氨氮氧化为亚硝酸盐氮,但AAOB的活性不足以将亚硝酸盐氮及时还原。同时,硝酸盐氮生成量较高,说明反应器中存在硝化细菌(Nitrite-oxidizing Bacteria,NOB),而这不利于高效脱氮。因此,在第11 d,将反应器内的溶解氧从0.17 mg/L调节至0.10 mg/L。之后,反应器的氨氮去除率和总氮去除率均迅速下降,出水氨氮质量浓度升高,同时不再有亚硝酸盐氮残留。这说明,溶解氧质量浓度的降低限制了AOB的活性,不能将全部氨氮氧化为亚硝酸盐氮,但低溶解氧有利于AAOB对亚硝酸盐氮的还原。再次运行10 d后,即第21 d再次通过调节曝气量将溶解氧升高至0.13 mg/L左右,之后出水氨氮质量浓度迅速降低,氨氮去除率和总氮去除率随之升高,同时反应器内无亚硝酸盐氮积累,硝酸盐氮生成量约为28 mg/L,此时硝酸盐氮生成量与氨氮去除量的比值为0.16,略大于CANON反应的理论值0.11[17]。此后直至该阶段结束,反应器运行稳定,氨氮去除率和总氮去除率最终稳定在83.7%和65.9%。这表明,溶解氧是CANON反应器运行的关键参数,即使相差较小的数值,对反应器的脱氮性能及功能微生物的活性都有较大影响。与之前的研究结果相似[18],即溶解氧太高会抑制AAOB活性,太低则抑制AOB活性,在实际运行中,需要经过多次调控以找到最佳参数。
在第二阶段P1加入0.1 mg/L的AHLs酰基转移酶后,氨氮氧化受到抑制,出水氨氮质量浓度迅速升高,同时总氮去除率下降。加入后的第1 d,出水氨氮质量浓度从25.6 mg/L升高至59.2 mg/L,相应地,氨氮去除率从87.0%降低至71.1%,总氮去除率从68.0%降低至57.9%,而亚硝酸盐氮质量浓度无明显变化,硝酸盐氮生成量大幅降低。这表明,AHLs酰基转移酶刚加入时,不仅抑制了AOB的活性,同时也抑制了NOB的活性,但是对AAOB的影响较小。然而,在运行一段时间后,反应器去除效果回升,尤其是第59 d后,出水氨氮质量浓度显著降低,氨氮去除率和总氮去除率均随之升高,最终分别达到91.8%和70.5%,出水氨氮、亚硝酸盐氮、硝酸盐氮质量浓度分别为16.4 mg/L、0.7 mg/L和42.2 mg/L(最后5 d平均值,下同),这个现象可能是由于MBR-CANON体系内的微生物逐渐适应了AHLs酰基转移酶,AOB和AAOB的活性得到提升,进而提高了总氮去除率,同时有部分氨氮被氧化为硝酸盐氮。
反应器运行稳定后,进入P2阶段。将淬灭酶的质量浓度提高到0.5 mg/L,出水氨氮质量浓度再次出现大幅升高,在该阶段第1 d上升至51.2 mg/L,说明AOB活性再次受到严重抑制。亚硝酸盐氮尚无积累,出水硝酸盐氮质量浓度有所下降但仍然较高,说明NOB活性没有受到抑制。而脱氮效果的下降主要是因为AOB无法为AAOB及时提供足够的亚硝酸盐氮基质。第5 d反应器运行效果开始回升,经过波动后,最终出水氨氮、亚硝酸盐氮和硝酸盐氮质量浓度分别稳定在87.0 mg/L、3.3 mg/L和24.6 mg/L,氨氮去除率和总氮去除率则稳定在57.0%和43.6%。该结果表明,0.5 mg/L的AHLs酰基转移酶长期作用严重影响了氨氮的氧化,AOB和AAOB活性均受到持续抑制,NOB能够较快速适应,这对于维持自养脱氮稳定是不利的。有研究[19]表明,AHLs酰基转移酶的加入会导致脱氮效果下降,严重抑制AOB活性,但对其丰度影响不大,这与本文结果相似。本文实验中AOB受到持续抑制后,AAOB由于得不到充足的反应基质,也在较高质量浓度的AHLs酰基转移酶作用下受到抑制。
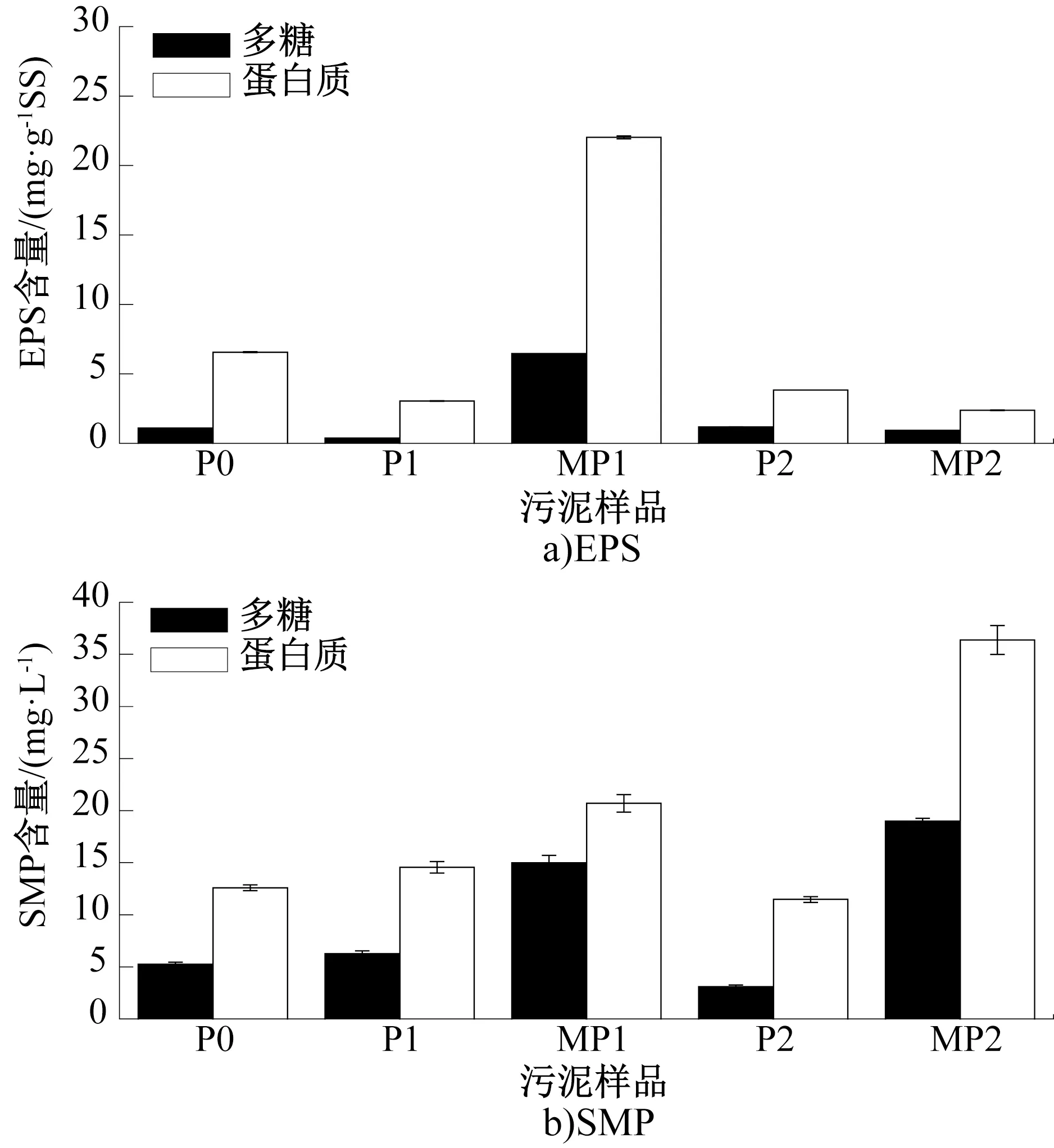
图2 各阶段悬浮污泥及膜附着污泥样品的EPS和SMP含量Fig.2 EPS and SMP contents of the suspended sludge and membrane attached sludge in each stage
2.2 淬灭酶对污泥EPS的影响
各阶段悬浮污泥及膜附着污泥样品的EPS和SMP含量如图2所示。由图2a)可知,在样品P0中,EPS中的多糖和蛋白质含量分别为1.1 mg/g SS(指单位质量污泥中的含量,下同)和6.6 mg/g SS,至P1阶段末,多糖和蛋白质含量均显著降低,分别降至0.4 mg/g SS和3.0 mg/g SS。一般认为,在受到毒性抑制时,微生物会大量分泌EPS以保护自身细胞的正常生命活动。但本实验中,AHLs酰基转移酶的加入却降低了EPS的含量,同样的结果在之前也有相关报道,例如猪肾酰基转移酶加入MBR后显著降低了EPS含量,有效抑制了膜污染[11]。其原因一方面是AHLs酰基转移酶的加入抑制了微生物对EPS的分泌,另一方面则是AHLs酰基转移酶会导致某些微生物受到抑制,尤其是膜污染微生物更易受到影响。
泥样MP1中,EPS中的多糖和蛋白质含量均显著升高(P<0.01),分别升至6.5 mg/g SS和22.0 mg/g SS。这说明低质量浓度的AHLs酰基转移酶会导致微生物生长趋向发生转变,逐渐向膜丝表面转移并附着生长。也可能是P1阶段运行时间较长,此时跨膜压力大、膜污染程度较重而导致的。而在P2阶段,悬浮污泥的EPS中多糖和蛋白质含量恢复至1.2 mg/g SS和3.8 mg/g SS,同时膜丝表面EPS中的多糖和蛋白质含量显著降低至0.9 mg/g SS和2.4 mg/g SS(P<0.01)。有研究[20]表明,膜丝表面附着的EPS是MBR出现膜污染的重要原因,而本文的结果表明,0.5 mg/L的AHLs酰基转移酶极大地抑制了EPS的分泌,降低了膜表面的EPS含量,有利于减缓膜污染速度。然而,值得注意的是,在该质量浓度下,氨氮的好氧氧化受到抑制,因此需进一步考查是否可用于厌氧系统的氨氮氧化,或者需结合其他抗抑制策略用于好氧系统。
SMP是反应器内的溶解性微生物产物,与死亡的微生物残体有密切关系。由图2b)可知,在P0阶段,SMP中多糖和蛋白质含量分别为5.3 mg/L和12.6 mg/L,而在P1阶段,SMP中多糖和蛋白质含量均略有升高,说明0.1 mg/L的AHLs酰基转移酶对于微生物生长影响较小。在P2阶段,SMP有轻微降低,表明AHLs酰基转移酶更多的是影响微生物活性,并不足以导致微生物死亡。膜丝表面附着污泥的SMP含量均比悬浮污泥要高,这是由于微生物产物更容易附着在膜表面,而膜表面的环境也更适合微生物附着生长。此外,据报道[21],反硝化菌可以利用SMP进行内源反硝化,这也是SMP含量出现波动的原因之一。
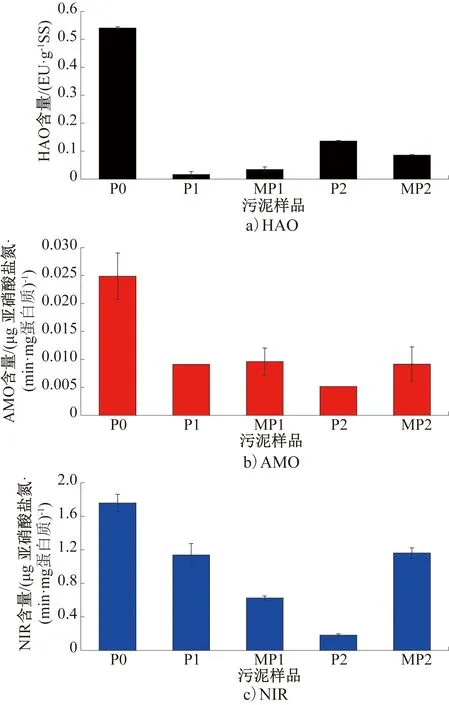
图3 反应器中各阶段关键酶活性的变化Fig.3 Variation of the key enzymes’ activity in each stage of the reactor
2.3 淬灭酶对关键酶活的影响
反应器中各阶段关键酶活性的变化如图3所示,其中P1和P2阶段的AMO仅测定了一次,故未进行误差分析。HAO是厌氧氨氧化过程的重要参与者,同时也广泛存在于 AOB和反硝化细菌中,能够催化脱氮过程中间产物—羟胺的氧化和还原。因此,HAO 的活性变化与 CANON 系统的脱氮效果密切相关[22]。由图3可以看出,加入AHLs酰基转移酶后,HAO的含量显著降低(P<0.01),从P0阶段的0.54 EU/g SS(指单位质量污泥的酶活性,下同)降低至0.016 EU/g SS,但到P2阶段有回升的趋势,悬浮污泥中的HAO含量略微升高到0.14 EU/g SS。这说明,AHLs酰基转移酶严重抑制了AOB的活性,但随着运行时间的延长,AAOB或反硝化菌逐渐适应,酶活增高。膜丝表面泥样的HAO含量也同样有所升高,从P1阶段的0.034 EU/g SS升高到P2阶段的0.086 EU/g SS。这说明AHLs酰基转移酶对自养脱氮系统有重要影响,但具体影响规律仍需进一步研究。
AMO主要存在于AOB中,反映了AOB氧化氨氮的活性[16]。由图3b)可知,在加入AHLs酰基转移酶后,AMO含量同样显著降低,从P0阶段的0.025 μg亚硝酸盐氮/(min·mg蛋白质)降低至0.009 μg亚硝酸盐氮/(min·mg蛋白质),并在P2阶段进一步降低至0.005 μg亚硝酸盐氮/(min·mg蛋白质),这再次说明,AHLs酰基转移酶对AOB活性影响较大,严重限制了氨氮的氧化。同时,在MP1和MP2样品中膜丝表面微生物的AMO活性在两个阶段变化不大,说明附着生长在膜丝表面的微生物受到的冲击较小,比悬浮态的污泥更能够耐受冲击,适应不利环境。
NIR是亚硝酸盐还原酶,其活性反映了微生物对亚硝酸盐氮的还原能力[23],在CANON工艺中则主要反映AAOB的活性。由图3c)可知,在加入AHLs酰基转移酶后,NIR也受到抑制,从P0阶段的1.76 μg亚硝酸盐氮/(min·mg蛋白质)降低到1.14 μg亚硝酸盐氮/(min·mg蛋白质)。但与HAO和AMO相比,其降低幅度较小,因而反映出AHLs酰基转移酶对AAOB活性影响较小。然而在P2阶段,NIR再次显著降低至0.18 μg亚硝酸盐氮/(min·mg蛋白质)(P<0.01),说明AHLs酰基转移酶质量浓度的升高增强了对AAOB的抑制。因此,在P2阶段,不仅AOB受到抑制,悬浮污泥中的AAOB同样受到抑制。值得注意的是,膜表面污泥中的NIR含量出现升高,从MP1的0.63 μg亚硝酸盐氮/(min·mg蛋白质)增加到MP2的1.16 μg亚硝酸盐氮/(min·mg蛋白质),这说明AAOB更加趋向于附着生长,其在膜表面污泥中的活性远远大于悬浮状态的污泥。膜表面污泥中AAOB活性的增强可以减小反应系统中AAOB受到的综合影响,而膜表面的AAOB分泌EPS较少,更加有利于控制膜污染。
通过分析以上3种关键酶的活性变化情况可知,AHLs酰基转移酶的加入,导致AOB的关键酶活受到严重抑制,而对AAOB的影响相对较小。AAOB在受到抑制时,更趋向于附着在膜丝表面生长以增强活性。因此推测,利用AHLs酰基转移酶减少EPS的分泌进而减缓膜污染的方法可能更适用于MBR-厌氧氨氧化系统。
2.4 淬灭酶对微生物群落的影响
在实验过程中,分别测得P0、P1、MP1、P2、MP2 5个泥样的有效序列个数为53 349、67 560、62 004、57 884、63 230,满足微生物分类的要求,按照相似度大于97%进行分类,5个样品的序列中分别包含479、488、477、475、474个OTU。而结合OTUs分布图(见图4)可知,5个样品中共有的OTU 为373个,每个样品独有的OTU较少。这说明,AHLs酰基转移酶的加入对CANON系统OTU组成及生物多样性的影响较小,对其微生物组成的种类影响不大。代表多样性的Shannon指数越高,代表微生物多样性越大,Simpson指数则相反。表1为高通量测序结果,表1显示,两个指数在几个样品中变化均较小。整体而言,加入AHLs酰基转移酶后,悬浮污泥中的生物多样性有所增加,从P0阶段的3.64增加到P1阶段的3.70,至P2阶段则进一步增加至3.82,这说明AHLs酰基转移酶的加入引入了一些新的微生物,但影响不显著。而膜表面污泥中的微生物多样性相对较小,这一方面是由于其附着时间较短,另一方面是由于附着在膜丝表面的微生物应具备一定的特性,比如黏性较大等,因此微生物组成相对较为简单,多样性较小,但随着AHLs酰基转移酶的加入,多样性同样有所增加。
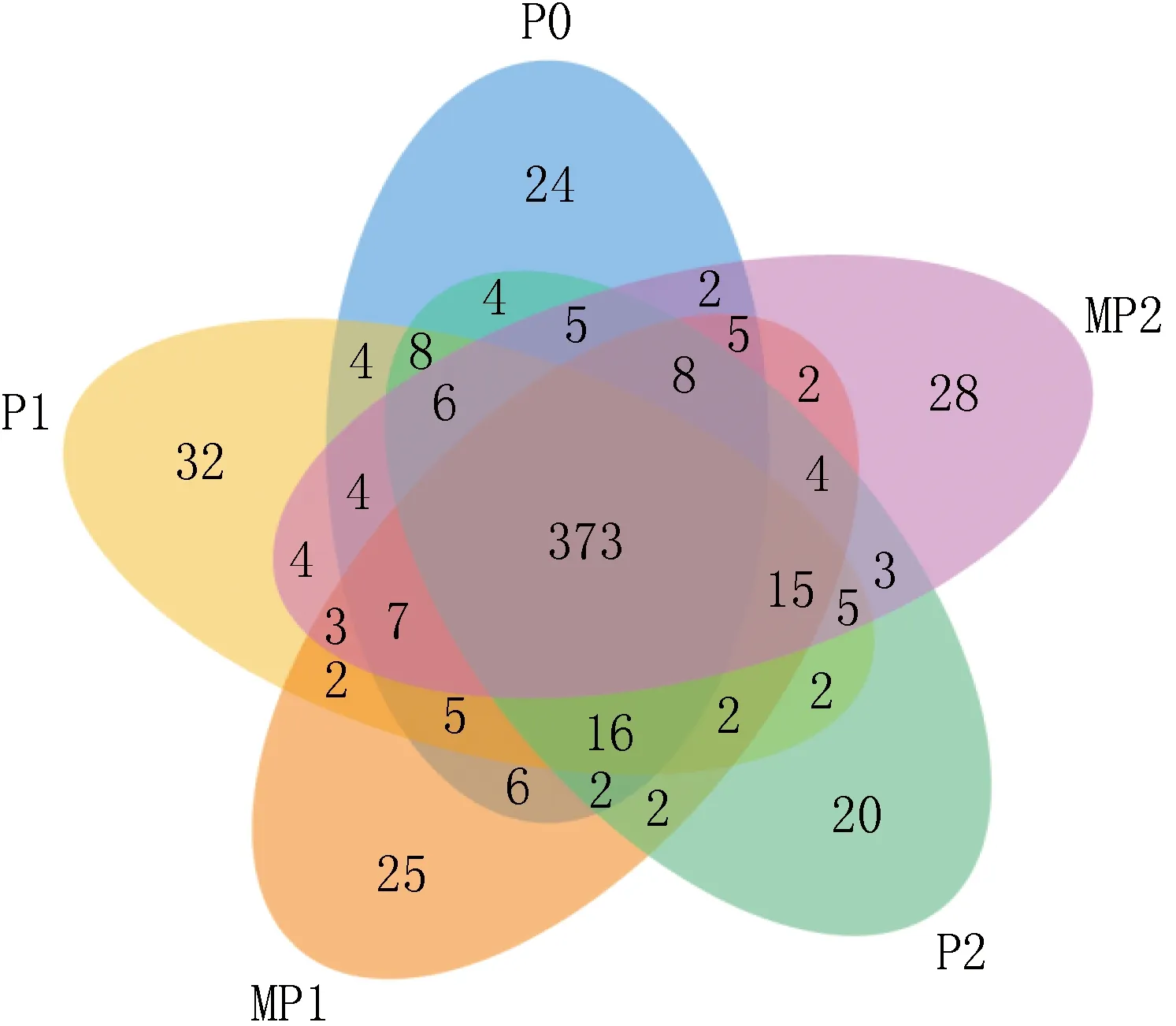
图4 OTUs分布图Fig.4 Distribution of OTUs
经与Silva数据库比对,各阶段悬浮污泥和附着污泥中微生物组成(属水平)如图5所示,与脱氮相关的微生物相对丰度见表1。其中,CandidatusKuenenia是典型的AAOB细菌,其相对丰度在P0阶段为21.1%,在P1阶段加入AHLs酰基转移酶后降低为17.1%,在P2阶段进一步降低至11.7%,这说明AHLs酰基转移酶的加入限制了AAOB的增殖,限制的原因可能是由于没有充足的基质而生长受限,从而导致总氮去除率下降。然而值得注意的是,膜丝表面同样存在AAOB,两个阶段的相对丰度分别为10.8%和9.3%,并不高于悬浮污泥,这是由于膜丝表面附着有大量与膜污染有关的微生物,减少了AAOB的相对占比。
Nitrosomonas是AOB细菌,其相对丰度同样出现下降,从7.1%降低至6.9%再进一步降低至5.7%。AOB丰度的下降并不明显,说明AHLs酰基转移酶的加入主要影响了AOB的活性,而对其相对丰度影响较小。相反,AHLs酰基转移酶对AAOB的限制则主要表现在相对丰度的降低,这是由于AOB活性受到抑制,无法为AAOB提供充足的基质,限制了AAOB的生长,该结论尚需进一步研究确认。膜丝表面污泥中的AOB和AAOB的相对丰度均低于悬浮污泥,与酶活的变化刚好相反,这说明附着生长的自养脱氮微生物活性更好,但膜丝表面生长了更多与膜污染相关的细菌,因此脱氮细菌占比较低。Nitrospira是系统中检测到的唯一NOB,这证实了反应器中过多的硝酸盐氮是由NOB氧化生成的。其相对丰度在整个实验过程中一直很低,从0.3%分别升高至0.8%和1.2%,这说明AHLs酰基转移酶的加入对硝化菌有一定的促进作用,从而导致反应器出水中硝酸盐氮的生成量相应增加。硝化菌相对丰度的升高不利于自养脱氮的稳定性,也不利于总氮的去除。膜丝表面的硝化菌含量也低于悬浮状态的污泥,分别为0.2%和0.9%。这说明,膜丝表面附着的更多是膜污染微生物,脱氮微生物则较多悬浮在反应器中。有研究[24]认为,AHLs酰基转移酶的加入虽然对有机物去除效果影响不大,但对微生物有较大影响。也有研究[25]表明,AHLs酰基转移酶的加入对微生物组成影响不大。此外,还有研究[26]认为,AHLs酰基转移酶的加入对革兰氏阴性菌有严重的抑制作用,而本文CANON系统中,功能微生物多为革兰氏阴性菌。结合本文的实验结果,AHLs酰基转移酶的加入对微生物组成影响较小,其生物多样性变化不大,但对功能微生物的相对丰度及关键酶活影响较大。因此,将群体感应淬灭酶应用于MBR-CANON系统的膜污染控制,需要解决的首要问题应是如何快速恢复功能微生物及关键酶的活性。
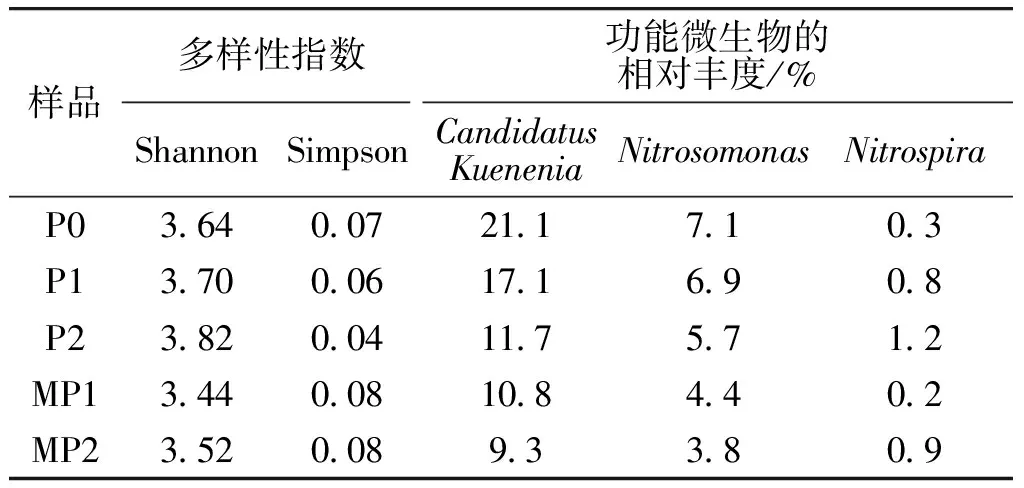
表1 高通量测序结果Table 1 Results of the high throughput sequencing
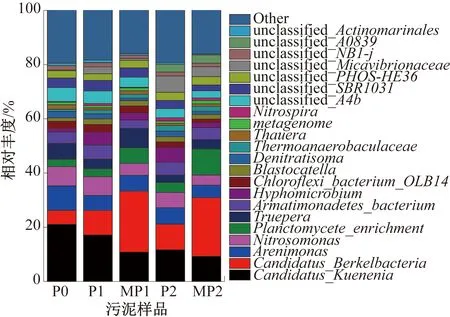
图5 各阶段悬浮污泥和附着污泥中微生物组成(属水平)Fig.5 Microbial composition of the suspended sludge and membrane attached sludge in each stage (in genus level)
3 结论
本文在稳定运行的MBR-CANON工艺过程中投加AHLs酰基转移酶,跟踪分析该工艺各阶段的脱氮性能、污泥性能、关键酶活及微生物组成的变化情况,得出:0.5 mg/L的AHLs酰基转移酶可大幅降低膜丝表面污泥的EPS含量,有利于减缓膜污染;AHLs酰基转移酶的加入,抑制了AOB及其关键酶活,对AAOB活性的抑制则相对较小,且长期运行后有一定的适应性;AHLs酰基转移酶对AOB的相对丰度影响较小,对AAOB的相对丰度影响较大,AAOB受到的影响主要表现为生长受限;AHLs酰基转移酶对NOB有一定的诱导作用,不利于自养脱氮工艺的稳定性。该研究结果表明AHLs酰基转移酶可用于调控MBR-CANON工艺的膜污染,但需考虑如何减轻其对功能微生物及关键酶活性的影响,并进一步了解其对单独的亚硝化或者厌氧氨氧化工艺的影响规律。

