同时检测H5和N8亚型AIV双重纳米PCR方法的建立和应用
李 丹,李 孟,谢芝勋,罗思思,张民秀,谢丽基,黄娇玲,华 俊,粟永春,阮志华
(1.广西壮族自治区兽医研究所/广西兽医生物技术重点实验室,广西 南宁 530001;2.广西金陵农牧集团有限公司,广西 南宁 530049)
禽流感(Avian influenza,AI)是一种由禽流感病毒(Avian influenza virus,AIV)引起的禽类传染性病毒病[1]。AIV具有亚型多、传染性强和分布广且具有一定的宿主特异性且变异快的特点[2-5]。依据AIV对鸡致病力的不同,AIV可分为高致病性禽流感病毒(HPAIV)和低致病性禽流感病毒(LPAIV),HPAIV引起的禽类感染死亡率极高,给养禽业造成了巨大的经济损失[6-8]。能引起HPAI发生的主要是H5和H7亚型AIV,其中影响最大的是H5亚型HPAIV。目前,H5亚型AIV已在60多个国家的家禽和野鸟中被检测出,包括H5N1、H5N2、H5N3、H5N5、H5N6和H5N8等组合,而且该亚型组合的病毒还在不断地进化和变异[9-10]。近年来,H5N8亚型AIV作为其中一个重要亚型组合,逐渐引起了人们的关注。1983年H5N8疫情首次在冰岛发生过流行,中国于2010年首次在家禽中检测出H5N8亚型AIV[11]。2014年初在韩国和日本的家禽中发现该亚型AIV,并传播至欧洲和北美洲[12-13]。2020年以来,世界动物卫生组织(OIE)通报发现,沙特阿拉伯和匈牙利等国家的家禽中再次暴发了H5N8亚型AI,并蔓延至其他国家[14-15]。2020年12月,国际上首次报告俄罗斯养殖场工作人员感染H5N8亚型AIV的病例[16]。H5N8禽流感病毒在亚欧大陆和非洲大流行,已成为影响全球家禽养殖、野生动物安全的一个重要因素。同时,新发生的H5N8禽流感病毒可造成人感染,已成为值得关注的公共卫生问题,须引起高度重视。因此,建立能迅速、有效地鉴别H5和N8亚型禽流感病毒的检测方法,对禽流感的防控及保障人类公共卫生安全具有十分重要的意义。
目前,病毒分离鉴定是诊断AIV感染的“黄金标准”,由于AIV亚型众多且新的变异株不断出现,采用传统方法对其进行分型和诊断,不仅存在着操作方法复杂,而且检测周期长、容易受抗体等因素影响,使得检测结果不能准确和及时地判断[17-18]。AIV分子生物学检测技术主要包括RT-PCR和荧光定量PCR等方法,纳米PCR技术是近年来新兴起的一种将纳米技术与分子生物学技术相结合的核酸检测技术,该技术在改善PCR反应特异性和敏感性等诸多方面具有一定的优势,可以有效地提高PCR检测结果的准确性和可靠性[19-21]。随着科学技术日新月异地发展,人们不断地改良和优化纳米PCR检测方法并扩展至其他应用领域。目前,纳米PCR技术在动物疫病检测领域已经有一些报道[22-25],而双重纳米PCR(nano-dPCR)技术的反应体系能同时扩增H5和N8基因并用于检测和鉴别H5N8亚型AIV的核酸检测技术尚未见相关报道。本研究旨在建立一种同时检测H5和N8亚型AIV的双重纳米PCR方法,以期为监测H5亚型和N8亚型AIV的流行情况及其鉴别诊断提供新的技术支撑。
1 材料与方法
1.1 材料
1.1.1 主要试剂和仪器 纳米PCR试剂盒(NPK02)购自上海沪峥生物科技有限公司;DNA/RNA共提试剂盒、小量质粒提取试剂盒、凝胶回收试剂盒、感受态细胞、PCR产物快速连接载体和DNA Marker均购自北京全式金生物技术有限公司;购自宝生物(北京)有限公司的试剂有M-MLV、随机引物、dNTP、RNA抑制剂。其他试剂均购自商业公司。PCR仪购自美国Bio-Rad Laboratories公司,超微量分光光度计购自美国Thermo公司,实验所用SPF鸡胚购自北京勃林格殷格翰维通生物技术有限公司。
1.1.2 毒株 毒株(H1N2、H3N2、H4N2、H6N8、H6N1、H9N2、NDV、IBV、ARV、ILTV和ChPV)均由广西兽医生物技术重点实验室保存;H7N2、H13N6、H14N5、H16N3和H15N9亚 型AIV的cDNA模板由美国宾夕法尼亚州立大学惠赠;H5N1和H5N2亚型AIV的cDNA模板由美国康涅狄格州立大学惠赠;其他AIV(H2N3、H8N4、H10N3、H12N5和H11N3)毒株或cDNA模板均由香港大学惠赠。
1.2 方法
1.2.1 引物的设计与合成 运用DNAStar软件,将GenBank中下载的N8亚型AIVNA和H5亚 型AIVHA基因的核苷酸序列进行比对,分别对2种目的基因进行特异性保守区域的筛选,采用Primer 6.0和Oligo 6.0软件设计特异性引物,并通过NCBI BLAST在线验证其特异性,筛选出分别针对2种目的基因的2对特异性引物。设计出的引物序列见表1。上述引物均由华大基因广州分公司合成。

表1 H5和N8亚型AIV HA和NA基因的引物序列
1.2.2 病毒RNA/DNA的提取与RNA的反转录 参照试剂盒使用说明书,运用DNA/RNA抽提试剂盒对实验中所用到的AIV、NDV、IBV、ARV和ILTV的DNA/RNA进行抽提,并用DEPC水溶解抽提后的DNA/RNA。参照反转录酶说明书,对RNA病毒的抽提产物进行反转录合成cDNA,所有DNA和cDNA产物均置于-30 ℃冰箱中保存。
1.2.3 双重纳米PCR反应体系及其条件的优化 nanodPCR方法的PCR反应体系为25 μL:2×Nano-QPCR buffer 12.5 μL,Taq DNA polymerase(5 U/μL)0.5 μL,作为模板N8亚型AIV和H5亚型AIV的cDNA各加入1 μL;再分10个梯度各加入0.1~1.0μL对引物H5-F、H5-R、N8-F和N8-R(25 pmol/μL)进行引物浓度的优化;最后,用超纯水将反应总体积补足至25 μL。为最终确定最佳的反应体系及条件,根据实验结果对退火温度和时间进行优化。
1.2.4 特异性实验 为验证所建立的nano-dPCR检测方法的特异性,按照优化后的条件,用该法对H1N2、H2N3、H3N2、H4N2、H5N1、H5N2、H6N8、H6N1、H7N2、H8N4、H9N2、H10N3、H11N3、H12N5、H13N6、H14N5、H15N9、H16N3、NDV、IBV、ILTV和ARV进行特异性扩增,检验其特异性。对扩增出的目的片段进行纯化和回收,PCR产物快速连接至载体上,并转化到感受态细胞中进行克隆,挑选阳性单克隆菌送赛默飞广州分公司进行测序和验证。
1.2.5 标准品的制备 分别以N8亚型AIV与H5亚型AIV的cDNA为模板,用特定的引物对N8亚型AIVNA和H5亚型AIVHA基因的全长片段进行PCR扩增,得到其N8亚型AIVNA和H5亚型AIVHA基因的全长目的片段,再分别将2个基因片段连接到PCR产物快速连接载体中,并转化到感受态细胞中进行克隆,挑选阳性单克隆菌送华大基因广州分公司进行测序验证。将含有N8亚型AIVNA和H5亚型AIVHA基因片段的2种重组质粒分别命名为N8-T和H5-T。分别提取N8-T和H5-T的质粒,并用微量核酸检测仪对其进行核酸浓度的测定,根据分子质量和核酸浓度计算对应的拷贝数,将N8-T和H5-T等拷贝数混合,并稀释10倍,以得到N8-T和H5-T质粒DNA浓度均为5× 100~5×109拷贝/μL的标准品。
1.2.6 敏感性实验 为检测该方法的敏感性,运用所建立的H5和N8亚型禽流感病毒双重普通PCR(dPCR)和nano-dPCR的检测方法,同时对N8-T和H5-T质粒浓度为5×100~5×109拷贝/μL的样品进行特异性扩增,并比较这2种方法的敏感性。
1.2.7 临床样品检测 对活禽市场采集的130份家禽咽喉及泄殖腔拭子样品运用建立的nano-dPCR检测方法进行检测和鉴定,同时将样品处理后接种SPF鸡胚进行病毒分离鉴定,将病毒分离鉴定结果与nano-dPCR检测结果进行比较;然后将阳性样品进行HA和NA基因全长扩增,并将HA和NA基因全长克隆送测序公司进行测序和分析,以验证nano-dPCR检测结果的准确性和可靠性。
2 结果与分析
2.1 双重纳米PCR方法的建立
通过nano-dPCR方法分别对H5亚型AIV和N8亚型AIV的目的基因进行扩增,经琼脂糖凝胶电泳检测,可分别获得207和428 bp的特异性目的片段(图1),与预期片段大小相符。
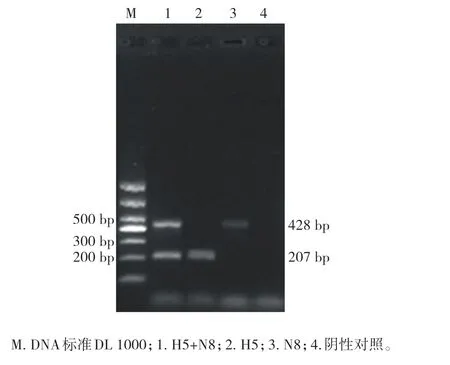
图1 H5和N8亚型AIV目的基因nano-dPCR扩增图谱
2.2 H5亚型和N8亚型AIV nano-dPCR检测方法的最佳退火温度和最佳反应条件的确定
H5亚型和N8亚型AIV nano-dPCR经退火温度(46~53 ℃)优化,琼脂糖凝胶电泳结果见图2。由图2可知,49~50 ℃下nano-dPCR扩增效果均表现为良好,最终选择50 ℃为nano-dPCR检测方法的最佳退火温度。nano-dPCR方法的PCR最佳反应体系为25 μL:2×Nano-QPCR buffer 12.5 μL,Taq DNA polymerase(5 U/μL)0.5 μL,作为模板N8亚型AIV和H5亚 型AIV cDNA各 加 入1 μL,引 物H5-F和H5-R(25 pmol/μL)0.8 μL、引物N8-F和N8-R(25 pmol/μL)1.2 μL,加ddH2O补足25 μL。最终优化的反应条件为:94 ℃、3 min;进入94 ℃、20 s,50 ℃、30 s,72 ℃、30 s,共30个循环;然后,再72 ℃延伸5 min,最后,4 ℃结束反应。

图2 nano-dPCR退火温度优化结果
2.3 特异性实验
在H5、N8亚型AIV扩增结果中出现2条特异性条带,分别为207和428 bp;在H5N2亚型AIV即H5Ny(y≠8)亚型AIV扩增结果中仅出现1条特异性条带,片段大小为207 bp;在H6N8亚型AIV即HxN8(x≠5)亚型AIV扩增中仅出1条特异性条带,片段大小为428 bp。对其他亚型AIV以及常见的禽病病原体的扩增中均未出现条带(图3),由此表明nano-dPCR检测方法的特异性良好。

图3 特异性扩增实验结果
2.4 敏感性实验
以初始浓度均为5×109拷贝/μL的H5-T和N8-T,经过ddH2O 10倍系列的稀释,取每个稀释度的重组质粒模板进行nano-dPCR和dPCR检测。敏感性实验结果表明:nano-dPCR可检测H5亚型AIVHA和N8亚型AIVNA基因的最低拷贝数均为5×102拷贝/μL;而使用dPCR方法检测的最低拷贝数均为5×104拷贝/μL(图4)。nano-dPCR检测方法的敏感性比dPCR检测方法高100倍。

图4 H5和N8亚型AIV nano-dPCR和dPCR敏感性实验结果
2.5 临床样品检测
运用该方法对广西兽医生物技术重点实验室从南宁活禽市场采集的130份鸡口腔及泄殖腔棉拭子品进行检测。样品nano-dPCR检测的结果显示:6份样品能扩增出478 bp的目的条带,为H5NxAIV,阳性率为2.31%;15份样品能扩增出428 bp的目的条带,为HyN8 AIV,阳性率为11.54%;所有样品同时接种SPF鸡胚进行病毒分离,病毒分离结果与nano-dPCR方法检测结果完全一致。nanodPCR获得的产物测序结果显示,nano-dPCR获得的207、428 bp特异片段分别与H5亚型AIVHA、N8亚型AIVNA基因序列的符合率均为100%。
3 讨论
近年来,由于不同组合H5亚型AIV感染引发的高致病性禽流感疫情持续出现,已经威胁家禽养殖业的健康可持续发展,并引发严重的公共卫生危机[26-27]。另外,某些N8亚型AIV(例如H10N8、H3N8和H5N8等)还能直接感染人类,对人类公共卫生安全构成了严重的威胁[28-29]。由于不同亚型禽流感病毒感染家禽后的临床症状、剖检病变极其相似,肉眼和常规的方法难以对其进行快速、准确的鉴别诊断。普通PCR在临床检测上比较常用,虽然实时荧光定量PCR检测的敏感性比普通PCR高,但需要昂贵的精密仪器且操作程序复杂。纳米技术已经广泛应用到生命科学的各个领域,随着对纳米材料在PCR反应过程中作用机制的深入研究,更多研究团队开发了检测不同动物疫病的纳米PCR技术[30]。目前,纳米PCR已成功应用于感染猪、牛、鸡、犬和猫等多种动物病原的临床检测中[31-32],上述研究所建立的纳米PCR检测方法灵敏度均比普通PCR检测方法的高,且特异性更好。
前期纳米PCR的研究多集中在对单一病原检测方法的研究。近年来,多重纳米PCR逐渐成为研究热点。在多重PCR反应体系中,引物的设计至关重要,它是决定多重PCR反应成功与否的关键。本研究在引物设计时,充分平衡各种影响多重PCR的因素,同时将扩增H5亚型AIVHA和N8亚型AIVNA基因的引物,进行多个引物组合的比对和筛选优化,并依据长期的实践经验,选择最佳的引物对组合进行nano-dPCR扩增,为nano-dPCR方法的成功建立奠定了基础。退火温度优化实验的结果表明:nano-dPCR产物在49~50 ℃的低退火温度条件下均能得到很好的扩增,在增加PCR产物量的同时,避免了引物间的非特异性扩增。本实验对所获得的特异性PCR产物进行了测序和比对分析,结果表明:nano-dPCR扩增获得了预期片段大小一致的特异条带,且测序结果与所设计基因片段高度一致。敏感性实验对比的结果表明,nano-dPCR的最低核酸检测量比普通dPCR最低核酸检测量高100倍,与其他研究者的结果基本一致[33],表明本研究建立的nano-dPCR反应具有良好的敏感性。
应用本实验所建立的nano-dPCR对临床样品进行检测,N8亚型AIV的感染率为11.54%,H5亚型AIV感染率为2.31%。由检测结果可知,N8亚型AIV在鸡群中存在普遍感染,N8亚型AIV的阳性率远高于H5亚型AIV的阳性率。此外,在本次检测中未出现了H5亚型AIV和N8亚型AIV的混合感染现象,这提示在禽流感防控的过程中,应该对H5亚型AIV和N8亚型AIV给予关注。
4 结论
本研究成功地建立了能同时检测H5亚型和N8亚型的双重纳米PCR检测方法,该方法具有比普通PCR方法灵敏性更高,又比实时荧光定量PCR方法更简便的特点,更有利于在基层推广应用,为H5亚型和N8亚型AIV的临床检测及防控提供了新的技术支撑。

