贵州省5 个金背鲤(Cyprinus carpio var.Jinbei)地理种群的遗传多样性与遗传结构分析
纪达,许劲松,姚俊杰,安元银,赵武,余忠奎,张昌帮
(1.贵州大学渔业资源与环境研究中心,贵州 贵阳 550025;2.贵州省水产技术推广站,贵州 贵阳 550025;3.贵州省台江县水产技术推广站,贵州 台江 556300)
稻田中养殖的金背鲤Cyprinus carpio var.Jinbei(暂定名)背鳍两侧有两条稳定遗传的金色条纹、头盖骨上有形似金色蝴蝶图案而得名,俗称“金边鲤”、“金线鲤”、“苗鲤”等,主要分布在黔、桂、湘三省交界处。近年来,贵州大学渔业资源与环境研究中心联合多个单位以贵州省本土稻田金背鲤为基础群体,针对贵州省稻田金背鲤开展选育工作。相比于建鲤Cyprinus carpio var.Jian、黄河鲤Cyprinus carpio 等,金背鲤性情温顺,在稻田中不易逃逸,觅食能力强,对温差的耐受力强、耐低氧,易成活,适应稻田浅水环境,近年来已陆续在贵州及周边省份推广,是贵州省非常重要的地方稻田鱼种质资源。
线粒体DNA(mtDNA)具有遵循母系遗传、进化速率快等特点;线粒体基因片段D-loop、Cyt b、COI、COII 等已作为一些鱼类遗传多样性的标记[1-5]。D-loop区是线粒体基因非编码区,缺乏编码压力,进化速率更快,可以更为灵敏地反应遗传多样性,在生物群体系统进化及遗传变异等研究中应用较多[6]。Cyt b 基因长度和进化速度适中,是遗传多样性、遗传结构和系统分化的重要分子标记基因[7]。
近年来,对稻田鱼的遗传多样性研究很多。Ren等[8]采用微卫星(SSR)研究了青田田鱼(Cyprinus carpio var.qingtianensis),发现稻田养殖青田田鱼群体遗传多样性低于野生群体;甘宝江等[9]采用微卫星研究广西稻田养殖金边鲤的遗传多样性,亦发现稻田养殖群体平均期望杂合度、多态信息含量、观测杂合度均低于野生群体。目前贵州省稻田养殖金背鲤的遗传多样性尚未明确,本研究联合线粒体DNA D-loop、Cyt b 基因分析贵州省5 个金背鲤群体的遗传多样性与遗传结构,旨在更准确地了解贵州省稻田中金背鲤群体的遗传多样性现状与遗传结构变异,为金背鲤的种质资源评价提供基础。
1 材料与方法
1.1 材料
前期经过调研发现,贵州省5 个区域有金背鲤(图1、图2)。2020 年8 月至10 月,先后在贵州省黔东南州的锦屏县(JP)、黎平县(LP)、从江县(CJ)和黄平县(HP)及都匀市匀东镇(DY)取125 尾金背鲤样本,每个采样点25 尾,体质量为379.4~431.8 g,体长为22.51~24.90 cm(表1)。
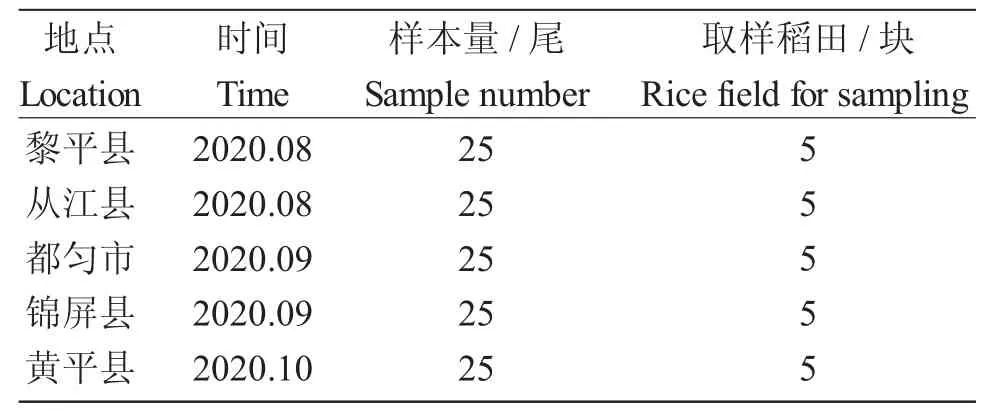
表1 采样信息Tab.1 Sampling information

图1 金背鲤侧面标准照Fig.1 Standard photo of side view of Jinbei commonn carp C.carpio var.Jinbei

图2 金背鲤背部标准照Fig.2 Standard photo of dorsal view of Jinbei commonn carp C.carpio var.Jinbei
1.2 基因组DNA 的提取与检测
剪取活金背鲤背部肌肉,无水乙醇-20℃保存。采用擎科生物科技有限公司的动物基因组提取试剂盒提取DNA,获得的DNA 样品采用分光光度计检测样品OD 值均在1.9 以上,-20℃保存备用。
1.3 PCR 扩增
D-loop 序列和Cyt b 序列引物分别为F1:5'-GGGAGGTAGCACTCCCTTTAT-3',Y1:5'-TGATTAATTATATTAGAGTATTTAGTGTCGAGCCTC、F1:5'-AAAATCGCTAACGACGCACT,Y1:5'-AACCATC CTGCTAGTGGCATA,PCR 体系总体积均为25 μL,包括模板DNA 1 μL,上下游引物各1 μL,金牌MIX(擎科生物有限公司生产)22 μL。PCR 扩增条件均为98℃预变性3 min,98℃变性10 s,58℃退火10 s,72℃延伸30 s,35 个循环,最后72℃终延伸1 min。产物用1%的琼脂糖进行凝胶电泳检测,在凝胶成像系统上观察产物长度与浓度,PCR 原液委托擎科生物有限公司进行双向测序。
1.4 数据统计及分析
运用Clustal X 1.81 软件将测序结果进行对位排序并辅以人工调整[10];运用MEGA v6.0 软件计算序列的碱基含量、变异位点、各种群间的遗传距离,并使用邻接法构建进化树[11];运用DnaSP v5.0 软件统计单倍型(Hap)种类和数量,计算单倍型多样性(Hd)、核苷酸多样性遗传多样性(Pi)、绘制核苷酸不匹配分布图[12];运用Arlequin v3.5 计算遗传分化指数(Fst)和分子变异方差分析,以1 000 次置换分析显著性,同时进行中性检验得到Fu's Fs、Tajima's D值[13];基因流采用公式Nm≈(1-Fst)/4Fst计算;采用Network 5.0 构建单倍型网络图[14]。
2 结果与分析
2.1 金背鲤5 个群体D-loop 和Cyt b 序列碱基组成
对125 尾金背鲤线粒体DNA D-loop、Cyt b 区进行了扩增与测序,将测序结果两端不稳定部分裁剪,保留了748 bp(D-loop)和902 bp(Cyt b)的序列用于进一步分析。其中,D-loop 序列中4 种碱基平均含量为A(32.6%)、T(33.3%)、C(19.6%)、G(14.5%),其中(A+T)含量为(65.9)%、(C+G)含量为(34.1)%;Cyt b 序列中,4 种碱基平均含量为A(28.9%)、T(26.4%)、C(30.4%)、G(14.3%),其中(A+T)含量为(55.3)%,(C+G)含量为(44.7)%(表2)。
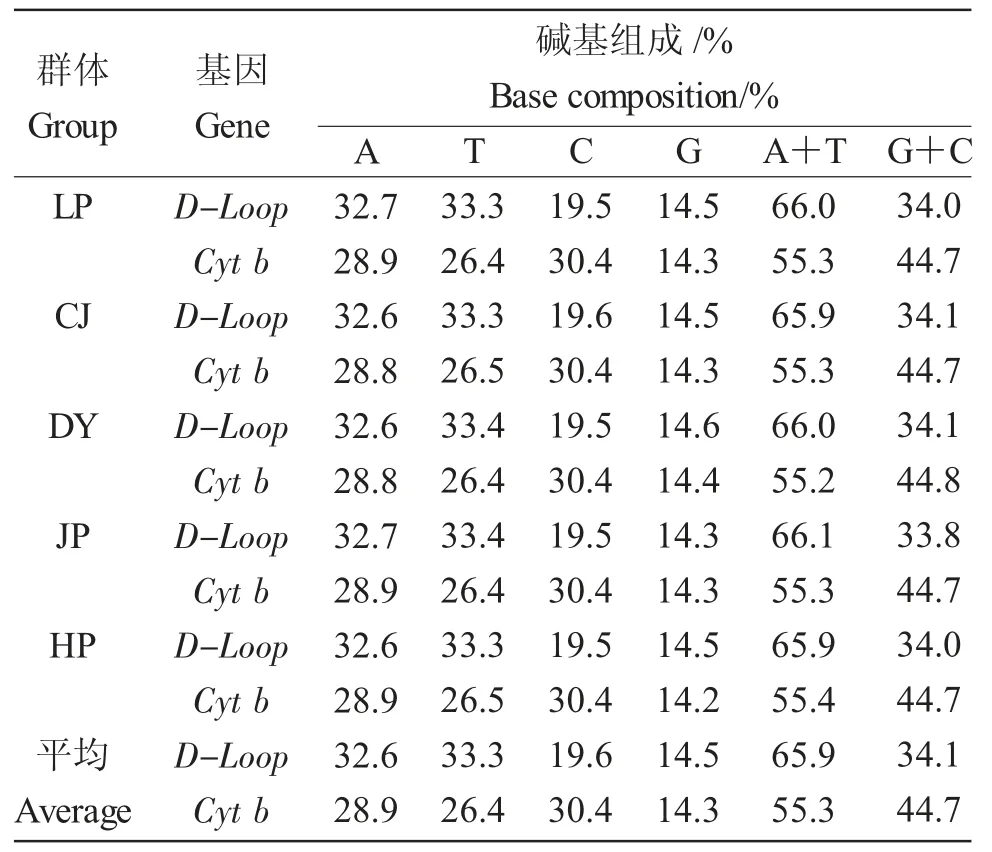
表2 5 个金背鲤群体D-loop、Cyt b 序列碱基组成(n=125)Tab.2 Base composition of D-loop and Cyt b sequences in five populations of Jinbei common carp C.carpio var.Jinbei(n=125)
2.2 基于D-loop、Cyt b 序列的遗传多样性参数
基于D-loop 和Cyt b 序列,5 个稻田金背鲤种群分别界定出21 和28 种单倍型,锦屏群体单倍型多样度(Hd)和核苷酸多样度(Pi)序列最低。黎平县群体D-loop 序列最高,从江县群体Cyt b 序列显示最高(表3)。
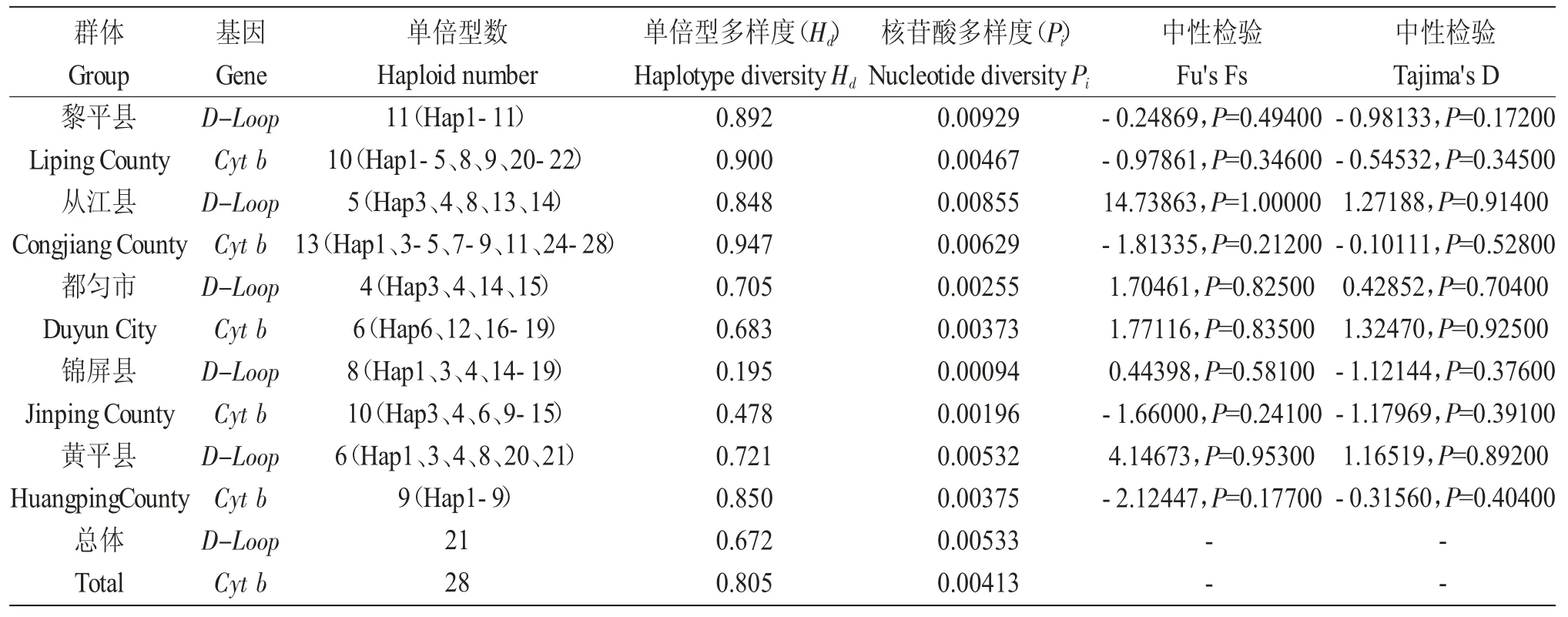
表3 金背鲤群体线粒体D-loop 序列的遗传多样性参数(n=125)Tab.3 Genetic diversity parameters of mitochondrial D-loop sequence in groups of Jinbei common carp Cyprinus carpio var.jinbei(n=125)
2.3 NJ 系统树与单倍型网络结构
以青海湖裸鲤Gymnocypris przewalskii(Gen-Bank 登录号:NC008661.1)为外群,基于Cyt b 序列构建稻田金背鲤5 个群体的邻接系统树(图3)。结果显示,金背鲤5 个群体间没有形成独立的谱系,种群间进化关系成交叉式嵌套,没有较为明显的地理分化。
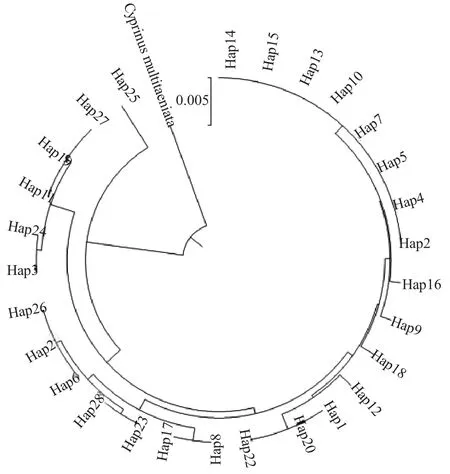
图3 基于Cyt b 序列构建单倍型邻接系统树Fig.3 Construction of haplotype adjacency system tree based on Cyt b sequence
用Network5.0 软件基于Cyt b 序列绘制单倍型网络图。结果显示,金背鲤各群体之间没有形成明显的地理结构,除都匀群体外,其余群体两两之间均有单倍型直接共享。除单倍型Hap3、Hap4、Hap6和Hap9 各自被4 个群体共享,5 个群体间没有共享单倍型(图4)。
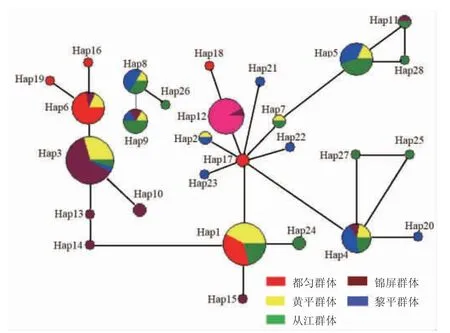
图4 基于Cyt b 序列构建单倍型网络图Fig.4 Haplotype network based on Cyt b sequence
D-loop 基因NJ 树显示(图5),金背鲤C.carpio var.Jinbei 与黄河鲤C.carpio 聚成一枝,节点布展值为76,亲缘关系最近,又与华南鲤Cyprinus rubrofuscus 与松浦镜鲤Cyprinus carpio Songpu 共同聚成一枝,节点布展值为45。
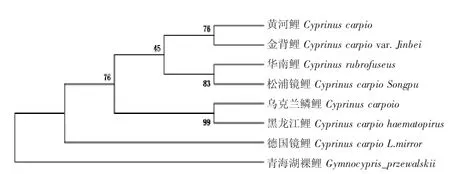
图5 基于D-loop 基因的鲤群体NJ 进化树Fig.5 NJ phylogenetic tree of Jinbei common carp Cyprinus carpio var.Jinbei population based on D-loop gene
Cyt b 基因NJ 树(图6)显示,金背鲤与华南鲤C.rubrofuscus 聚成一枝,节点布展值为87,亲缘关系最近,又与黄河鲤C.carpio 与瓯江彩鲤Cyprinus carpio var.color 共同聚成一枝,节点布展值为92。
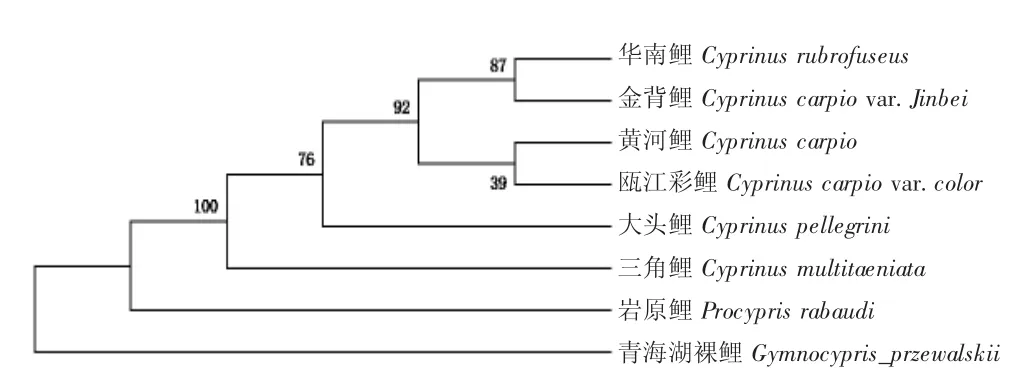
图6 基于Cyt b 基因的鲤群体NJ 进化树Fig.6 NJ phylogenetic tree of Jinbei common carp Cyprinus.carpio var.Jinbei population based on Cyt b gene
2.4 贵州省5 个金背鲤地理种群间的遗传分化
基于D-loop 序列,5 个金背鲤群体间的遗传距离在0.003~0.051 之间,其中黎平与从江群体间的遗传距离最大,为0.051;锦屏与都匀群体间的遗传距离最小,为0.003。基于Cyt b 序列5 个金背鲤群体间的遗传距离在0.003~0.006 之间,遗传距离普遍较近(表4)。
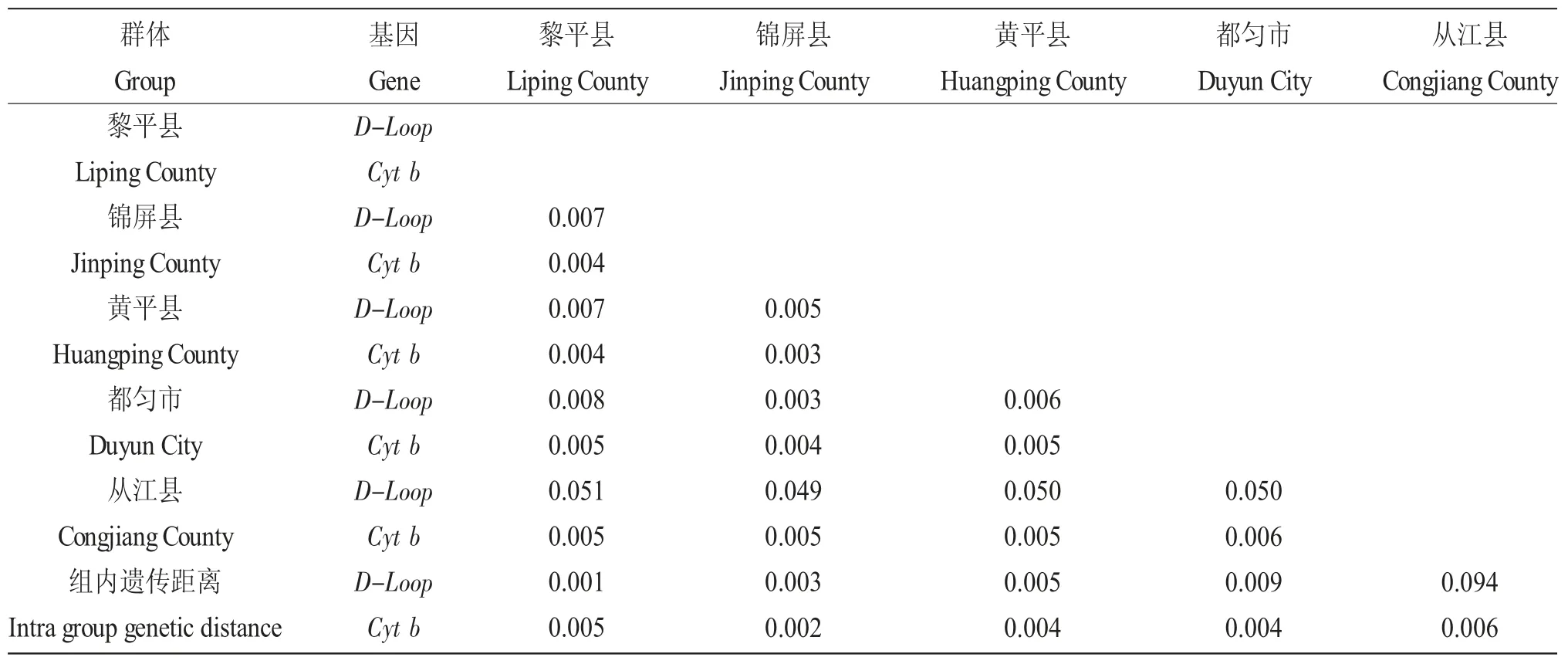
表4 基于D-Loop 和Cyt b 序列的5 个金背鲤群体间及群体内遗传距离Tab.4 Genetic distances between and within populations of Jinbei common carp Cyprinus.carpio var.Jinbei based on D-Loop and Cyt b sequences
5 个金背鲤群体间D-loop 序列的遗传分化系数Fst值在-0.00108~0.33265 之间,其中都匀群体和从江群体间的Fst值最大,为0.33265;黄平群体与黎平群体间Fst值最小,为-0.00108。锦屏和从江群体分别与其余种群达到极显著差异(P>0.001)(表5)。
5 个金背鲤群体间Cyt b 序列的遗传分化系数Fst值在-0.00565~0.2588 之间,其中都匀群体和锦屏群体间的Fst值最大,为0.2588;与D-loop 基因相同,黄平群体与黎平群体间Fst值最小,为-0.00565。除黄平与锦屏、黎平、从江群体未达到极显著差异外(P>0.001),其余群体间遗传分化均达到极显著差异(P<0.001)(表5)。
黎平群体与黄平群体D-loop、Cyt b 序列基因流(Nm)均为无限大(Inf),锦屏群体与黄平群体基因流(Nm)分别为3.888、1.970,从江群体与黄平群体基因流(Nm)分别为4.381、6.842,其余种群间基因流(Nm)均<1(表5)。

表5 五个金背鲤群体间的FST 与基因流Tab.5 The values of FST and gene flow among five populations of Jinbei common carp C.carpio var.Jinbei
AMOVA 分析结果显示,基于D-loop 序列,群体间、群体内分子变异率分别为6.87%、93.13%,分子变异主要在群体内。群体总的遗传分化系数Fst为0.06871,达到了极显著性差异(P<0.0001),说明金背鲤不同群体间发生了显著遗传变异。基于Cyt b序列,群体间、群体内分子变异率分别为13.45%、86.55%,分子变异主要在群体内。群体总的遗传分化系数Fst为0.13447,达到了极显著性差异(P<0.0001)(表6)。
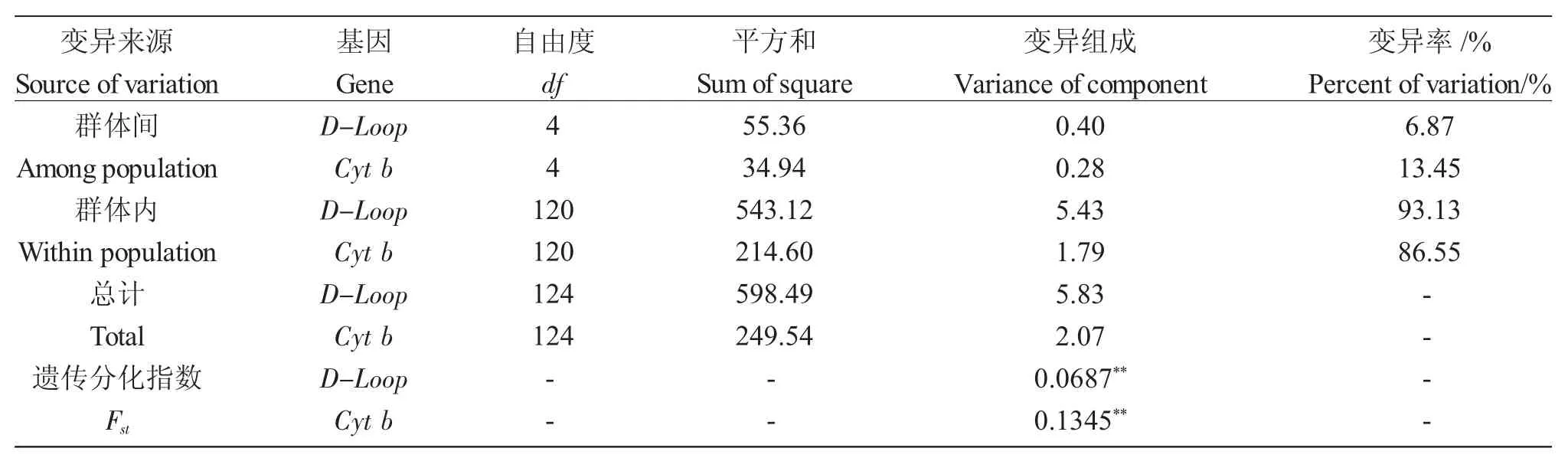
表6 基于D-loop、Cyt b 基因的分子变异方差分析Tab.6 Analysis of variance of molecular variation(AMOVA)based on D-loop and Cyt b genes
2.5 稻田金背鲤的种群历史动态
基于D-loop、Cyt b 基因,结合中性检验和核苷酸不匹配分析,对贵州省5 个稻田金背鲤群体及总体进行历史动态研究。Fu’s Fs 和Tajima’s D 检验结果显示,仅有锦屏群体、Cyt b 基因Tajima’s D 检验分别为-2.12144、-1.77969,且达到显著性差异(P<0.05),从江群体D-loop 基因Tajima’s D 检验为-2.57188,Cyt b 基因Fu’s Fs 中性检验为-3.84710,二者均达到显著性差异(P<0.05),其余均未达到显著性差异(P>0.05)。核苷酸不匹配分布图(图7)显示,基于D-loop、Cyt b 基因,5 个稻田金背鲤群体的错配分布曲线均呈现双峰或多峰型,表明5 个群体历史上均未出现种群扩张。
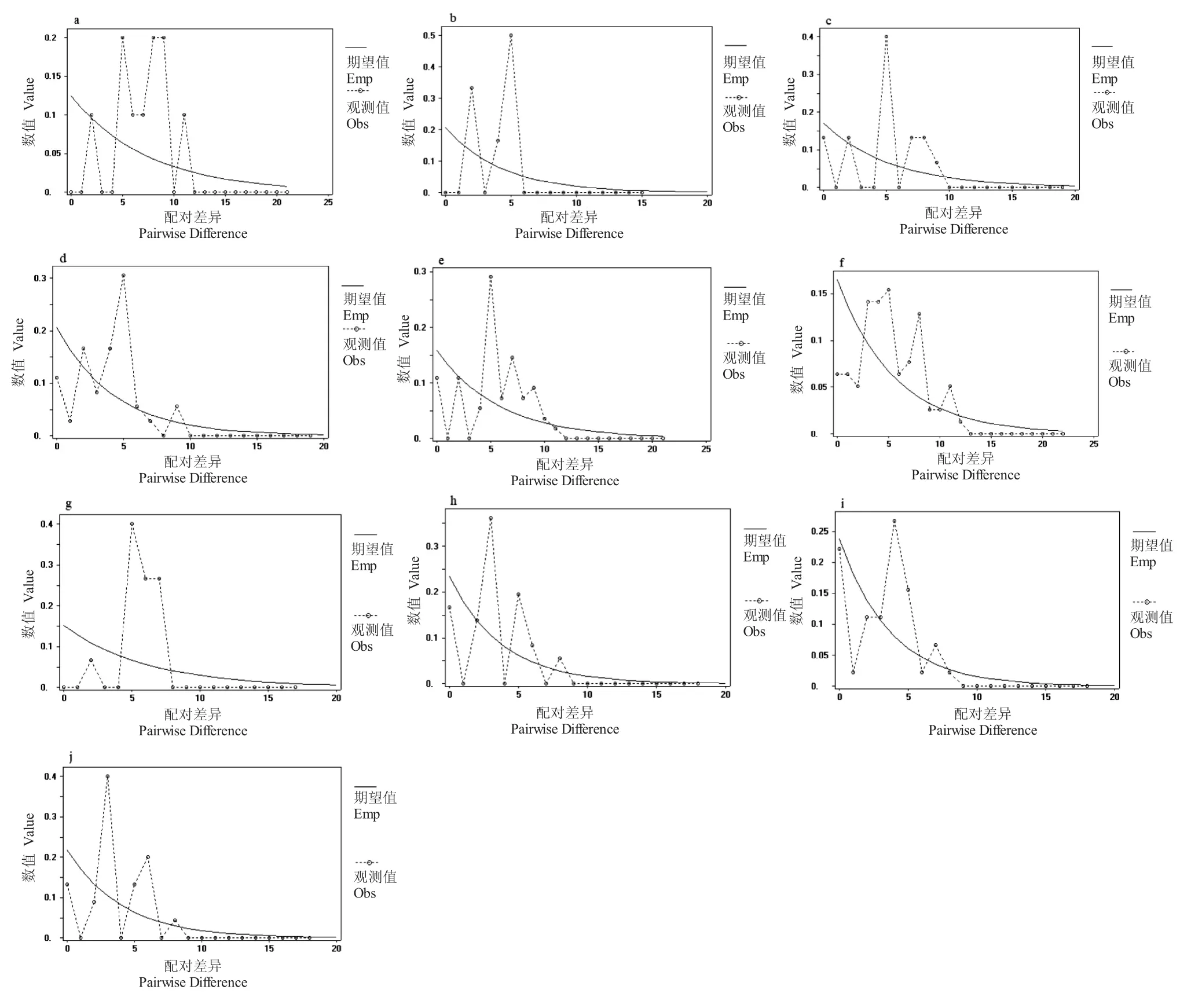
图7 基于Cyt b 和D-loop 基因的5 个地理种群核苷酸不匹配分布图Fig.7 Nucleotide mismatch distribution of five geographical populations of Jinbei common carp based on Cyt b and Dloop genes
3 讨论
3.1 贵州省稻田金背鲤D-loop、Cyt b 基因碱基特点和遗传多样性现状
3.1.1 贵州省稻田金背鲤D-loop 和Cyt b 基因碱基组成特点
金背鲤线粒体DNA D-loop 和Cyt b 基因碱基组成呈明显的反G 偏倚。金背鲤5 个地理种群线粒体DNA D-loop 基因碱基平均组成为A(32.6%)、T(33.3%)、C(19.6%)、G(14.5%);Cyt b 基因碱基平均组 成 为A(28.9%)、T(26.4%)、C(30.4%)、G(14.3%),其中G 含量明显低于其他三种碱基含量,体现了线粒体DNA 碱基反G 偏倚的特点[15]。金背鲤线粒体DNA D-loop 和Cyt b 基因(A+T)含量(65.9%、55.3%)明显大于(C+G)含量(34.1%和44.7%),体现了脊椎动物线粒体基因碱基分布不均的特点[16]。
3.1.2 贵州省5 个稻田养殖金背鲤群体的遗传多样性现状
单倍型多样性、核苷酸多样性指数是评价群体遗传多样性的两项重要指标。Was G 等[17]将单倍型多样性、核苷酸多样性以0.5、0.005 作为高低的标准,都匀、黄平群体为高单倍型多样性、低核苷酸多样性类型;锦屏群体为低单倍型多样性、低核苷酸多样性类型;黎平和从江群体为高单倍型多样性、高核苷酸多样性类型;杨博等[18]和向燕等[19]分别对青海湖裸鲤(Gymnocypris przewalskii)和浪白鱼(Anabarilius grahami)线粒体DNA 进行了遗传分析,发现所研究群体也出现高单倍型多样性、低核苷酸多样性。向燕等[20]推测,所研究的群体是由一个数量较小的有效种群扩张而成,黄平、都匀地处贵州中部偏东,两地金背鲤与外界金背鲤基因交流不多,数量较少的金背鲤群体在两地各自扩张,加上单倍型多样性较核苷酸多样性短时间内积累快,出现高单倍型多样性、低核苷酸多样性类型。本文在采样前期大量走访调查发现,从江与黎平靠近广西边界,与广西金背鲤群体基因交流较多,出现高单倍型多样性、高核苷酸多样性类型。而同为地处广西边界的锦屏,地理环境相对从江和黎平较为封闭,加上锦屏当地稻田养鱼重心主要偏向本地鱼“呆鲤”,导致遗传多样性逐年降低,出现低单倍型多样性、低核苷酸多样性类型。
3.1.3 贵州省稻田金背鲤群体整体遗传多样性现状
相比于其他鲤,基于D-loop 基因,贵州省稻田金背鲤总体单倍型多样性适中(0.672),高于河南省黄河鲤(0.572)、江苏省福瑞鲤(0.136)、黑龙江省松浦镜鲤(0.362)[21],及广西省建鲤(0.6160)[22],低于贵州省清水江鲤(0.961)、江苏省太湖鲤Cyprinus carpio Linnaeus(0.800)[21],江西省兴国红鲤Cyprinus carpio var.singuonensis(0.9050),及黑龙江鲤(0.9310)[22];核苷酸多样度较低(0.00533),低于贵州省清水江鲤(0.007)、江苏省太湖鲤(0.010)、河南省黄河鲤(0.007)、黑龙江省黑龙江鲤(0.008)[21]、广西省建鲤(0.0065),及江西省兴国红鲤(0.0067)[22],金背鲤的种质资源保护应引起重视。
3.2 贵州省稻田金背鲤5 个种群遗传分化
鱼类群体之间的遗传距离是反应群体分化程度的主要指标[23],Shaklee 等[24]提出属、种和种群三级水平上的遗传距离分别为0.9、0.3、0.05,本研究遗传距离分析结果显示,从江群体较其余群体遗传距离明显较远(表4)。Crawford 和Littlejohn[25]提出,各群体间的遗传距离越小,群体间的遗传速度就越快,相似系数就越大,表明从江群体于其余群体亲缘关系相对较远。研究结果不符合地理距离模型原则,地理距离与遗传距离呈反向相关,如黎平群体与从江群体地理距离最近,而遗传距离反而最远。吴俣学等[26]同样研究发现,地理位置较远的贵定县大鲵(Andrias dauidianus)群体和松桃县大鲵群体遗传距离较小,并推测贵州喀斯特地形对大鲵种群造成了地理隔离,大鲵种群间可能通过地下暗河进行基因交流。同理推测,可能是贵州卡斯特山区相对独立封闭的稻田环境造成了小范围地理隔离。与野生群体不同,稻田养殖鱼类之间基因交流受人为影响很大,贵州省少数民族聚集交错,形成“大聚居、小杂居”的形式,少数民族之间文化差异可能会影响稻田鱼就近引种,从而导致群体间遗传距离不符合地理距离模型。
Balloux 和Nicolas[27]曾提出了群体间遗传分化的标准:当Fst<0.05 时表示种群间无遗传分化;当0.15>Fst>0.05 时表示种群间产生了较小的遗传分化;当0.25>Fst>0.15 时表示种群间产生了中度的遗传分化;Fst>0.25 表示种群间产生了较大的遗传分化。本研究中,基于D-loop 和Cyt b 基因,从江群体与其余4 个群体均产生过较大遗传分化(Fst>0.25)。除黄平群体外,从江群体与其余3 个群体均出现基因流Nm<1 的情况,再次表明从江群体出现较大遗传分化,尤其是与黎平群体,两个种群间D-loop、Cyt b 区均出现基因流Nm<1 的情况,表明从江群体与其余群体之间基因交流少,这也就不难解释5 个群体间没有共享单倍型。基于D-loop、Cyt b 基因,黎平和黄平群体遗传分化指数均小于0.05,基因流无限大,表明两个地理种群进行了密切的基因交流,未产生遗传分化,两个群体可以看成一个群体。
NJ 邻接树(图3)和单倍型网络图(图4)均显示,金背鲤5 个群体间没有形成明显的谱系结构和地理结构。AMOVA 分析结果(表6)显示,基于Dloop、Cyt b 基因5 个金背鲤群体的遗传变异系数分别为0.0687、0.1345,群体间变异分别占6.87%、13.45%,群体内变异分别占93.13%、86.55%,几乎所有变异都发生在种群内部,表明稻田金背鲤群体间差异明显小于群体内部差异,群体间未形成较大遗传分化,再次表明群体可能是由一个数量较小的有效种群扩张而成。
D-loop、Cyt b 基因构建的NJ 树不同,D-loop基因NJ 树显示,金背鲤与黄河鲤最先聚成一枝,然后和华南鲤、松浦镜鲤聚在一起,而Cyt b 基因NJ树显示,金背鲤与华南鲤最先聚成一枝,再与黄河鲤聚在一起。同为线粒体两个基因构建的NJ 树存在差异,这与邹辉等[22]的研究类似,邹辉等推测原因可能是D-Loop 区遗传学上多样性丰富有关。两个基因构建的NJ 树表明,金背鲤与黄河鲤、华南鲤亲缘较近,与瓯江彩鲤、松浦镜鲤存在一定亲缘关系。
3.3 贵州省稻田金背鲤种群历史动态
Fu's Fs、Tajima's D 中性检验和核苷酸不匹配分布图能有效反应种群是否发生过扩张。Fu's Fs 检验倾向于反应种群近期发生的扩张,而Tajima's D 检验对种群历史扩张更为敏感[28]。通常,当Fu's Fs、Tajima's D 中性检验出现显著负值,核苷酸不匹配分布图出现单峰的时候,可以认定种群发生过扩张。本研究中,基于D-loop 和Cyt b 基因,各群体中性检验均未出现显著性负值(表3),核苷酸不匹配分布图均表现为双峰或多峰(图7),表明金背鲤群体历史上未出现过种群扩张。
3.4 稻田鱼种质资源保护
近年来,随着稻田养鱼的发展,“稻田鱼”的种质资源现状越来越受关注,如浙江省稻田青田田鱼群体遗传多样性低于野生群体[8],甘宝江等[9]研究发现,相比于野生群体,稻田鲤群体遗传多样性呈现出下降趋势。程磊等[29]研究发现,广西禾花鲤因为受到其他鲤品种杂交影响导致种质遗传渐渗。本研究基于D-loop 和Cyt b 基因,发现锦屏群体单倍型多样性和核苷酸多样性极低,处于濒危状态,此地金背鲤的保护迫在眉睫。黄平、都匀群体为高单倍型多样性、低核苷酸多样性类型,各地理群体之间总体基因交流不多,既要加强群体间基因交流,也要定向选育,避免外源鲤的基因污染。同时,因地制宜,结合各地地理环境、水文特征等因素开展合理的保护措施。为弥补线粒体DNA 评估遗传多样性的不足,未来应利用单核苷酸多样性(SNP)等分子标记技术,从核基因角度评估贵州省稻田养殖金背鲤群体遗传多样性,丰富贵州稻田金背鲤种质资源基础数据。
———从江加车村

