T细胞如何快速防御COVID-19
马心蕾,林进,陈伟钱
冠状病毒是多样化的单链RNA病毒家族,可导致地方病、流行病或大流行病。它们的严重程度存在明显的不同,轻者,出现上呼吸道感染,如普通感冒;重者,如COVID-19所致的下呼吸道感染,可出现严重致死性并发症,如成人呼吸窘迫综合征、细胞因子风暴和免疫性血栓形成。约80%以上的COVID-19感染者出现轻中度症状,甚至是无症状;其余患者可有严重的呼吸系统受累,需要住院治疗,并常出现严重并发症,需重症监护、插管,使用包括生物制剂和靶向药物在内的多种干预措施[1]。
由于COVID-19影响范围很广,因此找到决定预后的关键因素十分重要。部分影响因素,如老年人、男性、有高血压和肥胖等合并症,会导致病情更加严重。在其他影响预后的因素中,针对Ⅰ型干扰素的自身抗体与更严重的病情有关[2]。与其他病毒感染类似,对SARS-CoV- 2的免疫防御涉及先天性和适应性免疫系统、B细胞和T细胞。虽然免疫系统的细胞协同工作,但它们的作用并不同,且在疾病发展过程中可能发生变化。因此阐明这些细胞群的动态作用对于治疗、预后和预防策略非常重要。
因可能对未来的疾病发展产生影响,感染SARS-CoV- 2之前的免疫系统状态是一个非常有趣的话题。Swadling等[3]在Nature发表的一项研究显示,预先存在的病毒特异性T细胞群可能在感染早期阶段起关键作用,在特定人群中可中止新冠病毒的复制。因此,快速反应可预防感染扩散,缩短抗体产生时间。故血清阴性(seronegative,SN)可能代表宿主没有被病毒感染,也可能代表宿主对病毒感染的成功防御。
Swadling等[3]观察了在第一波感染期间的医护人员(health care workers,HCW),发现他们的病毒核酸PCR检测结果呈阴性,抗刺突蛋白1(Anti-spike-1)IgG抗体、核蛋白(nucleoprotein,NP)IgG和IgM抗体测定均为阴性。这些个体被认为是血清阴性HCW(seronegative HCW,SN-HCW)。该研究探讨了某些个体具有预先存在的记忆T细胞的可能,后者与SARS-CoV- 2蛋白交叉反应,在抗体产生之前迅速终止感染。
为描述T细胞在SN-HCW对病毒反应中的作用,研究人员通过体外酶联免疫吸收点(enzyme-linked immune absorbent spot,ELISPOT)方法分析外周血T细胞的反应。研究人员选择结构蛋白(刺突蛋白、膜蛋白、NP和ORF3a)和非结构蛋白的重叠肽作为抗原。其中非结构蛋白(non-structural protein,NSP)是细胞感染后早期转录的复制转录复合物(replication transcription complex,RTC)中的蛋白质,包括NSP7、NSP12和NSP13。对照人群包括大流行之前的队列以及已经感染病毒的队列。
研究者发现,尽管SN-HCW体内血清没有检测到抗新冠病毒抗体,但存在高反应的多种特异性记忆T细胞。SN-HCW的这些记忆T细胞数目明显高于未暴露于新冠的队列人群和大流行前期的队列人群。此外,与已感染病毒的对照组相比,SN-HCW的T细胞对RTC抗原的反应性更强,且血液中干扰素诱导性转录因子(interferon-inducible transcript 27,IFI27) mRNA表达增加(图1)。研究表明IFI27在感染新冠后表达增加[4],提示SN-SWC虽已感染新冠病毒,但不需要启动B细胞介导的免疫反应(产生抗体),就可成功防御新冠病毒。
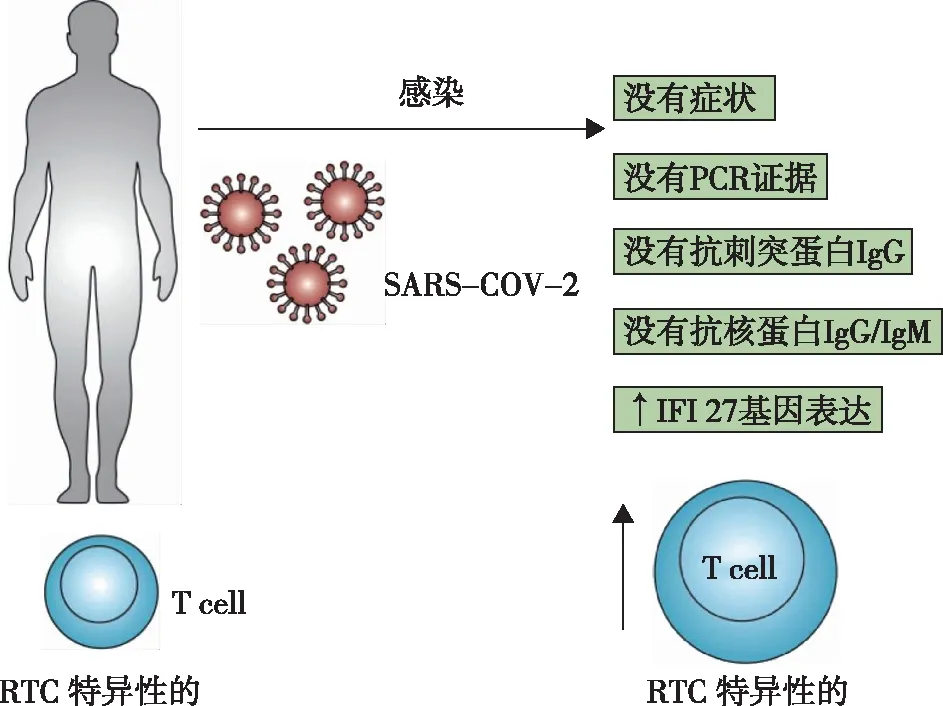
图1 感染SARS-CoV- 2后,血清阴性医护人员的免疫学发现
那些可终止感染的预先存在的T细胞起源于哪里?最可能的解释是,这些对RTC反应的T细胞先前已经感染了冠状病毒。在这种情况下,参与病毒早期复制的非结构蛋白,可能比刺突蛋白等结构蛋白表现出更大的保守性和同源性,更易诱导出交叉反应性的T细胞。冠状病毒的季节性感染非常普遍,因此有大量机会诱导出交叉反应性T细胞群,后者在SARS-CoV- 2和潜在的其他冠状病毒抗感染时发挥作用。尽管冠状病毒感染的频率非常高,但在普通人群中这些记忆T细胞并不常见,这可能与年龄密切相关。
通过研究利妥昔单抗(rituximab,RTX)治疗患者的疫苗反应,可阐明B细胞和T细胞在病毒防御中的相互作用。研究表明,RTX治疗自身免疫性疾病时,若B细胞缺乏,抗体反应会减弱[5- 7]。然而,T细胞反应受到的影响则更为复杂,这些影响可能取决于所使用的疫苗的类别和评估T细胞反应的方式。此外,T细胞的产生可能会受药物治疗的影响,以及该患者潜在的免疫紊乱的影响。尽管如此,大多数接受RTX治疗并接种疫苗的患者仍可产生可检测的T细胞反应。在某些患者中,即使没有可测量的体液反应,也可发生T细胞反应。
从流行病学角度看,上述结果表明PCR和抗体检测并不能检测到病毒感染,正如上文所示,受感染的个体可能缺乏这些感染的生物标志物。然而,通过T细胞反应性确定感染,比抗体检测更复杂,需要大型多肽阵列才能充分覆盖任何蛋白质上的潜在抗原位点。同样,IFI27测定是基于外周血细胞PCR测定,需要额外检测[4]。为避免假阳性结果,还需要进一步确定是哪种病毒感染导致IFI27表达升高。
研究结果也与疫苗的设计高度相关。目前的疫苗专注于结构蛋白,如刺突蛋白。这些疫苗可诱导抗体产生,阻止病毒吸附和侵入细胞。这类通过诱导抗体反应起效的疫苗接种(以及感染),其局限性在于它的持续时间,目前可通过注射加强针解决。尽管目前的疫苗也能诱导T细胞[8],但针对RTC的疫苗将涉及完全不同的机制:诱导的T细胞不阻止病毒侵入细胞;而是针对受感染的细胞,在病毒复制前杀死后者。通过诱导T细胞产生这些保守性的RTC蛋白而起效的疫苗可能具有更广泛的适用性,同时能预防如SARS、MERS和COVID-19,及可能导致大流行的任何变异型病毒。此外,此类疫苗可用于RTX治疗的患者,对提升风湿免疫科医生的认知具有重要意义。
疫苗新靶点的探索总是伴随着安全问题。鉴于当前疫苗的有效性,不仅需要检测T细胞靶向疫苗的有效性,还需检测其安全性。最近对接触SARS-CoV- 2家庭接触者的一项研究表明,因接触其他冠状病毒而预先存在的交叉反应性T细胞,与防止感染后PCR阳性具有高度相关性。有趣的是,在这项研究中,非刺突蛋白引发了T细胞反应,这进一步表明在未来的疫苗中加入非刺突抗原的重要性。然而,随着时间的推移和人群感染风险的降低,证明此类疫苗的功效可能会变得具有挑战性。未来可深入研究SARS-CoV- 2感染者不致病的机制[9]。

