细粒棘球蚴囊液抑制脂多糖诱导的巨噬细胞炎症反应
蔺珂,孟瑾,贺飞明,廖原,吴向未,陈雪玲,侯隽*
(1 石河子大学医学院免疫学教研室,新疆 石河子 832002;2 石河子大学医学院第一附属医院肝胆外科,新疆 石河子 832008)
囊性棘球蚴病(Cystic echinococcosis, CE)是一种家畜和人类因食用感染的细粒棘球绦虫(Echinococcusgranlosus) 虫卵而引起的疾病[1-2]。该病是一种慢性、复杂,且容易忽视的人畜共患传染病,呈世界性的分布,对人类生命健康和财产安全构成巨大威胁[3]。目前包虫病仍然是世界许多地区发病率和死亡率的主要原因,消除是很难做到的[4]。因此,探讨细粒棘球蚴与宿主在感染早期的相互作用,对于开发棘球蚴病的新型免疫疗法具有重要意义。
细粒棘球蚴感染宿主后通过有效的免疫逃避机制在宿主体内长期生存[5]。除了纤维囊肿的物理屏障外,囊肿液中的抗原成分也参与了应对宿主免疫应答的逃逸[6-7]。近年来,人们对棘球蚴调节宿主免疫应答的机制进行了广泛的研究[8]。研究报道,细粒棘球蚴囊液(Echinococcusgranulosuscyst fluid,EgCF)中的糖分子可干扰TLR4介导的DCs活化,包括CD80、CD86、NF-κB和p38 MAPK信号的下调,以及下游炎症因子的表达[9]。同时,EgCF可促进T淋巴细胞向Treg细胞分化,诱导TGF-β分泌,进而损害NK细胞的效应功能[10]。此外,EgCF调节CD4+/CD8+的转换率,促进免疫抑制CD4+CD25+ T细胞的百分率和Treg细胞特异性蛋白Foxp3的增加,起到免疫逃避的作用[11]。然而,针对EgCF如何调节巨噬细胞炎症反应的作用研究很少。
巨噬细胞是固有免疫反应应对寄生虫感染的主要组成部分[12-13]。研究发现JAK-STAT信号通路是多种细胞因子调节巨噬细胞表型及活性的主要通路之一[14]。其中IL-10可以与巨噬细胞表面的IL-10受体结合后激活JAK1,后者通过磷酸化将STAT3分子铆定其上,促进STAT3分子的磷酸化[15]。越来越多的证据表明IL-10/STAT3通过拮抗巨噬细胞和树突状细胞的活性而表现出强大的免疫抑制作用[16]。例如,弓形虫能通过诱导巨噬细胞STAT3有效抑制LPS诱导的IL-12和TNF-α的表达[17]。
基于以上背景,我们猜测STAT3是否参与调控细粒棘球蚴感染巨噬细胞后的免疫调控。因此,我们利用LPS诱导小鼠巨噬细胞构建炎症模型,同时加入囊液刺激细胞,检测炎症因子和STAT3的表达。本研究发现囊液通过IL-10/STAT3信号通路参与调控囊液介导的炎症作用,抑制脂多糖诱导巨噬细胞TNF-α的释放。
1 材料与方法
1.1 材料
RAW264.7细胞购自中国科学院上海生科院细胞资源中心;胎牛血清、DMEM培养基购自美国Gibco公司;二甲基亚砜 (DMSO) 和脂多糖 (Lipopolysaccharides, LPS ) 购自美国Sigma公司;总RNA提取试剂盒购自美国Omega公司;逆转录试剂盒购自美国Thermo Scientific公司,荧光染料(TB Green Premix Ex Taq II)购自日本TaKaRa公司;实时荧光定量 RT-PCR仪(Bio-Rad 生物工程公司);STAT3抗体(#68153)和p-STAT3(Tyr705)抗体(#76315)购自美国Abcam公司,β-actin抗体购自中国中山金桥生物有限公司;STAT3抑制剂S3I-201购自美国Selleck公司;PVDF膜购自美国Millipore公司;SDS-PAGE试剂盒和RIPA蛋白裂解液购自北京索莱宝生物公司、ECL发光液购自美国Thermo公司。
1.2 方法
1.2.1 RAW264.7细胞培养
将RAW264.7细胞置于37 ℃、5% CO2培养箱中培养。取生长对数期的细胞接种于6孔细胞培养板内(1.0×106个·mL-1)备用;分为四组:Control组,EgCF(终浓度2.15 mg·mL-1)组,LPS(终浓度1 μg·mL-1)组,LPS +EgCF共刺激组。
1.2.2 小鼠腹腔巨噬细胞的提取及培养
6~8周的C57BL/6小鼠,取细胞前三天,每天向小鼠腹腔注射0.5~1 mL淀粉肉汤。首先取小鼠眼眶血,后将小鼠颈椎脱臼处死。75%酒精浸泡3 min,倒立小鼠,置小鼠于解剖台上,固定四肢。用镊子将小鼠小腹皮肤提起,切小口,撕裂皮肤,使腹膜完全暴露。然后用5 mL注射器将预冷的培养基注入腹腔中,同时从两侧用手指揉压腹膜壁5 min,令液体在腹腔内充分流动。用针头轻轻挑起腹壁,使小鼠微倾向于一侧,至腹腔中液体集于针头下吸入注射器内。小心拔出针头,将液体注入15 mL离心管中。2 000 r·min-1,5 min离心(若有红细胞,可使用红细胞裂解液),弃上清,10%FBS培养基重悬细胞。细胞计数,并接种在6孔板中,每孔1.0×106个·mL-1,分组同RAW264.7。5% CO2,37 ℃温箱培养过夜后,PBS洗去未贴壁细胞,贴壁细胞即为纯度较高的原代巨噬细胞[18]。
1.2.3 细粒棘球蚴囊液的提取
将感染细粒棘球蚴的羊肝放至干净的盆中,以清水冲洗干净,洗去血渍、组织液及其他脏污。用75%的酒精喷洗羊肝、注射器以及操作平台等。其次观察整个羊肝的囊泡情况,选择单个、大、无结节的囊泡作为抽取对象。用50 mL的无菌注射器抽取囊泡中的囊液和原头蚴混合液放入高压过的玻璃瓶内,所抽取的囊液以清亮透明最佳。收集静置后上层混合液,1 000 g、4 ℃离心10 min。所得上清通过0.22 μm过滤器过滤,最后用核酸蛋白测定仪检测囊液(不同羊肝囊液的混合物)的蛋白浓度,再分装至高压过的无菌1.5 mL Ep管中,并保存在-80 ℃的冰箱中以备后续使用[10]。
1.2.4 目的及内参引物设计
在Genbank中查询TNF-α、IL-6、IL-10和内参β-actin的相应基因序列,应用引物序列比对:BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行分析,并由生物公司合成,引物序列见表1。
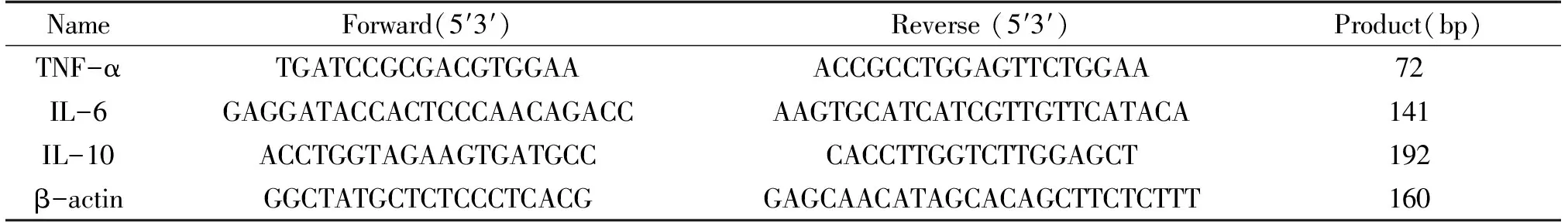
表1 引物序列
1.2.5 实时荧光定量PCR检测TNF-α、 IL-6和IL-10的表达
按照Omega试剂盒说明提取巨噬细胞总RNA。按逆转录试剂盒说明书将RNA进行逆转录合成cDNA(逆转录时根据RNA浓度调节加入的体积,保证每组加入的总RNA含量一致)。采用TB Green Premix Ex Taq II荧光定量PCR试剂在CFX96荧光定量PCR仪上进行反应以检测目的基因的mRNA相对表达量。使用的qRT-PCR的反应体系(20 μL): TB Green Premix Ex Taq II为10 μL,上下游引物共1.6 μL,cDNA 为2 μL,无酶水6.4 μL。反应程序: 95 ℃ 预变性10 min,95 ℃ 变性15 s,60 ℃ 退火延伸 1 min,共38~40个循环。以β-actin做内参,运行结束后查看结果进行计算分析,采用相对定量即2-△△Ct得到因子的相对表达量,记录并整理结果及作图,分析统计学意义。
1.2.6 Western 免疫印迹
收集各组细胞,加入裂解液,冰上裂解15 min(检测蛋白的磷酸化水平时,细胞裂解液需再加蛋白磷酸酶抑制剂)。将细胞裂解液收集于1.5 mL无菌Ep管,将裂解液离心,12 000 r·min-1,10 min,上清即为所需蛋白。60 V恒压电流分离蛋白,80 V恒压,转膜1.5 h。5%BSA封闭液室温封闭2 h,一抗4 ℃孵育过夜,TBST洗膜3次×5 min;二抗室温孵育1 h,TBST洗膜3次×5 min;用显影液进行显色反应,凝胶成像仪扫描拍照。用ImageJ分析条带的灰度值,以β-actin为内参,计算目的蛋白相对表达。
1.3 统计学分析
实验数据用GraphPad Prism 8.0进行计算和分析。使用One-way ANOVA检验进行组间差异的统计分析。*P<0.05 **P< 0.01, ***P< 0.001被认为差异有统计学意义。
2 结果
2.1 细粒棘球蚴囊液抑制LPS诱导RAW264.7细胞IL-6与TNF-α的生成
研究证实LPS能引起免疫细胞炎症因子的表达增加[19]。qRT-PCR技术检测RAW264.7细胞中的TNF-α和 IL-6的表达。结果显示1 μg·mL-1LPS 刺激RAW264.7细胞5 h后,IL-6 和TNF-α的表达明显增加。而加入囊液后可有效抑制RAW264.7细胞产生这两类炎症因子,且与LPS组相比具有显著差异性(图1)。
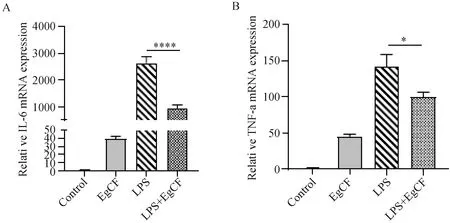
A:实时定量PCR检测IL-6 mRNA表达;B:实时定量PCR检测TNF-α mRNA表达。图1 囊液抑制LPS诱导RAW264.7细胞IL-6和TNF-α的生成
2.2 细粒棘球蚴囊液促进RAW264.7细胞IL-10的产生
IL-10是体内重要的炎症抑制因子,通过抑制TNF等促炎细胞因子的产生,从而抑制炎症反应[20]。为了检测EgCF是否通过IL-10抑制 RAW264.7细胞的炎症反应,我们利用qRT-PCR技术检测各组细胞中IL-10的表达。结果显示,与LPS单独处理组相比,LPS+EgCF组中IL-10的表达明显增加(图2)。即EgCF可促进LPS刺激RAW264.7细胞中IL-10的合成,提示IL-10可能是EgCF诱导RAW264.7细胞炎症反应的重要调控因子。
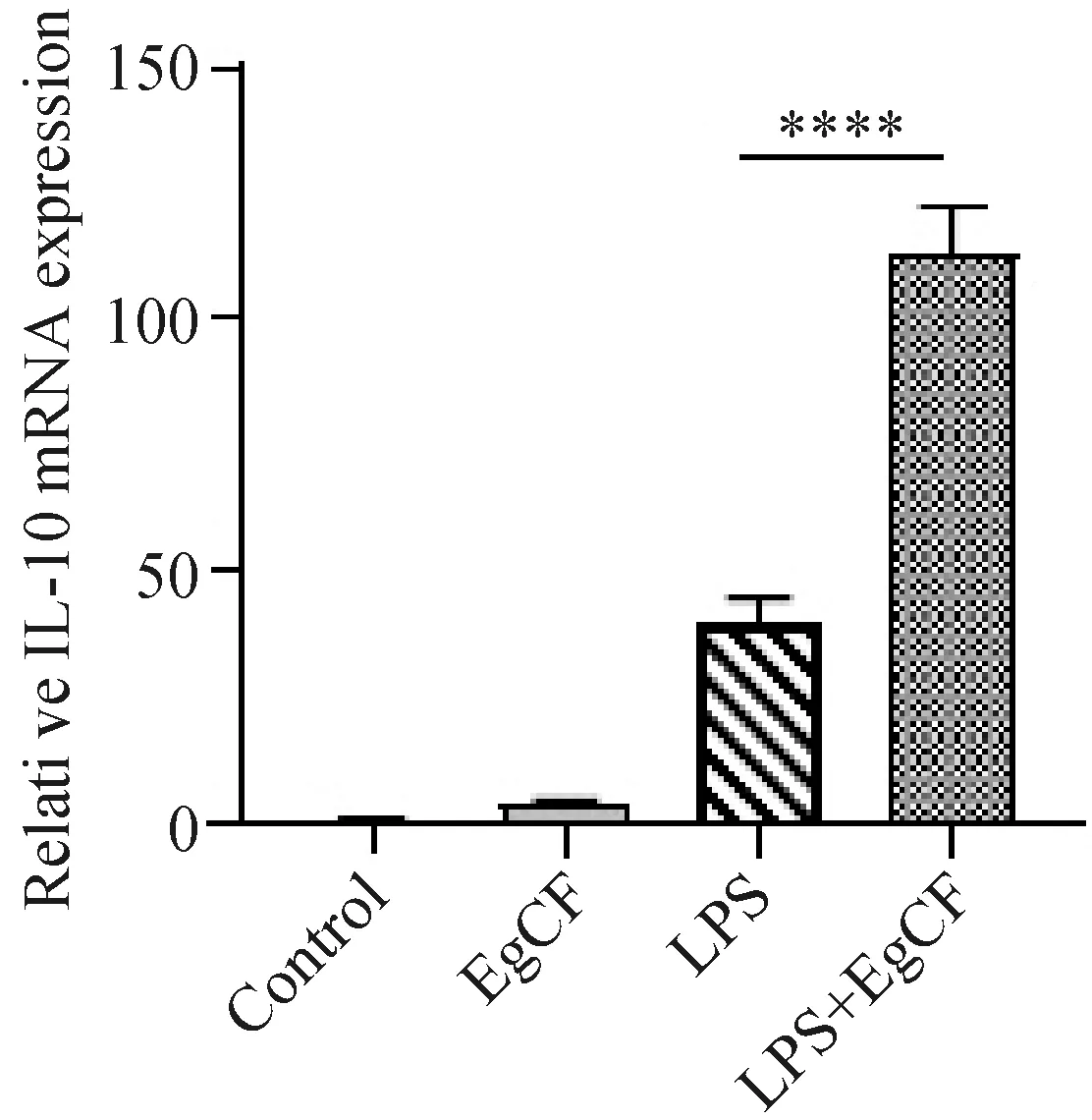
实时定量PCR检测IL-10 mRNA表达。图2 囊液促进LPS诱导RAW264.7细胞IL-10的生成
2.3 细粒棘球蚴囊液抑制LPS诱导小鼠腹腔巨噬细胞的炎症反应
为了进一步验证EgCF对小鼠腹腔巨噬细胞的抑炎作用,我们分别用EgCF和LPS处理细胞。结果显示,LPS可诱导IL-6水平升高,而EgCF和LPS共刺激可降低IL-6的表达(图3A)。然而,IL-10 mRNA水平较LPS组明显升高(图3B)。这些结果证实EgCF通过抑制LPS诱导的小鼠巨噬细胞中炎症介质的产生发挥抑炎作用。
2.4 细粒棘球蚴囊液促进RAW264.7细胞p-STAT3(Tyr705)蛋白表达
IL-10分子与细胞表面受体结合,激活下游的STAT3信号,该信号通过705酪氨酸位点磷酸化激活并发挥作用[21]。
为了检测EgCF刺激RAW264.7细胞后STAT3的变化情况,我们利用Western免疫印迹实验检测各组的STAT3和p-STAT3(Tyr705)蛋白的表达。图4显示,各组STAT3总蛋白表达量没有发生明显改变, 而LPS+EgCF组p-STAT3(Tyr705)蛋白的表达明显增加。结果表明,EgCF通过促进STAT3分子磷酸化激活STAT3信号通路。
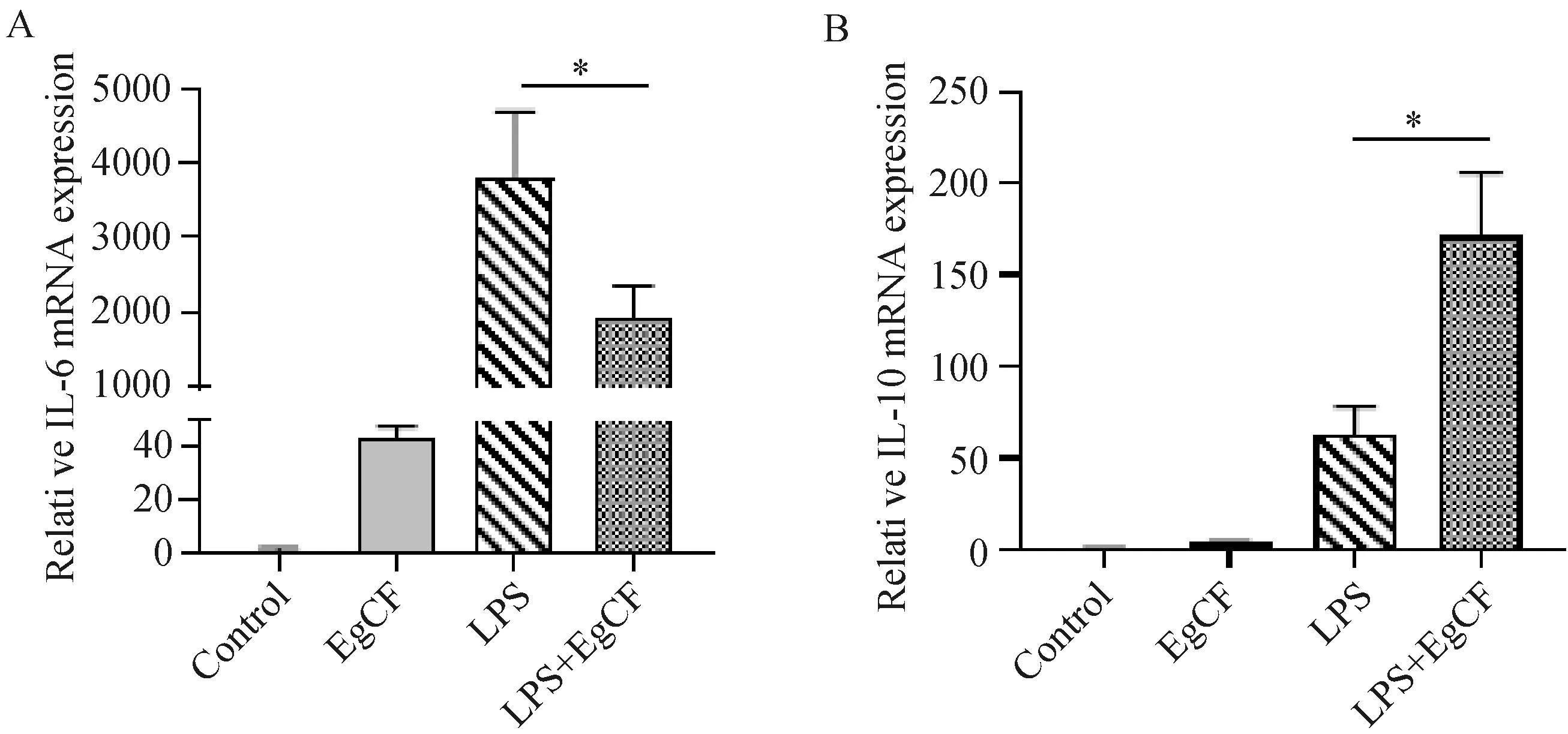
A:实时定量PCR检测IL-6 mRNA表达;B:实时定量PCR检测IL-10 mRNA表达。图3 囊液抑制LPS诱导腹腔巨噬细胞IL-6和促进IL-10的生成
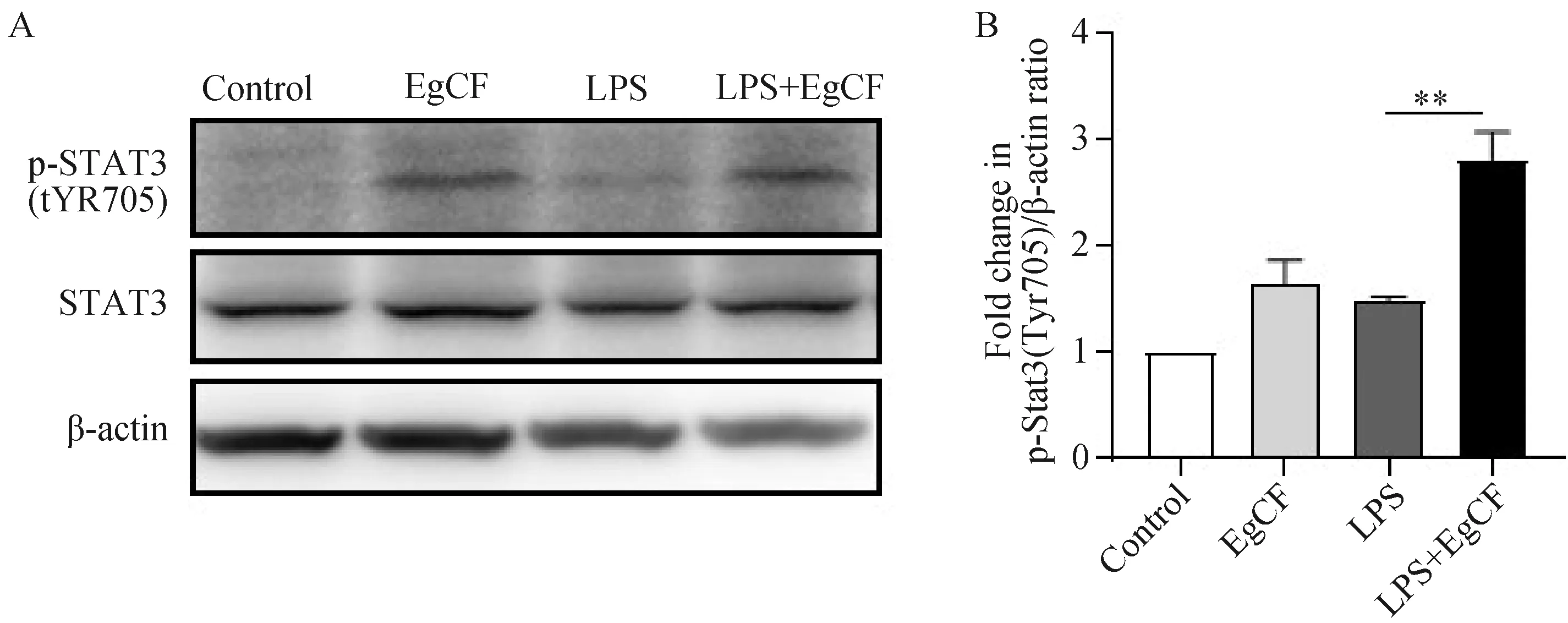
A:Western blot法检测STAT3蛋白磷酸化和非磷酸化表达水平;B:p-STAT3蛋白表达水平的半定量分析。图4 囊液促进RAW264.7细胞p-STAT3(Tyr705)分子表达
2.5 STAT3信号通路参与细粒棘球蚴囊液介导的炎症抑制作用
为了进一步确定STAT3信号通路是否参与囊液的抑炎作用,我们利用STAT3抑制剂S3I-201处理RAW264.7细胞,检测炎症因子的释放。使用30 μmol/L的S3I-201处理细胞后,发现STAT3总蛋白没有明显变化,但S3I-201能够有效抑制p-STAT3(Tyr705)的分子表达(图5A)。同时与LPS+EgCF组相比,LPS+EgCF+S3I-201组的p-STAT3(Tyr705)的蛋白表达也发生了明显下降,且具有显著的统计学意义(图5B)。证明S3I-201可抑制LPS+EgCF组中STAT3的磷酸化。我们在此基础上检测了各组细胞中TNF-α和IL-6的合成,结果显示,抑制STAT3磷酸化后,LPS+EgCF+S3I-201组中TNF-α的表达明显高于LPS+EgCF组(图5C),即囊液的炎症抑制作用消失,但是S3I-201并没有影响IL-6的表达(图5 D)。结果表明,STAT3信号通路参与囊液对LPS诱导细胞炎症的部分抑制作用。
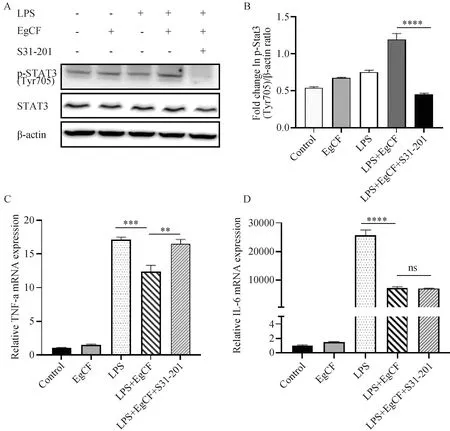
A:Western blot法检测STAT3蛋白磷酸化和非磷酸化表达水平;B:p-STAT3蛋白表达水平的半定量分析;C:实时定量PCR检测TNF-α mRNA表达;D:实时定量PCR检测IL-6 mRNA表达。图5 STAT3信号通路参与了EgCF介导的抑炎作用
3 讨论
细粒棘球绦虫具有复杂的防御机制,保护其不受抗寄生虫免疫反应的影响,因此逃避了宿主的免疫效应得以在宿主体内寄生[22]。所以对于细粒棘球蚴感染的发病机制的研究具有重要意义。据报道,一些抑制性分子可调节宿主的固有免疫和适应性免疫反应,寄生虫必须与这些分子积极相互作用以减少宿主反应的影响[23]。在本文中,我们发现细粒棘球蚴囊液通过促进IL-10调节STAT3,抑制巨噬细胞炎症因子TNF-α的释放。
巨噬细胞是炎症过程中的关键细胞,能够促进和消除炎症,清除凋亡细胞,调节急性炎症反应和慢性病理变化[24-25]。TLR介导的信号通路在免疫应答中起着关键作用。在LPS刺激后,TLR4触发多种下游通路,如NF-κB和MAPKs,随后激活TNF-α、IL-12和IL-6等细胞因子的产生[26]。在本研究中,我们利用RAW264.7细胞和小鼠腹腔巨噬细胞为研究对象,探究这两种不同的巨噬细胞在EgCF调节炎症反应过程中的作用。结果发现在RAW264.7细胞中,促炎因子(TNF-α和IL-6)在LPS刺激后显著增加,LPS被认为是炎症过程的生物标志物[19,27]。而当加入囊液后会抑制LPS诱导的促炎细胞因子的产生,即TNF-α和IL-6表达降低。囊液抑制炎症的这种现象同样也出现在小鼠腹腔巨噬细胞中。与我们的研究结果一致的是,多房棘球绦虫囊液也能够抑制LPS诱导的PBMC释放IL-12和TNF-α[28],并且肥头绦虫的分泌物能抑制LPS诱导的TNF-α和IL-12的表达[29]。
STAT家族是机体重要的调控分子,其激活能诱发IFN-r、TNF-α等重要因子的释放[30]。STAT3信号在慢性疾病过程中的作用一直是研究热点。IL-10是一种抗炎细胞因子,在控制免疫反应方面起着至关重要的作用[31]。IL-10/STAT3信号级联是一个参与调控炎症介质的主要途径[32-33],STAT3已被证明是IL-10作用的关键效应分子,它的激活对IL-10调节的抗炎作用是必要的,在这个过程中IL-10与STAT3分子激活之间存在正反馈机制[30]。在本研究中,我们发现LPS+EgCF组中IL-10的表达与STAT3的活化程度与LPS组相比较显著增加。最重要的是,EgCF抑制LPS诱导的炎症反应的能力高度依赖于STAT3的表达。当S3I-201抑制STAT3分子磷酸化后,囊液对TNF-α的抑制作用消失,但对IL-6没有产生影响。这些结果提示IL-10/STAT3信号通路可能参与囊液对LPS诱导细胞炎症的部分抑制作用。相似的文献报道,在脓毒症大鼠中,抑制JAK/STAT途径可明显下调组织TNF-α的表达,表明JAK/STAT信号通路参与TNF-α表达的调控过程[34]。
综上所述,细粒棘球蚴囊液可能通过促进RAW264.7细胞中IL-10与STAT3磷酸化,抑制LPS诱导的TNF-α的表达。这些结果将帮助我们进一步了解细粒棘球蚴抑制宿主的免疫杀伤,产生免疫逃逸的机制。然而细粒棘球蚴囊液中哪些成分具有抑制巨噬细胞的功能,需要进一步的研究。

