肿块本身超声特征联合病理表现在预测乳腺浸润性导管癌前哨淋巴结转移中的价值
汪向前,许华宁,马云飞,蔡 婷,董维露,吴意赟
前哨淋巴结(sentinel lymph node,SLN)转移是浸润性导管癌最早和最常见的转移方式,同时也是最主要发生转移的途径,不仅关系临床诊疗决策,而且影响疗效和生存质量[1,2]。既往研究大多围绕SLN自身的超声表现来预测,但其准确度和灵敏度仍存在较大差异[3,4]。而笔者研究主要从浸润性导管癌原发灶本身的超声特征及临床病理多参数来预测,筛选归纳更多用以预测SLN转移的观察指标。
1 资料与方法
1.1临床资料
选择2018年9月至2021年1月在南京中医药大学附属医院经手术病理诊断证实为乳腺浸润性导管癌的女性患者72例(72个病灶),年龄30~85岁,平均年龄52.9岁(标准差11.4岁);病灶最大直径0.90~5.40 cm,平均直径2.09 cm(标准差0.97 cm)。此次研究通过南京中医药大学附属医院医学伦理委员会审批。
选择标准:①术前未行新辅助化学治疗;②行癌肿根治术及同侧SLN清扫术;③手术病理诊断证实为浸润性导管癌,且为单发;④均获得患者及其家属知情同意。
排除标准:①妊娠或哺乳期妇女;②已接受过治疗的或已有明确病理诊断结果的乳腺病灶。
1.2方法
1.2.1 二维常规超声检查
采用荷兰飞利浦公司生产的iU22型彩色多普勒超声诊断仪,12-5线阵探头,探头频率5~12 MHz,用以常规检查。患者常规取仰卧位,双侧手臂外展,充分暴露乳腺外侧部分和腋窝,放射状和反放射状联合横切、纵切扫查,扫查面积足够大,扫查断面有交叉,选定浸润性导管癌肿块最大径线所在切面为标准切面,且肿块完全显示,详细记录其位置、形态、最大径、内部结构、晕征、纵横比、微钙化等指标,彩色多普勒血流分级在肿块血液供应最丰富切面上获取[5]。
1.2.2 超声造影检查
采用荷兰飞利浦公司生产的iU22型彩色多普勒超声诊断仪,9-3线阵探头,探头频率3~9 MHz,用以超声造影。所使用超声造影剂声诺维为意大利博莱科公司生产。先选取超声造影观察切面,切面中应包含部分或全部乳腺肿块,预留足够正常乳腺腺体组织用以对比观察,同时需避开粗大钙化及显著液化部分,聚焦范围调至最小并移至肿块后方,调机械指数为0.07。制备并充分振荡声诺维混悬液,经肘部静脉团注3.0 mL混悬液,尾以5.0 mL 0.9%氯化钠溶液冲管,同时开启录像,记录并保存动态影像时间>2 min。分析并记录增强时间、增强强度、增强缺损、造影前后病灶最大径差值、“蟹足”征或血管扭曲征等5个超声造影参数。
1.2.3 临床病理检查
记录病灶的病理组织学分级、Ki-67指标2个参数。
病理组织学分级参照Nottingham分级系统[6],主要由形态学特征决定,包括腺管形成的程度、细胞核的多形性和核分裂计数,分别对每个参数赋分,具体评分规则:①腺管形成的程度,占肿瘤成分多数(>75%)计1分,中等数量(10%~75%)计2分,少或无(<10%)计3分;②细胞核的多形性,细胞核小、形态规则一致计1分,细胞核中等大小、不规则、大小不一计2分,细胞核大,形态多样计3分;③核分裂计数取决于光学显微镜下视野范围计1~3分。根据评分规则将每项评分相加,总分为3~5分,组织学分级为Ⅰ级;6~7分,组织学分级为Ⅱ级;8~9分,组织学分级为Ⅲ级。乳腺癌的组织学等级越高,代表其恶性程度越高,预后越差。
Ki-67的评分体系一般是基于肿瘤细胞核着色的百分比。St.Gallen早期乳腺癌国际专家达成共识,提出将14%作为Ki-67阳性指数高低的界限值[7]。当Ki-67阳性细胞数<14%时为低表达,≥14%为高表达。
1.2.4 病例分组
以病理诊断为检查金标准,进行分组,即SLN转移状态分为淋巴结转移组和无淋巴结转移组。
1.2.5 观察指标
观察指标主要有位置(非内上象限、内上象限)、形态(规则、不规则)、最大径(≤1.5 cm、>1.5 cm)、内部结构(囊实性、实性)、晕征(有、无)、纵横比(>1、≤1)、微钙化(有、无)、彩色多普勒血流分级(0~Ⅰ级、Ⅱ~Ⅲ级)、增强时间(慢进、同进、快进)、增强强度(低增强、等增强)、增强缺损(有、无)、造影前后病灶最大径差值(<0.75 cm、≥0.75 cm)、“蟹足”征或血管扭曲征(有、无)、病理组织学分级(Ⅰ级、Ⅱ~Ⅲ级)、Ki-67指标(<14%、≥14%)。
1.3 统计学方法
采用SPSS 21.0统计学软件。所有二维常规超声及超声造影指标采用χ2检验,行单因素分析,采用Logistic回归对单因素分析中有统计学意义的指标行多因素分析,获得独立危险因素,并构建预测SLN转移的回归方程,绘制受试者工作特性(receiver operating characteristic,ROC)曲线,分析其诊断效能。
2 结果
2.1 分组结果
根据SLN转移状态分为淋巴结转移组26例和无淋巴结转移组46例。
2.2 单因素分析结果
72例乳腺浸润性导管癌患者,单因素经过χ2检验显示选定的二维常规超声、超声造影和临床病理检查共15个参数中位置、最大径、微钙化、血流分级、增强时间、造影前后病灶最大径差值及病理组织分级等7项参数与浸润性导管癌SLN转移相关(P<0.05)。见表1。
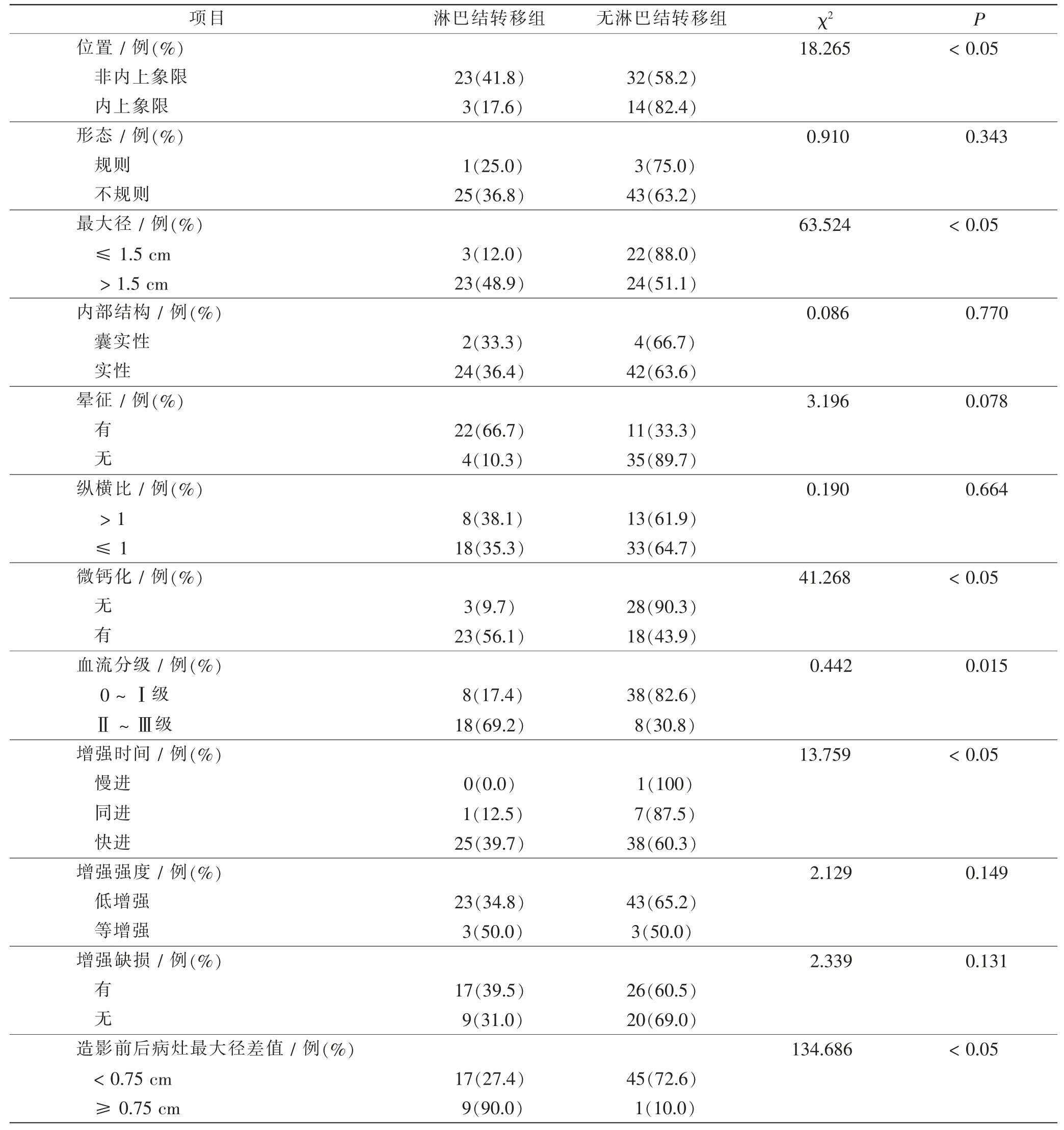
表1 浸润性导管癌SLN转移单因素分析结果Tab.1 Univariate analysis results of SLN metastasis in invasive ductal carcinoma
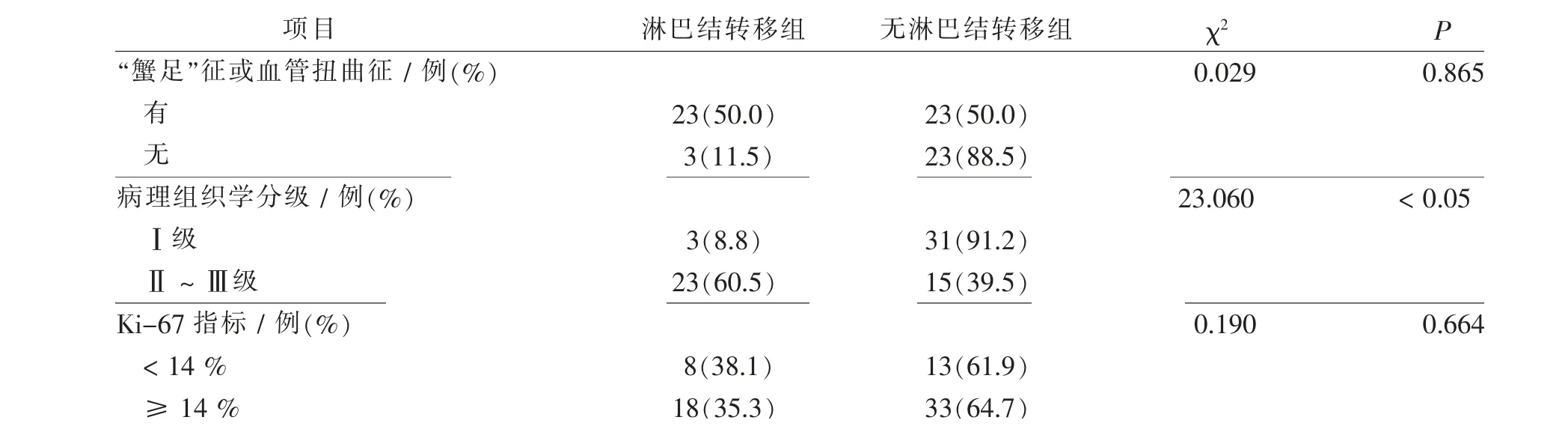
续表1浸润性导管癌SLN转移单因素分析结果Tab.1(Continued)Univariate analysis results of SLN metastasis in invasive ductal carcinoma
2.3 多因素Logistic回归分析
对单因素分析认为有统计学意义的参数进行多因素Logistic回归分析显示,微钙化、“蟹足”征或血管扭曲征、病理组织学分级、最大径及造影前后病灶最大径差值5个参数为SLN转移的高危因素。见表2、图1~3。

表2 浸润性导管癌SLN转移多因素Logistic回归模型Tab.2 Multifactor Logistic regression model of SLN metastasis in invasive ductal carcinoma

图1 乳腺肿块内微钙化预测SLN转移Fig.1 Images of microcalcification in breast mass predicting SLN metastasis

图2 乳腺肿块造影前后最大径差值预测SLN转移Fig.2 Images of maximum diameter difference value before and after contrast-enhanced ultrasound predicting SLN metastasis
2.4 绘制受试者工作特性曲线
绘制多参数综合预测能力的ROC曲线,曲线下面积为0.865。ROC曲线分析显示,多参数综合评估乳腺浸润性导管癌SLN转移有一定的临床参考价值。见图4。
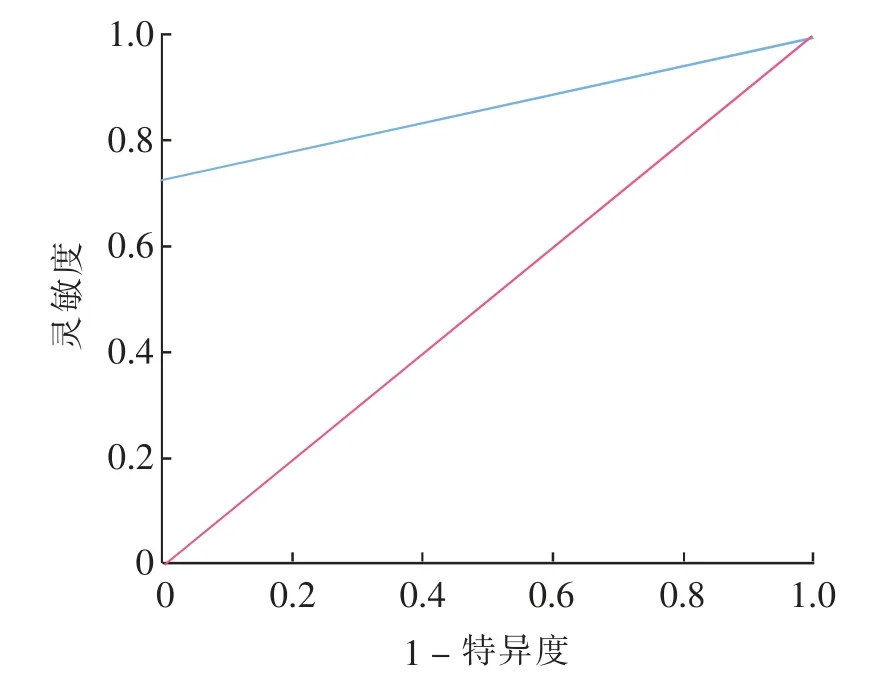
图4 乳腺肿块的多参数综合预测模型ROC曲线Fig.4 ROC curve of multiparameter prediction model for breast mass
3 讨论
腋窝淋巴转移是浸润性导管癌最早、最为常见的转移途径。腋窝淋巴结状态直接关系到术后生存率及生存质量,而腋窝淋巴结清扫术会导致一系列严重的并发症,如患侧腋窝疼痛、积液,患肢水肿、活动受限等,因此术前SLN状态评估至关重要。超声以其操作简便、无创、无辐射、价廉等优势作为首先影像学评估手段,既往研究也表明超声及其新技术对乳腺良恶性病变有较好的诊断效能[8~10],但SLN状态的评估可靠性还尚存争议[11,12]。浸润性导管癌肿块本身侵袭浸润能力和淋巴系统免疫应答是发生SLN是否转移的决定性因素,故评估SLN转移也应考虑肿块本身的超声声像特征。笔者通过分析肿块本身超声特征及联合病理诊断来进一步提高预测SLN转移风险的能力,对减少淋巴结清扫及其并发症具有重要临床意义。
笔者以浸润性导管癌肿块本身的二维常规超声、超声造影的声像特征及临床病理诊断为研究重点,预测SLN的性质,发现肿块本身的位置、最大径、微钙化、血流分级、增强时间、造影前后病灶最大径差值及病理组织分级等7项参数与SLN转移相关,而其中微钙化、“蟹足”征或血管扭曲征、病理组织学分级、最大径和造影前后病灶最大径差值等5个参数是SLN转移的独立危险因素。
乳腺肿块内≤1 mm的强回声称为微钙化。已有研究证实,乳腺恶性肿瘤细胞常表现为退行性改变,肿瘤因生长过快,生长所需能量不能得到充分供给,继而肿瘤细胞发生缺血、缺氧,导致细胞营养不良,并坏死、凋亡,结局产物发生堆积,因此形成微钙化[13]。Cox RF等[14]认为乳腺肿瘤细胞自身在某些特定条件下可转化为具有间质成分的成骨细胞特性表型细胞,以此促进微钙化形成[15]。乳腺肿块内的钙化成分主要包含羟基磷灰石和草酸钙,且认为前者与乳腺恶性肿块有相关性。杨丽等[16]认为微钙化多见于年龄大、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)过表达的患者中,对于伴有沿导管分布的微钙化的浸润性导管癌患者SLN转移可能性更大。笔者试验数据中,超声未发现微钙化的浸润性导管癌患者中有9.68%SLN发生转移,而发现有微钙化的浸润性导管癌患者SLN出现转移的占56.10%。单因素分析结果示,根据有无微钙化分组其SLN发生转移阳性率差异具有统计学意义(P<0.05)。经多因素分析显示乳腺肿块内出现微钙化是浸润性导管癌患者发生SLN转移的危险因素(OR=30.745,P<0.05),存在微钙化最终进入Logistic回归预测模型。这表明微钙化是判断浸润性导管癌患者SLN转移的一项具有重要参考意义的指标。分析原因可能与肿瘤细胞坏死后产生矿物质化及肿瘤细胞上皮细胞物质代谢紊乱相关,微钙化在一定程度上能够反映出乳腺组织受侵袭的严重程度。
乳腺肿块超声造影增强模式中的“蟹足”征或血管扭曲征是公认的乳腺癌典型的超声造影增强模式之一。在笔者研究中,共有46例出现该超声造影征象,占总病例数的63.89%,淋巴结转移组中有23例出现“蟹足”征或血管扭曲征,无淋巴结转移组中23例无该征象,其灵敏度及阴性预测值均为88.46%。说明其对SLN转移具有很好的预测作用,成为腋窝SLN转移的独立危险因素,这与Osanai T等[17]和罗丽芳等[18]研究结果较为一致。
乳腺恶性肿块本身的大小在一定程度上也能反映病变的侵袭能力。肿块本身越大,其侵袭能力越强,周边正常腺体被累及的范围越广,癌细胞接触淋巴管和沿着淋巴管扩散的机会就大大增加,从而导致SLN转移风险增加。在笔者研究中,单因素分析结果显示肿块本身最大径>1.5 cm的SLN转移阳性率明显高于最大径≤1.5 cm,且二者之间差异具有统计学意义,这与Aitken E等[19]研究报道一致。然而与既往研究不同的是,笔者研究在原发肿块大小的基础上分析了超声造影前后病灶最大径差值与SLN转移之间的相关性。经单因素和多因素分析,超声造影前后病灶最大径差值>0.75 cm为SLN转移的独立危险因素。超声造影后肿块范围扩大程度越大,表明肿瘤细胞向肿块边缘包括正常腺体、脂肪结缔组织等过渡浸润扩散的能力就越大,在一定意义上,差值可反映乳腺恶性肿瘤的浸润能力,同时表明超声造影较二维常规超声更能体现肿瘤实际大小[20]。因此,在既往超声评估指标的基础上,差值作为一项新的评估指标被纳入到多参数评估中,能够为SLN转移提供新的评估思路。
病理组织学分级代表着肿瘤细胞分化程度,分级越高,其分化程度越低,侵袭浸润能力越强,淋巴系统更易受侵,进而更容易发生SLN转移。笔者研究也证实了这一规律,病理组织学分级是SLN转移的独立危险因素,SLN转移阳性率在组织学Ⅱ~Ⅲ级者中高于Ⅰ级,与罗海愉等[21]研究结果一致。
笔者研究具有一定的局限性,首先研究的样本量仍较少,其次评估参数中未纳入其他超声新技术指标及腋窝淋巴结自身的超声特征。在今后的工作中,将进一步扩大样本量,更深入的研究能反映乳腺肿块硬度信息的弹性成像、能获取冠状面反映乳腺肿块边缘特征如汇聚征的乳腺自动全容积成像技术和腋窝淋巴结自身特征等多参数对SLN转移的预测作用。
微钙化、“蟹足”征或血管扭曲征、病理组织学分级、最大直径及造影前后病灶最大径差值等独立危险因素所构建的预测模型ROC曲线下面积为0.865。说明结合浸润性导管癌的临床病理特征、肿块本身的二维常规超声及超声造影特征所构建的回归模型能够很好地预测SLN转移,具有一定的临床应用价值。

