桑叶多糖结构特征及其对α-葡萄糖苷酶活性的抑制作用
胡润锋,李浚哲,李鹏飞,周军,李湘洲*
(1.中南林业科技大学材料科学与工程学院,长沙 410004;2.广西民族大学,广西林产化学与工程重点实验室,南宁 530006;3.广西民族大学,广西林产化学与工程协同创新中心,南宁 530006)
糖尿病是一种需要终身治疗的慢性代谢疾病,有研究表明糖尿病为新型冠状病毒肺炎的第二大并发症,且糖尿病患者感染新冠的风险更高,感染后病情更严重[1]。因此,在新冠肺炎疫情蔓延全球的当下,糖尿病的治疗显得尤为重要。α-葡萄糖苷酶可快速降解碳水化合物,导致血糖水平升高[2]。目前许多药物都是通过抑制α-葡萄糖苷酶活性来实现降糖效果。然而这些药物存在肝损伤、肠胃不适等副作用[3],因此科研人员开始专注于从天然产物中筛选α-葡萄糖苷酶抑制剂,研究出新颖、安全、副作用少的治疗药物。
桑叶含有多种活性成分,如多糖、黄酮、甾体类、生物碱等[4]。多糖作为桑叶的主要活性成分之一,具有降血糖、抗氧化、调节免疫、抗炎等生物活性[5]。此外,有研究表明氧化应激与糖尿病之间存在着密切的联系[6]。因此,同时具有强抗氧化活性和降血糖活性的桑叶多糖有望成为糖尿病的首要候选药物。近几年,国内外有诸多学者做过桑叶多糖抑制α-葡萄糖苷酶活性的研究,崔汉钊等[7]利用分级醇沉法得到不同的桑叶多糖组分,结果表明在低浓度醇沉得到的多糖组分对α-葡萄糖苷酶表现出更好的抑制效果。罗晶洁等[8]从桑叶多糖中分离纯化得到两种不同多糖组分均对α-葡萄糖苷酶活性起到较好的抑制效果。
然而,目前国内外的研究仅仅局限于桑叶多糖对α-葡萄糖苷酶的抑制效果上,而对其抑制动力学和抑制类型方面却鲜有报道。此外,多糖的组成、分子量、结构对多糖的生物活性均有很大的影响。基于此,笔者利用离子交换柱层析分离纯化得到不同的多糖组分,并对不同多糖组分的结构、分子量、单糖组成进行了探究,最后深入研究桑叶多糖对α-葡萄糖苷酶的抑制效果、抑制动力学及其抑制类型。研究结果可为桑叶中多糖资源的开发和利用提供理论依据。
1 材料与方法
1.1 试验材料
干桑叶,产自湖南永州,采摘于2019年10月,常温晒干;DEAE-52纤维素、葡聚糖系列(分子质量为3 000~2×106u)、α-葡萄糖苷酶、阿卡波糖,上海源叶生物科技有限公司;对硝基苯-α-D-吡喃葡萄糖苷(PNPG),上海蓝季生物有限公司。
1.2 试验方法
1.2.1 桑叶多糖的提取
将桑叶粉碎后烘干,称取一定量的桑叶粉,按照固液比1∶20(g∶mL)加入乙醇,80 ℃回流2 h后过滤,滤渣60 ℃烘干得到脱脂桑叶粉。称取一定量脱脂桑叶粉,按照1∶20(g∶mL)的固液比加入去离子水,80 ℃回流提取2 h,离心取上清液。依次用聚酰胺树脂和S-8大孔树脂动态吸附法去除提取液中蛋白和色素,浓缩后加入4倍体积的乙醇,5 ℃下静置24 h后过滤,沉淀依次分别用乙醇、丙酮、乙醚洗涤3次,冷冻干燥得到桑叶多糖(MLP)并计算得率,见公式(1)。
多糖得率=(m1/m0)×100%
(1)
式中:m1为多糖质量,g;m0为桑叶粉质量,g。
1.2.2 DEAE-52纤维素柱层析
取一定量的MLP用蒸馏水复溶,用DEAE-52纤维素(40 cm×4 cm)柱层析,依次用0,0.1,0.3和0.5 mol/L的NaCl溶液洗脱,自动收集器收集,流速3.0 mL/min,每管5 mL。用苯酚-硫酸法跟踪检测各管吸光值,绘制洗脱曲线。根据洗脱曲线合并各组分并浓缩,用蒸馏水流动透析72 h(3 500 u),冷冻干燥,将得到的产品分别命名为MLP-1、MLP-2、MLP-3、MLP-4,并用公式(1)计算得率。
1.2.3 多糖含量的测定
采用苯酚-硫酸法测定桑叶多糖的糖含量[9]。以葡萄糖质量浓度(C)为横坐标,吸光度(A)为纵坐标,绘制标准曲线。配制一定质量浓度的桑叶多糖溶液,按照上述方法测得吸光值代入标准曲线并计算糖含量。
1.2.4 桑叶多糖分子量的测定
采用凝胶色谱法(GPC)测定桑叶多糖的各组分的纯度及其分子量[10](Agilent 1200)。色谱条件:SB-804HQ(8.0 mm×300 mm)柱,示差折光器,柱温25 ℃,流动相为0.1 mol/L的NaCl溶液,流速0.6 mL/min,进样20 μL。根据凝胶色谱图上的峰面积和出峰数判断多糖的纯度,通过出峰时间计算多糖分子量。
1.2.5 桑叶多糖单糖组成的测定
采用气相色谱法(GC)测定桑叶多糖的单糖组成[11](Agilent GC7890)。色谱条件:HP-5色谱柱,氮气,FID检测器。升温程序:初始温度为160 ℃,保持3 min;3 ℃/min升至190 ℃;1 ℃/min升至200 ℃,保持2 min;2 ℃/min升至210 ℃,保持15 min;进样口温度250 ℃,分流比5∶1,进样量1 μL;检测器300 ℃。
对多糖进行水解和乙酰化处理,根据保留时间和峰面积对多糖的水解产物进行定性与定量分析。
1.2.6 红外光谱分析
利用KBr压片法对多糖样品进行压片制样,经傅里叶变换红外光谱仪(ALPHA II,布鲁克公司)扫描,频率64 Hz,32次,范围400~4 000 cm-1。
1.2.7 桑叶多糖对α-葡萄糖苷酶抑制作用分析
采用PNPG法测定桑叶多糖抑制α-葡萄糖苷酶的活性[12]。向96孔板中依次加入0.1 mol/L 磷酸盐缓冲液(PSB,pH为6.8)、样品和0.4 U/mL的α-葡萄糖苷酶溶液,置于酶标仪中37 ℃孵育10 min,之后加入5 mmol/L的PNPG溶液50 μL,37 ℃孵育45 min,再加入0.2 mol/L Na2CO3溶液50 μL以终止反应,置于酶标仪(ThermoFisher Multiskan GO)405 nm下检测吸光值,以阿卡波糖作为阳性对照。反应体系见表1,对α-葡萄糖苷酶的抑制率计算方法见公式(2)。

表1 反应体系Table 1 Reaction system 单位:μL
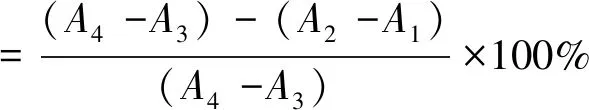
(2)
式中:A1、A2、A3、A4分别为按照反应体系表1反应后得到的吸光度值。
1.2.8 桑叶多糖对α-葡萄糖苷酶的抑制类型分析
根据参考文献[13]的方法并稍微改变:固定底物浓度为5 mmol/L,分别设置不同浓度的酶溶液(0.05,0.10,0.20,0.40和0.60 U/mL)和样品溶液(0,0.01,0.05和0.10 mg/mL),按照表1的反应体系进行试验,反应过程中读数间隔30 s/次。以反应初速度V0为纵坐标,酶浓度E为横坐标绘制点图并线性拟合,根据拟合直线的相交和平行情况及直线的斜率变化情况,探究桑叶多糖对α-葡萄糖苷酶抑制的可逆性。
1.2.9 桑叶多糖对α-葡萄糖苷酶抑制动力学分析
根据参考文献[13]的方法并稍微改变:固定酶浓度为0.4 U/mL,分别设置不同浓度的底物溶液(0.25,0.50,1.00,3.00和5.00 mmol/L)和样品溶液(0,0.01,0.05和0.10 mg/mL),按照表1的反应体系进行试验,反应过程中读数间隔30 s/次。采用Lineweaver-Burk双倒数方程作图法,以反应初速度的倒数1/V0对底物浓度的倒数1/S绘制点图并线性拟合,由纵轴截距可计算出最大反应速率Vm的值,再根据米氏方程计算出米氏常数Km,由Km和Vm的变化趋势确定酪氨酸酶的抑制类型。
1.2.10 数据处理与分析
试验数据用3次独立重复试验结果的平均值±标准差表示,采用Origin 9.1绘图。采用SPSS 18.0 软件进行单因素方差分析。
2 结果与分析
2.1 桑叶多糖的提取分离纯化结果
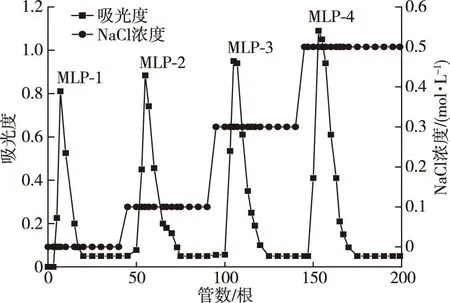
图1 MLP的DEAE-52纤维素洗脱曲线图Fig.1 Elution curves of MLP on DEAE-52 cellulose column
经过乙醇脱脂、热水浸提、除蛋白和色素、浓缩醇沉、冻干后得到MLP,其得率为8.54%,糖含量为45.87%。MLP的DEAE-52纤维素柱层析洗脱曲线见图1。MLP经柱层析后得到4个组分,其中以水为洗脱液得到的中性多糖为MLP-1,以0.1,0.3和0.5 mol/L的NaCl溶液洗脱得到的酸性多糖分别为MLP-2、MLP-3、MLP-4。MLP-1、MLP-2、MLP-3、MLP-4的糖含量分别为88.46%,78.18%,69.42% 和67.35%,得率分别为0.25%,0.65%,1.43% 和1.78%。随着洗脱液离子强度的增加,4个组分的得率依次上升,但糖含量逐渐下降,可能是随着NaCl浓度的提高,有部分色素和小分子物质液也被洗脱,造成多糖纯度下降[14]。
2.2 桑叶多糖的分子质量
凝胶色谱(GPC)法检测桑叶多糖各组分的分子质量,结果见图2。由图2可知,桑叶多糖4个组分都含有2个或2个以上的峰,这表明经DEAE-52纤维素纯化后的多糖组分还含少量杂质。其中4个组分的主要多糖组分的分子质量分别为6.14,8.08,10.25和2 017.55 ku。多糖分子质量的大小与张晓[10]的研究结果相似。

图2 桑叶多糖各组分的GPC图谱Fig.2 GPC chromatogram of mulberry leaf polysaccharide components
2.3 桑叶多糖的单糖组成
将不同质量浓度的单糖混标溶液进行乙酰衍生化后分别进样检测,结果见图3a。由图3a可知,6种单糖可以有效地分离,峰1至峰6依次为鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖,出峰时间依次为26.152,27.015,27.746,39.742,40.641和42.573 min。将桑叶多糖各组分溶液进行乙酰衍生化后分别进样检测,结果见图3b~e。将多糖样品的GC谱图与单糖混标的GC谱图对比确定样品的单糖组成,采用面积归一法计算单糖组成摩尔百分比,结果见表2。桑叶多糖各组分均由以上6种单糖组成,不同的组分单糖组成的物质的量比情况不同,其中MLP-3、MLP-4组分存在部分杂峰,原因可能是在DEAE-52纤维素柱层析过程中,高浓度的NaCl溶液洗脱下部分色素和小分子物质。
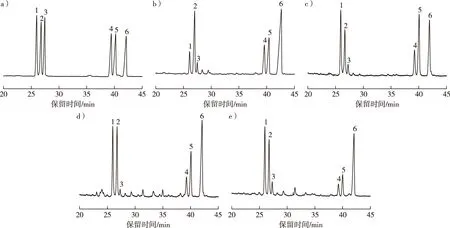
a)单糖混标;b)MLP-1;c)MLP-2;d)MLP-3;e)MLP-4。图3 单糖混标乙酰化产物和桑叶多糖各组分乙酰化产物的GC图谱Fig.3 GC chromatogram of acetylated derivative of standard monosaccharides
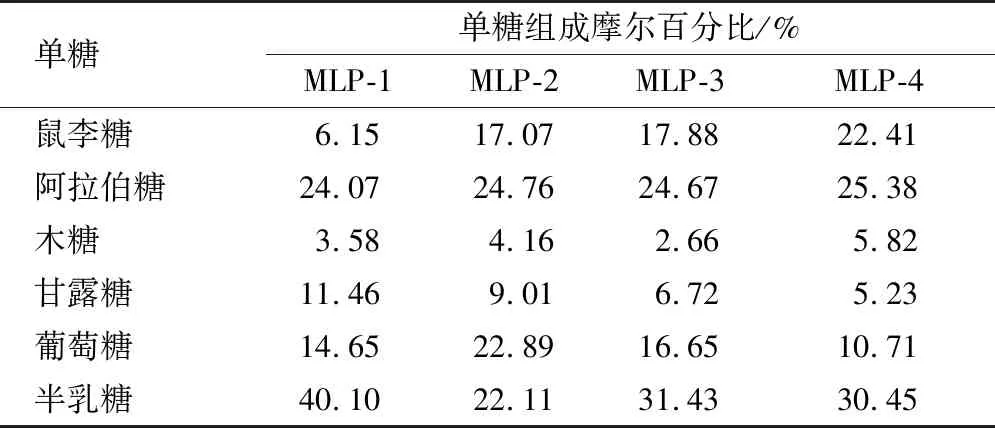
表2 桑叶多糖各组分的单糖组成Table 2 Monosaccharide compositions of mulberry leaf polysaccharide components
结果表明,桑叶多糖主要由鼠李糖、阿拉伯糖、葡萄糖和半乳糖组成,而木糖和甘露糖含量比较少。中性多糖组分MLP-1主要由半乳糖和阿拉伯糖组成,鼠李糖含量较少,而酸性多糖组分MLP-2、MLP-3、MLP-4中鼠李糖含量明显高于中性多糖,且鼠李糖的含量随着洗脱剂浓度的增加而增加,均与汪叶青[15]的研究结果高度类似。但也有研究表明,从桑叶粗多糖中分离出的中性多糖组分鼠李糖含量比较高,可能和提取分离方法及桑叶产地不同有关[16]。此外,本研究中的所有多糖组分均未检测出半乳糖醛酸和糖醛酸。这可能和醇沉的浓度相关,有研究报道,在低浓度乙醇沉淀下,糖醛酸含量比较高,而随着乙醇浓度的增加,糖醛酸的含量逐渐减少,当醇含量超过80%时,醇沉得到的多糖中几乎不含糖醛酸[17]。
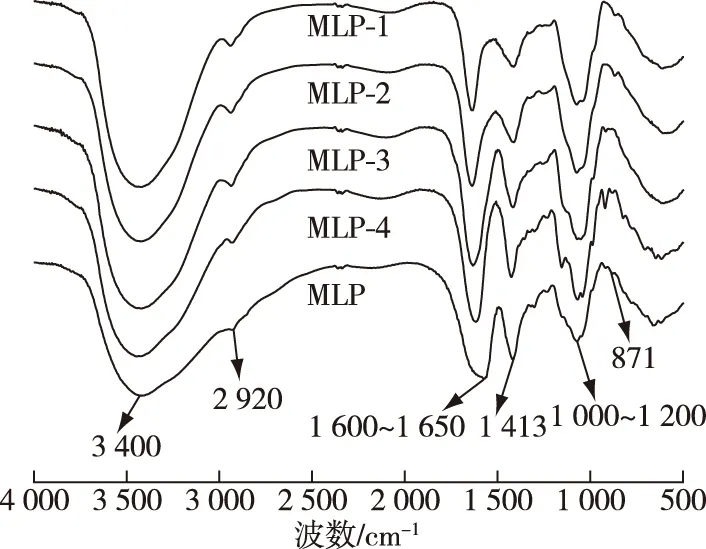
图4 桑叶多糖各组分的红外光谱图Fig.4 IR spectroscopy analysis of mulberry leaf polysaccharide components
2.4 桑叶多糖的红外光谱

2.5 桑叶多糖对α-葡萄糖苷酶的抑制作用
桑叶多糖各组分对α-葡萄糖苷酶的抑制作用见图5。由图5可知,在桑叶多糖的4种纯化组分中,仅MLP-1表现出明显的抑制作用,且在0~5 mg/mL的质量浓度范围内,呈现出良好的剂量-效应关系,IC50值为0.503 8 mg/mL。而MLP-2、MLP-3、MLP-4在质量浓度为0~5 mg/mL的范围内,对α-葡萄糖苷酶的抑制率均为0,说明酸性多糖对α-葡萄糖苷酶没有抑制作用。造成这种差异的原因可能在于多糖所带电荷、单糖组成等因素,MLP-1为经水洗脱得到的中性多糖,而其他3个为氯化钠溶液洗脱得到的酸性多糖;此外,还可能是因为中性多糖含有较少的色素和其他杂质,纯度更高,因此抑制效果显著。而未经DEAE-52纤维素柱分离纯化的MLP,含有少量的MLP-1组分,使其对α-葡萄糖苷酶表现出微弱的抑制作用。
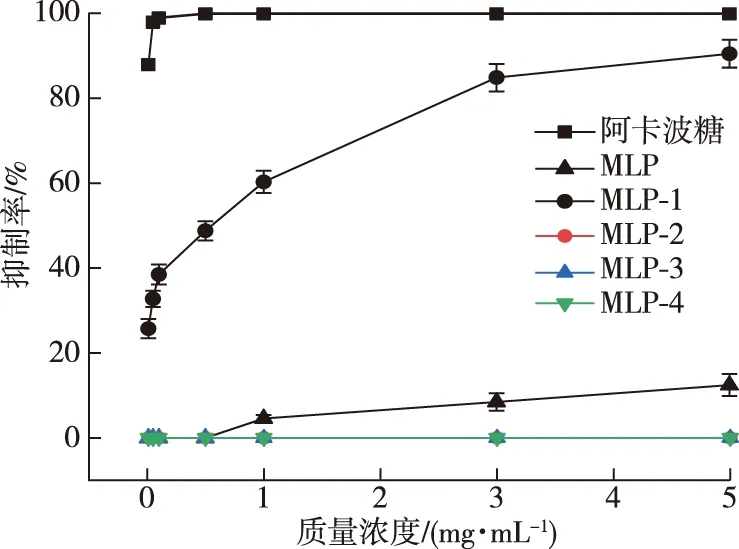
图5 桑叶多糖各组分对α-葡萄糖苷酶抑制作用Fig.5 Inhibitory effect of mulberry leaf polysaccharide components on α-glucosidase
2.6 桑叶多糖MLP-1组分对α-葡萄糖苷酶的抑制类型
建立不同浓度α-葡萄糖苷酶在不同浓度MLP-1反应下与反应初速度的关系,结果见图6。由图6可知,酶浓度与反应速率具有良好线性关系,均经过原点,添加MLP-1的直线斜率小于未加MLP-1直线斜率,且随浓度逐渐增大,直线斜率逐渐减小,这属于可逆性抑制的典型特征[13]。表明MLP-1的添加,并未增加或减少酶的浓度,而是通过降低酶活性使其分解底物浓度降低。因此,可判断MLP-1对α-葡萄糖苷酶的抑制作用属于可逆抑制类型。
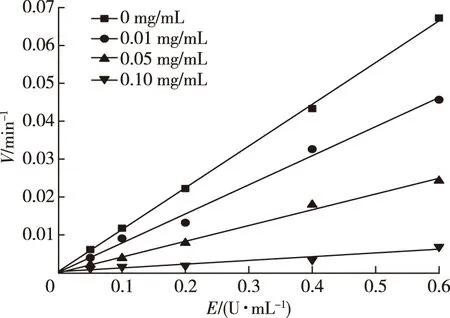
图6 MLP-1对α-葡萄糖苷酶抑制机理Fig.6 Inhibition kinetics of MLP-1 on α-glucosidase
2.7 桑叶多糖对α-葡萄糖苷酶的可逆抑制动力学
通过固定α-葡萄糖苷酶浓度,改变MLP-1与PNPG的浓度,绘出Lineweaver-Burk双倒数曲线,结果见图7,通过计算得到表3。不同浓度抑制剂的拟合曲线与空白组相交于轴,最大反应速率Vm随着样品浓度的增加逐渐降低,米氏常数Km为1.394 1 mmol/L,具有非竞争型抑制的典型特征,说明MLP-1与α-葡萄糖苷酶的非活性部位相结合,形成“MLP-1-酶”的络合物后会进一步与PNPG结合,MLP-1和PNPG分别独立地与酶的不同部位相结合,PNPG浓度的改变对抑制程度无影响[22-23]。

图7 MLP-1对α-葡萄糖苷酶抑制作用的Lineweaver-Burk 双倒数图Fig.7 Lineweaver-Burk double reciprocal graph of the inhibitory effect of MLP-1 on α-glucosidase
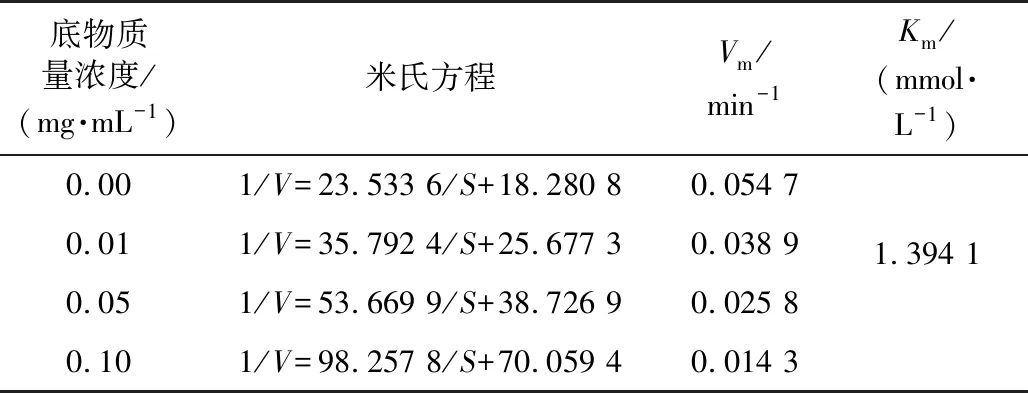
表3 MLP-1抑制α-葡萄糖苷酶动力学参数Table 3 Inhibition kinetic parameters of MLP-1 on α-glucosidase
3 结 论
采用水提醇沉法制备得到桑叶多糖(MLP),进一步用离子交换柱层析分离纯化得到4个桑叶多糖组分(MLP-1、MLP-2、MLP-3和MLP-4),对其分子质量、单糖组成和基础结构进行了分析,并深入研究了桑叶多糖对α-葡萄糖苷酶的抑制作用及抑制动力学,得出以下结论:
1)4个多糖组分(MLP-1、MLP-2、MLP-3和MLP-4)的分子质量依次为6.14,8.08,10.25和2 017.55 ku;4个多糖组分均由6种单糖包括鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖组成,但具有不同的单糖物质的量比;4个多糖组分具有典型的多糖特征吸收峰,含有吡喃糖环结构。
2)4个多糖组分中仅MLP-1 对α-葡萄糖苷酶有明显的抑制作用,IC50值为0.503 8 mg/mL,而其他3个多糖组分(MLP-2、MLP-3和MLP-4)对α-葡萄糖苷酶的抑制率均为0。MLP-1对α-葡萄糖苷酶活性的抑制作用类型属于可逆抑制,MLP-1和PNPG分别独立地与酶的不同部位相结合,PNPG浓度的改变对抑制程度无影响。
通过对桑叶多糖中抑制α-葡萄糖苷酶活性的有效成分进行深入探究,将有助于明晰其药效成分及作用机制,为桑叶多糖的开发利用提供理论依据。

