典型国家和地区罕见病用药保障模式比较及启示
李乐乐 何晓彤 陈湘妤 李怡璇
(中国人民大学劳动人事学院 北京 100872)
1 引言
罕见病又称孤儿病,指发病率极低、患病人数极少的一类疾病,是与常见病、多发病相对的概念[1,2]。目前,关于罕见病的定义在国际上尚未达成一致意见。世界卫生组织认为,罕见病是指患病人数占总人口0.65‰—1‰的疾病与病变。美国则认为罕见病是指每年患病人数小于20 万的疾病。欧盟对罕见病的定义是指患病率低于0.5‰,严重危及生命、渐进性疾病或慢性疾病,且针对性药物难以从无保护的市场销售中收回成本,目前无令人满意的疗效与替代疗法的疾病[3]。《中国罕见病定义研究报告2021》在2010 年中华医学会医学遗传学分会的定义基础上进一步将罕见病的定义扩展为以下三点:一是新生儿发病率小于1/10000 的病种;二是患病率小于1/10000 的病种;三是患病人数小于14 万的病种[4]。
罕见病患者作为重点特殊人群,尤其需要国家的保障和社会的支持。然而,由于罕见病具有发病率较低、患者规模较小等特点,罕见病用药受到可及性低、药品价格高等因素制约,导致我国罕见病患者长期陷入需求未被满足、相关保障不足的困境,承受着生理和经济带来的双重压力。为保障罕见病患者的基本权益,缓解用药难问题,国家相继出台了一系列的政策措施(见表1)。
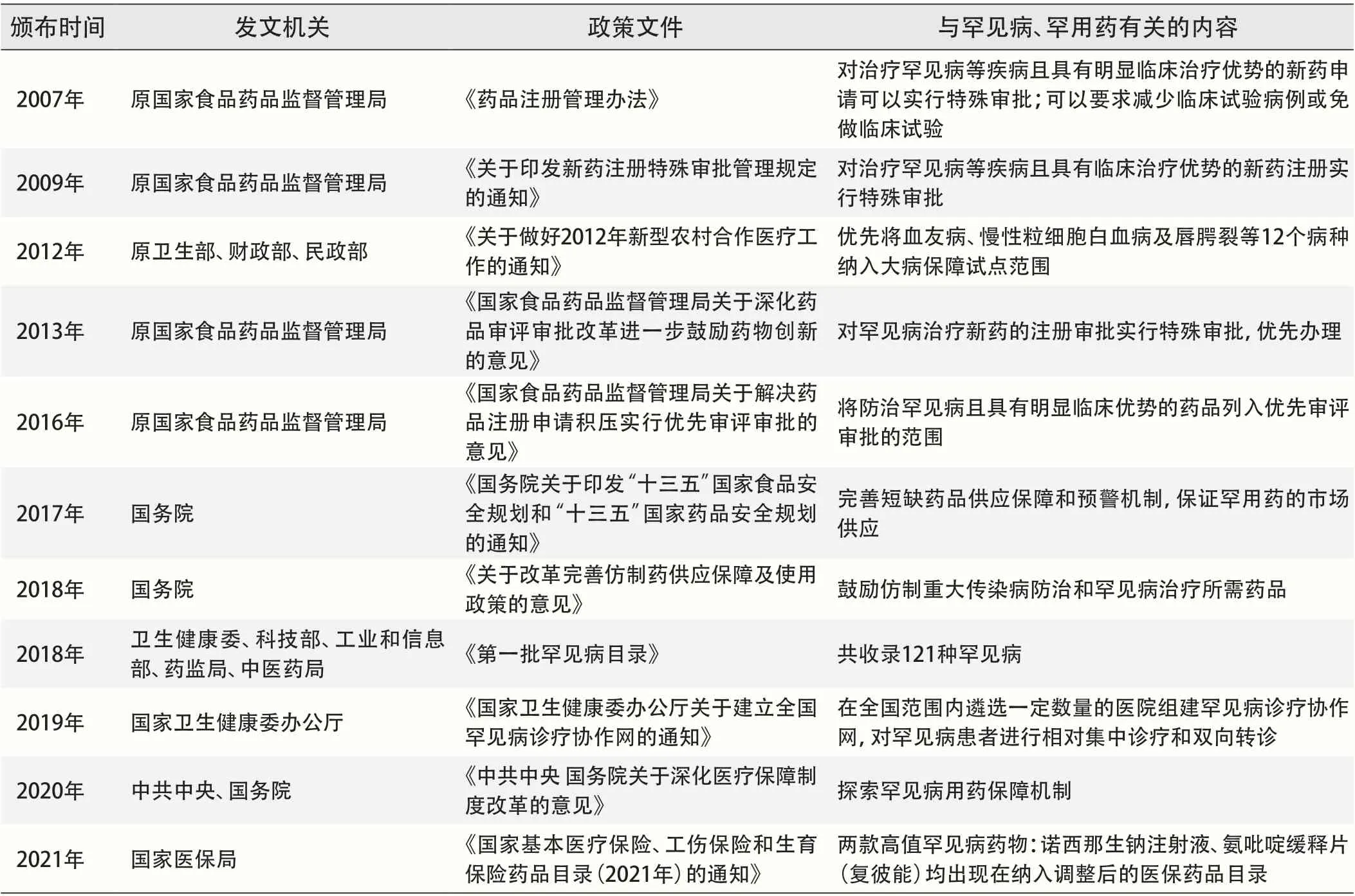
表1 我国罕用药保障主要政策文件梳理
本文通过对典型国家和地区的罕见病用药保障模式进行梳理,从法律法规、筹资方式、支付方式、管理机构和社会支持五个维度分析国外有益经验,为建立和完善高效可行的我国罕见病用药(以下简称罕用药)保障体系提供借鉴。
2 国际罕用药保障的主要模式
目前世界各国和地区对于罕用药的保障主要有两个路径:一是政府层面加大对药品研发的投入,鼓励和支持罕用药的研发与上市;二是政府与社会联动,确保罕用药保障资金池的流动性和筹资稳定性(见表2)。

表2 典型国家和地区罕见病保障模式
2.1 美国模式
美国的罕用药保障表现为立法先行,市场激励,政府出台法律法规,联动市场参与罕用药的保障,“两只手”联合建立了世界上罕用药上市品类最多的美国模式。
美国罕用药保障资金来源于商业保险保费,由承保机构对参保人符合规定的罕用药费用予以报销[5]。在法律法规方面,美国自20 世纪70 年代开始构建罕用药法律体系,1983 年的《罕用药法案》(the Orphan Drug Act) 为 罕 用 药 市场激励机制提供了法律保障。此后,随着罕用药市场的发展,美国联邦法院进一步修订该法案,并于2002 年通过《罕见病法案》(Rare Diseases Act)《孤儿药研究资助法案》(Disease Orphan Product Development)等一系列法律,对美国罕用药法律体系进行补充[6]。
作为当今世界罕用药上市最多的国家,美国的罕用药管理突出表现为以“政府撬动市场”,在严重失灵的罕用药市场中,用“看得见的手”规制“看不见的手”[7]。1983年,美国食品和药物管理局(FDA)颁布了第一个有关孤儿药监管的立法——《孤儿药法》,并提出为开发和注册孤儿药的公司提供经济和监管激励[8]。美国政府主要采取行政激励与经济激励相结合的方式对罕用药企业进行激励。在行政政策上FDA 对于符合条件的罕用药设置绿色通道、加速审查、快速批准,为企业进行政策减负[9]。在经济激励方面,FDA 和美国国立卫生研究院(NIH)通过各种资金扶持计划对符合条件的罕用药研发企业发放研发补贴,并由政府对药品临床试验、专利申请和临床注册费用均予以一定程度的减免。在临床试验阶段,美国政府给予研发者最长3 年的税收优待,罕用药研发者可申请50%—70%的免税比例。研发成功并符合美国法律认定的罕用药,自动免除处方申请费用。药品获批上市后,罕用药的生产和确认费用也可得到一定比例的减免。同时,成功研制罕用药的企业可获得最低7年的市场独占期。政府对已上市的罕用药进行相应的监管[10],保障患者用药安全。
2.2 日本模式
日本的罕用药保障表现为政府主导型,由政府通过立法的方式对罕用药进行界定和管理,用药保障、生产研发主要依靠政府财政拨款支持。日本政府对符合厚生劳动省相关规定的患者提供较高的医疗费用报销比例,同时政府罕见病预算基金将为困难家庭提供资金兜底保障。
日本的罕用药立法始于1993年的《罕用药管理制度》(Orphan Drug Regulations)。同年,日本《药事法》中明确提出鼓励孤儿药研发,2002 年,日本政府在修订《药事法》时引入孤儿药研发及其具体条款[11]。2005 年,日本设立专门的机构——国家生物药品创新协会(NIBIO),负责罕用药研发资助、税收及优惠授权[12]。区别于美国,日本的罕用药管理政策更加强调经济激励。在药品研发阶段,日本国家生物医药研究中心对罕用药研发单位进行一定年限的资助,同时政府对总研发费用达到相关规定的药企予以税收减免。在药品申请审批环节,对评审费用予以减免。同时,为罕用药开设优先审批通道,缩短审批流程,并对再审批间隔周期予以延长[13,14]。审批合格后,日本政府给予罕用药研发企业10 年的市场独占期[15]。
2.3 比利时模式
比利时模式一方面突出表现为资金池充裕;另一方面,在制度设计上,比利时具备较为完善的罕用药保障政策体系。
比利时的罕用药保障资金池相对充裕,以政府拨款作为罕用药保障的主要资金来源。比利时对参加社会基本医疗保险的罕见病患者用药进行全额报销[16],并设置特别团结基金(SSF)为治疗成本较高的罕见病患者提供费用支持[17]。而在法律法规方面,作为欧盟成员国,比利时适用欧盟制定的罕用药相关法律。
在用药保障方面,比利时设计了罕用药早期临时访问制度(ETA)和早期临时报销制度(ETR),在药品研发和申请上市阶段,给予厂商补偿和奖励[18],同时缩短药品上市周期,促进罕用药产业发展[19]。比利时政府注重与企业的合作,有效提高罕用药的可及性,拓宽药品获取渠道[20]。当罕用药短缺时,比利时政府允许医疗机构在保证患者安全的前提下,为罕见疾病的患者提供定制治疗[21]。
2.4 我国台湾地区模式
作为亚洲罕见病保障先行地区之一,我国台湾地区已经建立起系统较为完备的罕见病防治和用药保障体系。同时,社会力量的支持在台湾的罕见病保障系统中发挥着积极作用。
我国台湾地区罕用药保障资金池主要依托政府拨款,辅之以慈善机构和病人组织的捐款,为患者用药提供资金保障。我国台湾地区是目前世界上第四个对罕见病专门立法的地区[22],2000 年出台《罕见疾病防治及药物法》后[23],我国台湾地区已建立起相对系统的罕见病防治和保障支持体系[24]。此外,我国台湾地区还设定了罕见病法规制定、教育研究、罕用药保障、罕见病报销、罕见病患者及其家庭救助等机构。在制度层面,我国台湾地区建立了从产前遗传诊断、新生儿筛查等涵盖罕见病防治全流程的罕见病制度体系。政府层面,开展罕见病防治教育与倡导活动,并颁布专门法案为罕见病患者提供社会支持。同时,由于我国台湾地区罕见病社会支持意识发轫较早,社会认同度相对较高,社会力量在罕见病社会支持体系中发挥了重要作用[25]。
3 国际和地区经验对我国的政策启示
世界各国和地区对罕用药保障模式进行了有益探索,在法律法规、筹资方式、支付方式、管理机构和社会支持等方面具有创新性,对建立和完善我国统一的罕用药保障模式具有重要意义。
3.1 法律法规:法制化,依靠法律强制保障
美国1983 年通过的《罕用药法案》是世界上最早的罕用药专门法律。日本于1993年修订的《药事法》参考了美国的《罕用药法案》,对罕用药进行了明确规定。欧盟的《罕见病医药产品法规》(Regulation(EC)No 141/2000)于1999 年12月通过,并在2000 年1 月正式生效,该法第三条明确了罕用药定义。我国台湾地区建立了以《罕见疾病防治及药物法》为基础的罕用药保障法律体系。
截至目前,尽管我国卫健委已发布了《第一批罕见病目录》等文件,涵盖部分国内多发罕见病病种,但仍然缺乏国家层面的规范性文件。从长远来看,我国构建罕用药保障体系需要以法律法规为基础,建立和完善罕用药保障相关的法律法规,通过法律的手段为罕用药提供保障。
3.2 筹资方式:多元化,拥有多元的筹资路径
美国主要依托商业保险保费为罕见病诊疗费用提供保障,政府资金则更多用于对罕见病药品研发的支持与激励。日本、比利时和我国台湾地区的罕见病保障资金主要源于政府财政资金和有关部门设置的罕见病专项基金,同时政府鼓励社会慈善力量进入罕见病保障筹资体系,对接受政府报销后仍有困难的患者及其家庭由社会慈善力量进行二次援助。
罕见病治疗费用和药品价格高昂,这导致罕见病群体成为“因病返贫、因病致贫”高风险人群。从国际经验与我国各地经济发展程度来看,政府应该在罕见病保障体系中发挥主导作用,同时引入社会组织、企业等社会力量,构建政府与社会慈善合力的多元筹资模式。
3.3 支付方式:多样化,支付方式灵活多样
美国更多地借助商业保险对罕见病治疗与用药费用进行报销。我国台湾地区的罕见病保障支付中,社会慈善与罕见病组织的力量也较为突出。日本厚生劳动省在罕见病保障方面发挥了主导作用,患者病情符合厚生劳动省规定的,即由政府对医药费用进行报销,同时设置困难家庭兜底条款,对获得报销后仍有困难的患者及其家庭,超出其负担上限部分由政府兜底支付。比利时对罕见病诊疗及报销同样设置了二级保障体系,首先由社会基本医疗保险对罕见病诊疗费用进行报销,其次设立特别团结基金(SSF)对缺少替代疗法、罕见病特殊疗法以及治疗成本高的患者进行特别援助。
随着国家和社会对罕见病重视程度的提高,我国罕见病救助呈现政府主导、社会参与的良好局面,但整体而言,各方救助力量仍较为分散。罕见病患者家庭难以获得系统的、长期稳定的救助。未来我国在罕用药保障方面,除了着力扩大罕用药医保目录覆盖范围外,应该重视罕见病患者的信息登记制度,形成全国统一的患者信息平台,由政府牵头,引导、组织商业承保机构、社会慈善基金等多方合力,有针对性地对罕见病患者及其家庭提供精准救助。构建由基本医疗保险兜底,大病保险、普惠型商业健康保险、慈善救助为补充的多层次罕用药保障体系。
3.4 管理机构:专业化,设置行政机构专管罕见病相关事宜
美国罕见病政策制定和产品管理由食品和药物管理局负责,该部门下设的罕见病产品研发办公室(OOPD)专门与医疗机构、罕用药研制企业、社会慈善机构、民间组织合作,合力推动罕见病保障体系的建设,并为罕见病研究与罕用药研发项目提供资金支持。日本厚生劳动省下设药品医疗器械审评中心(PMDA)、国家生物医学创新研究所(MIBIO)分管罕见病药品和医疗器械临床试验与上市评审、罕用药研发补助与咨询工作。欧盟设置欧洲药品管理局(EMA)以及罕见病药品委员会(COMP)管理欧盟境内罕见病药品及医疗器械相关事宜。我国台湾地区设置了相关机构专管罕用药相关事宜。
为实施健康中国战略,推动罕见病保障体系的发展,我国有必要设立专门的罕见病管理机构,负责罕见病有关事务的管理与执行,主要职责包括政策制定、筹资支付、教学研究等工作。
3.5 社会支持:普遍化,广泛动员和利用社会力量
我国台湾地区的罕见病保障模式一个突出特点是利用社会力量支持关注罕见病患者及其家庭,通过罕见病预防筛查体系的构建以及相关政府机构对罕见病知识的全民普及,对患者的生活方式、疾病预防行为、寻求治疗等行为方式进行干预。全社会参与、各利益相关方合力是美国罕见病保障领域的突出特点,亨廷顿氏病学会(HDSA)等患者组织积极组织社会行动,为患者争取到多方面的社会支持与政策福利。
罕见病对患者及家属带来的困扰远超生理上的痛苦和经济上的沉重负担,随着罕见病研究的纵深发展,有关报告表明我国罕见病群体的生存现状仍不容乐观,需要国家牵头,构建政府、社会、公众多方参与的罕见病社会支持体系,一方面提高社会对罕见病的认识和关注,另一方面为患者和家庭提供生活、就业等全方位专业援助,保障罕见病群体权益。
4 结语
罕见病健康危机的缓解是一个关乎全人类的重要公共卫生问题。部分国家和地区在罕见病保障方面发展较早,已经形成较为完备的罕见病综合保障体系,为我国罕见病保障提供经验借鉴。本文对典型国家和地区罕见病保障模式进行梳理,从法律法规、筹资方式、支付方式、管理机构和社会支持五个维度为构建罕见病保障的“中国模式”提供政策建议。维护罕见病患者的健康权益,为保障全人类健康福祉,推进健康中国建设奠定坚实基础。

