金花茶叶提取物减轻动脉粥样硬化的作用机制
农 微, 韦金锐, 陈柏承, 卫智权
(广西中医药大学,广西 南宁 530200)
心脑血管疾病已连续多年位居我国人民死亡原因的首位,而且其发病率仍不断增长,其中动脉粥样硬化是心脑血管疾病最主要的危险因素[1],早期缺乏特异症状,当发现时大多数已出现难以逆转的粥样硬化斑块,故预防的意义大于后期的治疗。研究表明,动脉粥样硬化与低密度脂蛋白(low density lipoprotein, LDL)及其氧化修饰形成的氧化低密度脂蛋白(oxygenized low density lipoprotein,ox-LDL)密切相关[2],ox-LDL可使血管内皮细胞过表达细胞间粘附分子1(intercellular adhesion molecule 1, ICAM-1)、血管粘附分子1(vascular cell adhesion molecule 1, VCAM-1)、P-选择素(P-selectin)与巨噬细胞趋化蛋白1(macrophage chemotactic protein 1, MCP-1),提升血管内皮细胞趋化血液循环中的单核细胞的能力,单核细胞逐渐衍变为泡沫细胞进而形成早期动脉粥样硬化病变的脂质条纹,此后相继出现粥样和纤维粥样斑块及复合病变[3]。由上述病理过程可知,血管内皮细胞趋化单核细胞是动脉粥样硬化进程起始的关键,设法减少ox-LDL诱导的血管内皮细胞过表达ICAM-1、VCAM-1、MCP-1、P-selectin,或能在早期遏止动脉粥样硬化病理进程。
他汀类药物已被证明对于预防动脉粥样硬化发生是有效的,但长期治疗仍缺乏足够的安全性保证,故寻找安全性更高的新型药物非常重要[4]。金花茶叶为山茶科植物金花茶Camelliachrysantha(Hu) Tuyama的叶片,主要分布于中国广西境内,性平,味微苦、涩,是广西壮族的传统用药,具有良好的清热解毒作用[5],本实验以其提取物为对象,采用体外含药血清药理学实验结合体内活性实验来考察其基于负调控血管内皮细胞ICAM-1、VCAM-1、MCP-1、P-selectin表达,从而抑制ox-LDL诱导的单核细胞趋化、粘附,以减轻动脉粥样硬化的潜在作用,以期为该药材开发提供依据。
1 材料
1.1 细胞株与动物 人脐静脉内皮细胞株(human umbilical vein endothelial cells,HUVEC)、THP-1人单核细胞株,均购自中国科学院昆明细胞库。SPF级雄性SD大鼠10只,购自北京大学医学部(实验动物科学部),实验动物生产许可证号SCXK(京)2016-0010;6周龄SPF级C57BL/6JGpt雄性小鼠8只、6周龄ApoE-/-雄性小鼠24只,均购自江苏集萃药康生物科技股份有限公司,实验动物生产许可证号SCXK(苏)2018-0008,饲养环境为温度21~25 ℃,相对湿度70%~80%。
1.2 药材与药物 金花茶叶购自广西峰下花贸易有限公司,经广西中医药大学药学院中药鉴定教研室廖月葵高级实验师鉴定为山茶科植物大叶金花茶Camelliachrysantha(Hu) Tuyama var.macrophyllaS. L. Mo et S. Z. Huang的干燥叶片。辛伐他汀购自厦门力卓药业有限公司,批号181105。
1.3 试剂 RPMI 1640细胞培养液、胎牛血清(fetal bovine serum, FBS)、磷酸盐缓冲液(phosphate buffered saline, PBS)、Accutase胶原酶细胞解离液、Pen Strep青链霉素混合液(美国Gibco公司,批号2120425、1828728、8117266、1952692、1881461);内皮细胞培养基(endothelial cell medium,ECM)、FBS培养基、ECGS培养基、P/S Solution培养基(美国Scien Cell公司,批号28755、29009、29065、28331);CCK-8细胞增殖活性检测试剂盒(日本同仁化学研究所,批号DV652);蛋白电泳预制胶(南京金斯瑞生物科技有限公司,批号C35252003);ox-LDL、组织细胞裂解液、蛋白浓度测定试剂盒、辣根过氧化物酶(horseradish peroxidase, HRP)标记羊抗兔IgG(北京索莱宝科技有限公司,批号H7980、20190903、20190910、20190909);Image-iT 细胞固定与透化试剂盒(美国Life Technologies公司,批号1968179);小鼠抗人CD14- Alexa Fluor 488单抗(美国Invitrogen公司,批号2016143);小鼠抗人甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)单抗(英国Abcam公司,批号GR202362-1);兔抗人ICAM-1、VCAM-1、MCP-1、P-selectin单抗(美国Cell Signaling Technology公司,批号02、02、01、05);HRP标记兔抗小鼠IgG[生工生物工程(上海)股份有限公司,批号G218AA0001]。
1.4 仪器 细胞共培养板(无锡耐思生命科技股份有限公司,批号071719XS01);旋转蒸发仪(德国Heidolph公司);冷冻干燥仪(美国IXRF公司);CO2细胞培养箱(美国Thermo Fisher公司);5430R高速冷冻离心机(德国Eppendorf公司);Infinite 200 Pro酶标仪(瑞士Tecan公司);LSR Fortessa多色分析流式细胞仪(美国BD公司);Mini-PROTEAN垂直电泳仪、Mini Trans-blot转印仪、Chemi Doc成像系统(美国Bio-Rad公司);ASP300S全自动组织脱水机、RM2245半自动轮转切片机、EG1150H石蜡包埋机(德国Leica公司)。
2 方法
2.1 THP-1人单核细胞与HUVEC细胞的体外培养 THP-1细胞采用RPMI-1640培养基,HUVEC细胞采用ECM内皮细胞培养基,均添加10% FBS、100 U/mL青霉素、100 mg/L链霉素,初始细胞密度2×105/mL,培养箱环境为37 ℃、5%CO2、饱和湿度,细胞长至约70%时即可进行细胞传代。
2.2 提取物制备 准确称取500 g金花茶叶,粉碎后过40目筛。先后以10、8倍量75%乙醇回流提取各1次(时间分别为2、1.5 h),合并提取液,通过旋转蒸发仪与水浴锅除去醇味,所得膏状物用冷冻干燥仪干燥成为固态干粉,称取干粉质量后折算为生药量,最终每1 g固态干粉状提取物相当于生药13.53 g,密闭置于干燥容器内,在-40 ℃下冷冻保存,临用时以蒸馏水稀释后使用。
2.3 提取物含药血清、空白对照血清制备 10只SD大鼠适应性喂养3 d后随机分为空白对照组3只,每天灌胃给予蒸馏水2 mL,连续7 d;给药组7只,每天灌胃给予金花茶叶提取物(生药量0.8 g/kg),连续7 d。末次给药1 h后戊巴比妥钠腹腔注射麻醉,下腔动脉穿刺采血,分离血清,56 ℃灭活30 min,分装后在-40 ℃下冷冻保存[6-8]。
2.4 提取物含药血清、空白对照血清的细胞安全性实验 取对数生长期HUVEC细胞,初始密度2×105/mL,分别设置添加10% FBS的正常组和添加5%、10%、15%、20%金花茶叶含药血清或空白血清的给药组。细胞培养24 h后,加入CCK-8试剂继续培养2 h,酶标仪检测450 nm波长处吸光度,以正常组为100%细胞增殖活性,计算给药组细胞增殖活性。
2.5 提取物含药血清干预ox-LDL诱导的HUVEC趋化单核细胞 取对数生长期HUVEC与THP-1单核细胞,设置正常组、模型组、空白血清组、金花茶叶含药血清组,给药组根据细胞安全性实验结果选择适宜浓度,并对HUVEC细胞进行24 h孵育预处理,而正常组和模型组不作预处理。预处理结束后,加入100 μg/mL ox-LDL孵育24 h,更换新鲜培养液,取细胞共培养板,上层接种THP-1单核细胞,下层接种HUVEC细胞,共同培养24 h,分别收获上下层所有细胞,用于流式细胞术分析或总蛋白提取[9]。
2.6 提取物减轻动脉粥样硬化的体内活性实验 采用高脂饲料饲喂ApoE基因敲除(ApoE-/-)雄性小鼠以复制动脉粥样硬化小鼠模型,8只C57BL/6JGpt雄性小鼠作为正常组,饲喂小鼠正常饲料;24只ApoE-/-雄性小鼠分为模型组、辛伐他汀组、金花茶叶提取物组,每组8只,给予高脂饲料(含21%脂肪和0.15%胆固醇)喂养8周。从第9周开始,在原有饲喂方式的基础上,正常组、模型组小鼠每天灌胃给予蒸馏水2 mL,辛伐他汀组小鼠每天灌胃给予药物10 mg/kg,金花茶叶提取物组每天灌胃给予提取物5 g/kg,连续8周。第16周末,各组小鼠脱颈椎处死,迅速剖胸切取主动脉弓,一部分主动脉弓纵向剖开并仔细分离动脉内膜,将内膜置于-80 ℃下冷冻保存,另一部分主动脉弓于10%中性甲醛固定[10-11]。
2.7 流式细胞术检测HUVEC+单核细胞共培养体系中的单核细胞数目占比 收集处理完毕的细胞,以胶原酶细胞解离液室温处理10 min使其解离为单个细胞,Image-it Fix-Perm kit进行细胞固定处理,加入1∶1 000稀释的小鼠抗人CD14-Alexa Fluor 488单抗,在4 ℃下避光孵育120 min,4 ℃预冷的PBS轻柔洗涤3次,进行流式细胞术分析。
2.8 免疫印迹法检测ICAM-1、VCAM-1、MCP-1、P-selectin蛋白表达 收集处理完毕的细胞与主动脉弓内膜组织(尽量剪碎),裂解液4 ℃裂解处理30 min,12 000 r/min离心10 min,取上清并进行蛋白定量,上样量为20 μg,恒压100 V条件下电泳,湿法转膜,封闭,ICAM-1(1∶1 200)、VCAM-1(1∶1 000)、MCP-1(1∶1 000)、P-selectin(1∶1 200)、GAPDH(1∶1 300)一抗4 ℃孵育过夜,次日二抗(1∶2 000)室温孵育60 min,超敏化学发光液孵育3 min,即以ChemiDoc成像系统成像。
2.9 小鼠主动脉弓组织动脉粥样硬化斑块观察 取10%中性甲醛固定的小鼠主动脉弓,常规石蜡包埋,连续切片,脱蜡至水,HE染色,中性树胶封片,在光镜下观察。
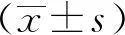
3 结果
3.1 HUVEC、THP-1细胞形态观察 HUVEC细胞每4~5 d以1∶3比例传代1次,细胞贴壁生长,显微镜下可见细胞呈长梭形,部分呈不规则多边形;THP-1细胞每3~4天以1∶3比例传代1次,细胞悬浮生长,显微镜下细胞呈圆形,有聚集生长的趋势,见图1。
3.2 细胞安全性实验 与正常组(10%胎牛血清)比较,5%、10%金花茶叶含药血清或空白血清组HUVEC细胞增殖活性无明显变化(P>0.05),而15%、20%金花茶叶含药血清或空白血清组细胞增殖活性降低(P<0.05,P<0.01),见图2。因此,选择10%作为后续血清药理实验的适宜浓度。
3.3 金花茶叶提取物含药血清抑制HUVEC趋化单核细胞 正常组单核细胞比例为(1.14±0.26)%,与正常组比较,模型组HUVEC的趋化单核细胞数增加(P<0.01),为(12.77±0.15)%;与模型组比较,金花茶叶含药血清组、空白血清组可见HUVEC趋化单核细胞数呈现差异化的变化趋势,其中前者减少(P<0.01),为(2.67±0.36)%,后者无明显变化(P>0.05),为(12.87±0.06)%,见图3A~3B。金花茶叶提取物含药血清了抑制ox-LDL诱导的HUVEC细胞ICAM-1、VCAM-1、MCP-1、P-selectin蛋白过表达,见图3C~3D。
3.4 金花茶叶提取物抑制动脉粥样硬化小鼠的粥样斑块形成 正常组未见粥样斑块形成,内膜表面光滑,各层次结构完整,细胞与组织结构正常,主动脉管腔无缩窄;模型组可见较大的向管腔内明显突出的粥样硬化斑块形成,主动脉管腔有不同程度缩窄,内膜表面欠光滑,粥样斑块内可见典型泡沫细胞,有明显炎细胞浸润,粥样斑块与内膜下肌层分界不清,部分肌纤维断裂;辛伐他汀组主动脉弓内膜镜下所见接近正常组,仅有轻微炎细胞浸润,未见粥样斑块形成;金花茶叶提取物组可见较小的向管腔内轻微突出的粥样斑块形成,主动脉管腔内膜表面尚光滑,各层次结构基本完整,粥样斑块内泡沫细胞较少,炎细胞轻度浸润,粥样斑块与内膜下肌层分界不清但未见肌纤维断裂,见图4A。金花茶叶提取物抑制动脉粥样硬化小鼠的动脉内膜ICAM-1、VCAM-1、MCP-1、P-selectin蛋白过表达,见图4B~4C。
4 讨论
以中医学的脾胃学说解析动脉粥样硬化的慢性低度血管内皮炎症,应为元气虚衰基础上发生的“内热”[12],但动脉粥样硬化患者的内热异于寻常所见的阳火。苦寒之品伤脾胃阳气,泻下之品亦可加重元气亏虚,动脉粥样硬化的阴火内热之证不适用苦寒泻火的治则,而金花茶叶清热解毒,可用于解除阴火内热,以其性平,可避免苦寒耗损脾胃阳气的弊端,适用于动脉粥样硬化早期防治的中医药干预。
研究表明,动脉粥样硬化局部的内皮源性一氧化氮(nitic oxide, NO)、前列腺素、血小板源性生长因子、ox-LDL、血管紧张素Ⅱ和内皮素的生理平衡被破坏,内皮细胞异常高表达P-selectin、ICAM-1、VCAM-1、MCP-1等粘附分子,促进单核细胞在局部内皮的粘附,迁移至内皮下并进而分化为成熟的巨噬细胞,加重局部炎症损伤,增加LDL的局部沉积及氧化修饰,构成ox-LDL与炎症反应的自加强循环[13]。因此,动脉粥样硬化是一种与糖脂代谢异常、脂质氧化修饰密切相关的慢性低度血管内皮炎症[14-15]。金花茶叶兼具改善糖脂代谢异常、减轻血管内皮炎症、抑制脂质氧化修饰等多种药理活性,可有效遏制动脉粥样硬化进程的启动与进展,在早期防治领域具有潜在积极意义[16]。
本研究以ox-LDL刺激HUVEC细胞成功诱导过表达ICAM-1、VCAM-1、MCP-1、P-selectin,类似改变也出现在高脂饮食饲喂的ApoE-/-雄性小鼠的主动脉弓内膜组织,提示ox-LDL确为血管内皮过表达粘附与趋化分子的重要危险因素[17]。有研究证实,金花茶叶/金花茶叶提取物有降低LDL作用,并且具有较高的安全剂量范围,然而其作用强度显然不及他汀类药物,也没有直接比较两者调节ICAM-1、VCAM-1、MCP-1、P-selectin在血管内皮表达的研究报道[18]。体外实验的药效考察体系仅能检测内皮细胞与含药血清的直接相互作用,缺乏与之相关的其他细胞、组织的调控作用的参与,导致金花茶叶提取物的体内药效明显优于体外药效,该现象也是许多天然药物体内外药效差异的常见原因[19]。然而,模式动物在金花茶叶提取物干预的情况下仍然出现了轻度的动脉粥样斑块病变,表明单独使用金花茶叶或其提取物可能不足以充分阻止动脉粥样硬化粥样斑块形成,但其显著的安全性使其极为适合用于广泛人群的动脉粥样硬化日常预防。对于不能耐受他汀类药物的人群,金花茶叶或其提取物则具有更为显著的应用价值。
获取人体早期动脉粥样硬化的病理标本是非常困难的,因而对其各阶段的研究需不断深化[20-21]。动脉粥样硬化研究使用的动物与人类存在诸多差异,本研究使用的高脂饲料饲喂ApoE-/-雄性小鼠动脉粥样硬化模型亦难以避免,故今后仍应进行临床研究[22]。

