MCC950对心肌梗死大鼠心功能的保护作用及其机制
王禹婷,石菲菲,张迪,马淑梅
(中国医科大学附属盛京医院心功能科,沈阳 110004)
心肌梗死(myocardial infarction,MI)是心肌缺氧和心肌细胞能量衰竭引起的心肌坏死,冠状动脉阻塞引起的长期心肌缺血会加重MI。线粒体是真核生物产生能量和活性氧(reactive oxygen species,ROS)的主要场所,参与细胞凋亡和信号转导,正常线粒体功能对调节氧化应激和细胞凋亡至关重要。MI后线粒体因心肌缺氧和再灌注而受损,ROS形成、线粒体分裂/融合平衡破坏、线粒体自噬异常、线粒体膜通透性增加和线粒体超微结构改变都会引起线粒体功能障碍,诱导心肌细胞凋亡。因此,改善线粒体功能障碍对于改善和维持MI后心肌细胞的正常功能至关重要。核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)炎症小体在MI的病理生理过程中起至关重要的作用,抑制NLRP3炎症小体可减轻炎症反应并改善MI诱导的心肌功能障碍。研究[1]表明,线粒体功能障碍和ROS产生可激活NLRP3炎症小体,其激活进一步破坏线粒体的结构和功能。因此,靶向抑制NLRP3炎症小体激活可能是MI的有效治疗方案。MCC950是一种NLRP3抑制剂,可改善与NLRP3有关的多种炎症疾病。研究[2]表明,MCC950可通过抑制MI后的早期炎症反应,缓解MI小鼠心肌纤维化并改善心脏功能。MCC950能否通过改善MI导致的心肌线粒体功能障碍从而改善心功能,有待进一步研究。本研究建立大鼠MI模型,探究MCC950在MI导致的心肌损伤和心功能障碍中的保护作用,及其对氧化应激和线粒体功能的影响,为MCC950在MI治疗中的应用提供理论基础。
1 材料与方法
1.1 主要试剂和仪器
HE染色试剂盒(北京索莱宝科技有限公司);超氧化物歧化酶(superoxide dismutase,SOD)和丙二醛(malondialdehyde,MDA)ELISA试剂盒(上海酶联生物科技有限公司);冰冻切片ROS检测试剂盒(北京百奥莱博科技有限公司);RIPA裂解液、BCA蛋白定量试剂盒、ECL化学发光试剂盒(上海碧云天生物科技有限公司);NLRP3、pro-caspase-1、cleaved caspase-1、pro-IL-1β、pro-IL-18、GSDMD-N、Drp1、Fis1、OPA1、Mfn2、PGC-1α、TFAM、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein,ASC)和GAPDH抗体(美国Abcam公司);石蜡包埋机及切片机、冰冻切片机(德国Leica公司);组织研磨仪(德国IKA公司);荧光显微镜(日本Olympus公司);酶标仪(美国Bio Tek公司);全自动化学发光分析系统(上海天能科技有限公司)。
1.2 动物分组和大鼠MI模型建立
将30只SD大鼠按随机数字表法分为假手术组、MI组和MCC950组,每组10只。假手术组大鼠麻醉后仅打开胸腔后缝合。MI组和MCC950组建立MI模型,大鼠麻醉后打开胸腔,结扎冠状动脉前降支。MCC950组于术前30 min尾静脉注射3 mg/kg MCC950。
1.3 超声心动图检查大鼠心功能
对各组大鼠进行超声心动图检查,记录大鼠左心室射血分数(left ventricular ejection fraction,LVEF)、左心室短轴缩短率(left ventricular fractional shortening,LVFS)、左心室收缩末期内径(left ventricular end systolic diameter,LVESD)和左心室舒张末期内径(left ventricular end diastolic diameter,LVEDD)。
1.4 HE染色检测大鼠心肌组织病理形态变化
将大鼠心肌组织在4%多聚甲醛中固定48 h后,蒸馏水清洗,梯度乙醇脱水,二甲苯透明,石蜡包埋并制成厚4 μm的石蜡切片。切片经二甲苯脱蜡、梯度乙醇水化及蒸馏水洗涤后,进行HE染色。染色后的切片经梯度乙醇脱水,二甲苯透明,中性树胶封片。光学显微镜观察并拍照,放大倍数为200倍。
1.5 ROS荧光探针检测大鼠心肌组织ROS水平
将大鼠心肌组织制成冰冻切片,严格按照冰冻切片ROS检测试剂盒说明书操作,检测大鼠心肌组织ROS水平。将冰冻切片用DHE探针37℃避光孵育30 min,PBS洗涤,DAPI染色液室温避光孵育30 min,PBS洗涤,抗荧光淬灭封片剂封片,荧光显微镜下观察并拍照。
1.6 ELISA检测大鼠心肌组织SOD和MDA水平
严格按照检测试剂盒说明书操作,检测大鼠心肌组织匀浆SOD和MDA水平。将标准品和大鼠心肌组织匀浆样本加入酶标板中,37 ℃孵育1 h,弃液,加入辣根过氧化物酶标记的抗体,37 ℃孵育1 h,弃液,PBST洗板3次,加入生物素标记的亲和素,37 ℃孵育1 h,弃液,PBST洗板5次,加入TMB底物,37 ℃避光孵育15 min,加入终止液,酶标仪检测450 nm吸光度值。
1.7 Western blotting检测大鼠心肌组织NLRP3炎症小体相关蛋白及线粒体分裂、融合和生物发生相关蛋白表达
使用RIPA裂解液提取心肌组织总蛋白,BCA法定量蛋白,将蛋白配置成蛋白样品,煮样使其充分变性,将样品上样于聚丙烯酰胺凝胶上样孔中,电泳分离蛋白,将蛋白转移到PVDF膜上,5%脱脂奶粉室温封闭1 h,NLRP3、pro-caspase-1、cleaved caspase-1、pro-IL-1β、pro-IL-18、GSDMD-N、Drp1、Fis1、OPA1、Mfn2、PGC-1α、TFAM和GAPDH一抗4 ℃孵育过夜,PBST洗膜,二抗室温孵育1 h,PBST洗膜,ECL化学发光,使用ImageJ软件进行灰度分析,并计算蛋白相对表达量。
1.8 免疫荧光染色检测大鼠心肌组织ASC斑点形成
将大鼠心肌组织制成冰冻切片,实验前将切片置于室温平衡30 min,PBS洗涤3次,2%牛血清蛋白室温封闭1 h,ASC一抗4 ℃孵育过夜,PBS洗涤3次,荧光二抗室温避光孵育1 h,PBS洗涤3次,DAPI染色液室温孵育30 min,PBS洗涤3次,抗荧光淬灭液封片,荧光显微镜观察并拍照。
1.9 统计学分析
采用SPSS 22.0软件进行统计学分析。数据均符合正态分布,以表示,多组间比较采用单因素方差分析,组间两两比较采用Tukey事后检验。P< 0.05为差异有统计学意义。
2 结果
2.1 各组大鼠心功能指标比较
与假手术组比较,MI组大鼠LVEF和LVFS明显降低,LVESD和LVEDD明显升高(P< 0.05);与MI组比较,MCC950组大鼠LVEF和LVFS明显升高,LVESD和LVEDD明显降低(P< 0.05)。见表1。

表1 各组大鼠心功能指标Tab.1 Cardiac function indexes of rats in each group
2.2 各组大鼠心肌组织病理形态变化
假手术组大鼠心肌组织结构正常,细胞均匀分布,轮廓清晰,胞核与胞质边缘分明。MI组大鼠心肌组织细胞紊乱,部分细胞可见不清晰及破裂现象,可见大量炎症细胞浸润。MCC950组大鼠心肌组织损伤较MI组损伤减轻,炎症细胞浸润减少。见图1。

图1 各组大鼠心肌组织病理形态表现 HE×200Fig.1 Pathomorphology of cardiac muscle tissue from rats in each group HE×200
2.3 各组大鼠心肌组织ROS水平
与假手术组比较,MI组大鼠心肌组织ROS荧光强度明显升高(P< 0.05);与MI组比较,MCC950组大鼠心肌组织ROS荧光强度明显降低(P< 0.05)。见图2。

图2 各组大鼠心肌组织ROS水平Fig.2 ROS levels in myocardial tissue from rats in each group
2.4 各组大鼠心肌组织氧化应激因子水平
与假手术组比较,MI组大鼠心肌组织MDA含量明显升高,SOD含量明显降低(P< 0.05);与MI组比较,MCC950组大鼠心肌组织MDA含量明显降低,SOD含量明显升高(P< 0.05)。见表2。

表2 各组大鼠氧化应激因子水平Tab.2 Levels of oxidative stress factors in rats from each group
2.5 各组大鼠心肌组织NLRP3炎症小体相关蛋白表达
与假手术组比较,MI组大鼠心肌组织NLRP3、pro-caspase-1、cleaved caspase-1、pro-IL-1β、pro-IL-18和GSDMD-N蛋白相对表达量均明显升高(P< 0.05);与MI组比较,MCC950组大鼠心肌组织NLRP3、procaspase-1、cleaved caspase-1、pro-IL-1β、pro-IL-18和GSDMD-N蛋白相对表达量均明显降低(P< 0.05)。见图3。
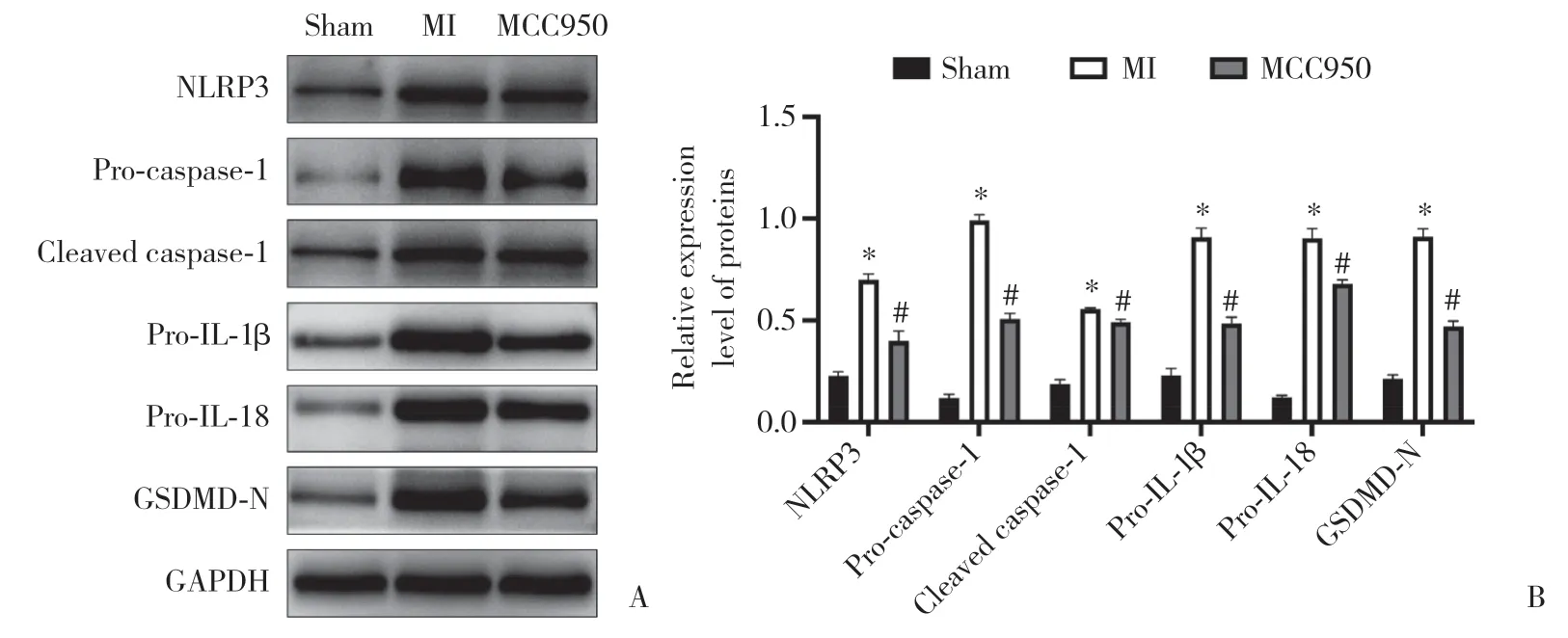
图3 各组大鼠心肌组织NLRP3炎症小体相关蛋白表达检测结果Fig.3 Expression of NLRP3 inflammasome-related proteins in myocardial tissue from rats in each group
2.6 各组大鼠心肌组织ASC斑点形成
与假手术组比较,MI组大鼠心肌组织ASC斑点形成数明显升高(P< 0.05);与MI组比较,MCC950组大鼠心肌组织ASC斑点形成数明显降低(P< 0.05)。见图4。

图4 各组大鼠心肌组织ASC斑点形成检测结果Fig.4 ASC speck formation in myocardial tissue from rats in each group
2.7 各组大鼠心肌组织线粒体分裂、融合和生物发生相关蛋白表达
与假手术组比较,MI组大鼠心肌组织OPA1、Mfn2、PGC-1α和TFAM蛋白相对表达量明显降低,Drp1和Fis1蛋白相对表达量明显升高(P< 0.05);与MI组比较,MCC950组大鼠心肌组织OPA1、Mfn2、PGC-1α和TFAM蛋白相对表达量明显升高,Drp1和Fis1蛋白相对表达量明显降低(P< 0.05)。见图5。
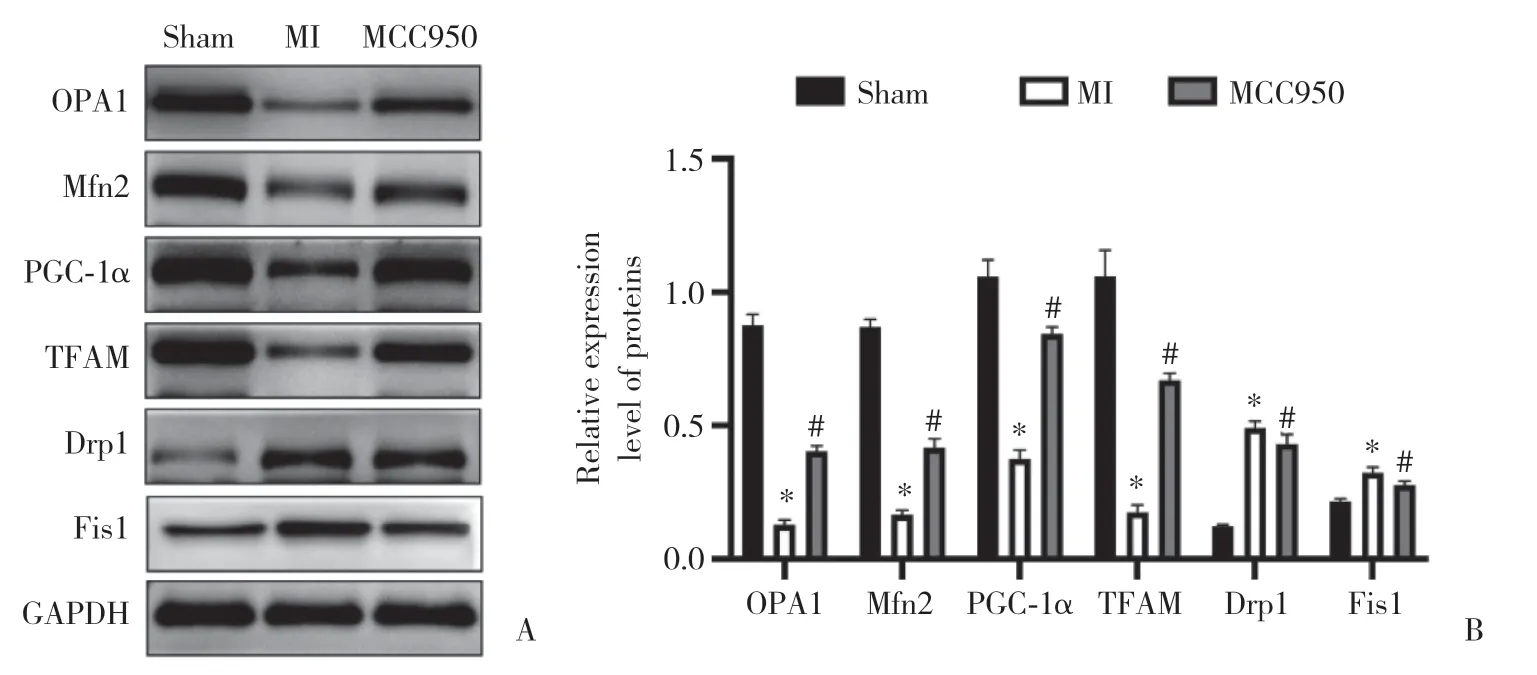
图5 各组大鼠心肌组织线粒体分裂、融合和生物发生相关蛋白表达Fig.5 Expression of proteins related to mitochondrial division,fusion,and biogenesis in myocardial tissue from rats in each group
3 讨论
MI是世界上发病率和死亡率最高的疾病之一,其特征是心肌细胞丢失和纤维化瘢痕形成,心脏肥大和纤维化在很大程度上导致心室壁增厚和变硬,最终导致心脏功能受损和随后的心力衰竭。MI期间的无菌炎症反应在瘢痕形成和受损心肌的重塑中发挥至关重要的作用,早期的炎症反应可能会增加基质降解,导致梗死的心肌组织愈合并形成疤痕,然而炎症反应加重和延长导致MI后心室重构和功能障碍。因此,适度调节MI后的炎症反应对预防心力衰竭至关重要。
MCC950是NLRP3的选择性抑制剂之一,具有缓解疼痛、抗氧化、调节自噬和抗衰老等作用。CHENG等[3]的研究表明,将MCC950加载到基质金属蛋白酶9水解微球中可抑制粒细胞中炎性因子的分泌,改善心功能。本研究发现,MCC950可改善MI大鼠心功能和心肌组织病理损伤,提示MCC950对MI的潜在治疗作用。此外,本研究还检测了MCC950对MI大鼠心肌组织NLRP3炎症小体相关蛋白表达的影响,结果显示,MCC950降低MI大鼠心肌组织中NLRP3、pro-caspase-1、cleaved caspase-1、pro-IL-1β、pro-IL-18和GSDMD-N蛋白表达,并抑制ASC斑点形成。GSDMD是参与细胞焦亡发病机制的关键蛋白,可裂解为GSDMD-N 和GSDMD-C 结构域,GSDMD-N寡聚化并穿透质膜以引发细胞焦亡,从而诱导心肌损伤[4]。因此,MCC950对MI大鼠的心脏保护作用可能与其抑制心肌细胞焦亡有关,其具体机制有待进一步验证。
ROS是线粒体呼吸或代谢的副产品,线粒体功能障碍时会产生过多的ROS,并对线粒体造成不可逆的损害,当其释放超过内源性抗氧化能力时会诱发氧化应激,导致细胞死亡,这是MI发展的重要因素[5]。本研究发现,MCC950降低MI大鼠心肌组织ROS水平和MDA含量,并增加SOD含量,提示MCC950抑制MI诱导的心肌氧化应激,这可能与其改善线粒体功能障碍有关。线粒体分裂、融合以及线粒体生物发生是调节线粒体形态、大小、质量、数量和生物活性的主要控制方法,保护线粒体免受损伤。Drp1是线粒体分裂的主要介质,其通过与线粒体外膜上的Mff、Fis1、MiD49和MiD51 结合促进线粒体裂变[6-7]。研究发现,抑制 Drp1 的表达和活性可以改善心功能,LI等[8]的研究表明,黄芩素可通过KLF4-MARCH5-Drp1通路上调心肌细胞膜相关的MARCH5表达,下调Drp1表达,从而缓解心肌缺血再灌注损伤。LIU等[9]发现,注射microRNA-138抑制剂后MI小鼠Drp1表达下调,MI面积减小。本研究发现,MCC950降低MI大鼠心肌组织Drp1和Fis1蛋白表达,表明MCC950抑制MI导致的线粒体分裂。线粒体融合与分裂一起维持线粒体的正常结构和功能,融合依赖于线粒体跨膜GTP酶,包括介导线粒体外膜融合的Mfn1和Mfn2,以及介导线粒体内膜融合的OPA1[10]。OPA1分为具有较高分子量的L-OPA1和具有较低分子量的S-OPA1。再灌注损伤时,L-OPA1过度切割导致线粒体内膜嵴完整性丧失,细胞色素C和其他促凋亡因子释放到细胞质中,并激活细胞凋亡[11]。OKATAN等[12]发现,心肌缺血再灌注导致Mfn2表达大幅下降,从而减少线粒体融合,表明Mfn2的异常表达与MI后线粒体融合的减少有关。本研究发现,MCC950增加MI大鼠心肌组织OPA1和Mfn2表达,表明MCC950增加MI大鼠线粒体融合。线粒体生物发生是指增加线粒体体积以满足细胞能量需求的增加,从而补偿线粒体的损失[13]。线粒体生物发生主要受PGC-1α调节,它可以激活TFAM等线粒体生物发生相关转录因子[14]。本研究发现,MCC950增加MI大鼠心肌组织PGC-1α和TFAM蛋白表达,表明其增加MI大鼠心肌线粒体生物发生。
综上所述,本研究发现,MCC950降低MI大鼠心肌组织氧化应激,促进线粒体融合和生物发生并抑制线粒体分裂,从而改善心肌损伤,保护心功能,这可能与其抑制NLRP3炎症小体激活有关。

