肠道菌群对大鼠紫杉醇神经病理性疼痛模型的影响*
朱彬,郑彩虹,边英麟,施海滨
(1杭州市妇产科医院,浙江 杭州 310000;2浙江大学医学院附属杭州市第一人民医院,浙江 杭州 310000)
据统计,2020年全球新增肿瘤病例达1 930万例,肿瘤死亡人数近1 000万例[1]。紫杉醇(paclitaxel,PTX)是一种常用的抗肿瘤药物,被广泛用于卵巢癌、乳腺癌和前列腺癌等实体肿瘤的治疗[2]。PTX是新型抗微管药物,通过促进微管蛋白聚合抑制解聚,保持微管蛋白稳定,抑制细胞有丝分裂,从而发挥抗肿瘤作用。然而,PTX不仅仅影响肿瘤细胞,也影响中枢和外周神经系统的细胞[3]。神经毒性是PTX剂量限制性毒性的主要因素之一[4],临床表现为持续数月至数年的肢体麻木、疼痛以及对机械或冷刺激的超敏反应[5],导致患者无法足量完成PTX治疗。因神经毒性诱发的神经病理性疼痛的机制不明,目前尚无有效镇痛治疗方法[6]。
微生物广泛定植于皮肤和黏膜,在胃肠道中微生物密度最大,其次是结肠部分[7]。研究显示肠道菌群在内分泌、免疫功能以及药物代谢、吸收方面发挥作用[8],肠道菌群可通过“肠-轴”影响神经系统功能[9],PTX治疗可导致肠道菌群失调和肠道炎症[10]。Shen等[11]研究显示肠道菌群在奥沙利铂神经病理性疼痛动物模型中发挥着关键作用,然而肠道菌群是否影响大鼠PTX模型的神经病理性疼痛,仍需要进一步研究。
因此,基于以上研究,本项工作拟通过构建大鼠PTX神经病理性疼痛动物模型,通过使用广谱抗生素及粪便移植技术干预各组动物肠道菌群,观察肠道菌群在大鼠PTX神经病理痛模型中的作用,并探讨可能的分子机制。
材料和方法
1 动物
42只雄性清洁级SD大鼠,6~8周龄,200~250 g,购自上海斯莱克实验动物有限责任公司,许可证号:SCXK(沪)2017-0005。饲养环境温度保持在(22±1)℃,湿度保持在65%~70%,12 h明/暗光照周期,自由饮食。
2 主要试剂
PTX(HJ20171227,Italy);组织细胞快速裂解液(RIPA)和PBS购自上海碧云天生物公司;Toll样受体4(Toll-like receptor 4,TLR4)抗体(66350-1-Ig)、p38抗体(14064-1-AP)和GAPDH抗体(14064-1-AP)购自Proteintech;p-p38抗体(bs-0636R)、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)抗体(bs-10562R)和p-JNK抗体(bs-4163R)购自Bioss;细胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2,ERK1/2)抗体(Ab184699)和p-ERK1/2抗体(Ab201015)购自Abcam;BCA蛋白定量试剂盒(PICPI23223)、大鼠白细胞介素1β(interleukin-1β,IL-1β)ELISA检测试剂盒(#BMS630)和大鼠肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)ELISA检测试剂盒(#ERA56RB)均购自Thermo Scientific;Tween-20(BYL40713)购自Amresco。
3 主要方法
3.1 PTX神经病理性疼痛模型的建立及分组大鼠适应环境1周,在实验开始前1天(D0)测大鼠的基础痛阈值,挑选合格大鼠。使用随机数字法将24只大鼠分为对照(control)组、PTX+生理盐水组(PTX组)、PTX+抗生素(antibiotic,Abx)组和PTX+粪菌移植(fecal microbiota transplantation,FMT)组,每组6只。另18只大鼠随机分为PTX+TLR4激动剂LPSPG Ultrapure组、PTX+TLR4抑 制 剂TAK242组 和PTX+p38抑制剂SB203580组,每组6只。按照文献[12]构建PTX神经病理性疼痛模型,PTX各组在实验开始D1、D3、D5、D7分别通过腹腔注射PTX 2 mg·kg-1·d-1(溶于2.5 mL生理盐水),穿刺位置为下腹部,避免穿刺入膀胱及反复穿刺,以防感染和造成大鼠不适[13]。对照组于相同时点腹腔注射等体积生理盐水。PTX+LPS-PG Ultrapure组、PTX+TAK242组和PTX+SB203580组均在造模第1天鞘内单次注射激动剂或抑制剂(参考既往研究[14])。各组大鼠饮用水内容:PTX+Abx组饮用水中添加1.0 g/L氨苄西林钠、1.0 g/L甲硝唑、1.0 g/L硫酸新霉素和0.5 g/L万古霉素,与40%无菌糖浆混合,2 d更换一次,持续整个实验;对照组、PTX组和PTX+FMT组大鼠每天饮用蒸馏水。PTX+FMT组每天固定时间给予2 mL细菌悬液灌胃,持续7 d;于同一时点,对照组、PTX组、PTX+LPS-PG Ultrapure组、PTX+TAK242和PTX+SB203580组均给予等体积蒸馏水灌胃,PTX+Abx组给予等体积的抗生素混合液灌胃。
3.2 FMT[15]收集对照组大鼠实验前新鲜粪便颗粒,用无菌PBS(每毫升1个粪便颗粒)稀释浸泡约15 min,摇匀后888×g、4℃离心5 min,再取悬浮液在7 104×g、4℃离心5 min后,在PBS中过滤两次。最后的细菌悬浮液与相同体积的40%无菌糖浆混合。PTX+FMT组大鼠于造模开始,每天给予2 mL细菌悬液灌胃并持续7天。
3.3 机械缩足反射阈值(mechanical withdrawal threshold,MWT)的测定采用SLY-HFM手持式测痛仪测定。大鼠被放置于透明有机玻璃罩内,其底为细的金属网,网格大小能够满足测量的需要,将大鼠放置30 min后进入安静状态后,用手持式测痛仪垂直由金属网格刺入实验动物的右侧足底中部并逐渐加大刺激力度,待大鼠突然出现缩足反应时,手持式测痛仪可以自动记录动物在缩足瞬间的机械刺激力度,仪器会自动记录压力读数(单位:g),间隔5 min测1次,共连续测定5次,取平均值为此时间点大鼠的MWT,在实验的前1天和实验的第7、12、21天分别测定。
3.4 热缩足潜伏期(thermal withdrawal latency,TWL)的测定采用PL-200热刺痛仪测定。将实验动物放在透明的有机玻璃箱中,待其自由活动逐渐处于安静状态时,在实验箱底部缓慢移动热辐射光源对于大鼠足底中部,打开热辐射光时仪器自动记录开始时间,光透过透明的有机玻璃板底部聚焦于大鼠足底中部皮肤,待大鼠出现抬腿回避动作时,仪器可以自动记录时间(单位:s),即为大鼠的TWL。整个实验过程中光照强度保持一致,为避免热刺激时间过长造成组织损伤,光照25 s时仪器会自动切断电源,连续测量3次,每次间隔5 min,取平均值为此时间点此只大鼠的TWL,在实验的前1日和实验的第7、12、21天分别测定。
3.4 Western blot在实验结束时取结肠组织,用RIPA溶解组织,RIPA中含有0.05 mol/L Tris(pH 7.4)、0.15 mol/L氯化钠、1%脱氧胆酸钠、1% Triton X-100、0.1%十二烷基硫酸钠。在4℃下溶解30 min,然后在4℃下10 656×g离心15 min,上清液保存在-80℃冰箱直至使用。采用BCA蛋白检测试剂盒检测上清液蛋白浓度。常规电泳分离,200 mA,90 min。用5%脱脂奶粉TBST浸泡PVDF膜室温封闭条带1 h,加相应Ⅰ抗(均1∶1 000稀释),4℃孵育过夜,TBST洗脱3次,每次5 min,随后浸泡在HRP标记的Ⅱ抗,37℃孵育1 h,用TBST洗涤3次,每次5 min。ECL发光显色。以GAPDH作为内参照,放入成像系统(Tanon-5200)中进行扫描,使用ImageJ软件测定蛋白印迹强度。
3.5 16S rDNA分析实验结束收集各组大鼠粪便,利用16S rDNA进行粪便微生物分析。完成基因组DNA抽提后,利用1%琼脂糖凝胶电泳检测抽提的基因组DNA。设计合成引物进行PCR扩增,将PCR扩增产物用QuantiFluor™-ST蓝色荧光定量系统(Promega)进行定量检测。使用TruSeqTMDNA Sample Prep Kit试剂盒进行Miseq文库构建以及测序,将MiSeq测序得到的PE reads进行样本拆分,并进行质控、过滤、拼接。使用序列降噪方法(DADA2/Deblur等)处理优化数据,获得ASV(Amplicon Sequence Variant)代表序列和丰度信息,进行群落组成分析以及物种差异分析。
3.6 检测SD大鼠血清中炎症因子的水平利用SD大鼠血浆IL-1β和TNF-αELISA检测试剂盒检测SD大鼠血清中炎症因子的水平,样品均采用复孔检测,减少操作误差。所有操作根据试剂盒说明书进行。
4 统计学处理
应用SPSS 25.0软件对实验数据进行统计分析。计量资料以均数±标准差(mean±SD)表示,计数资料以率(%)表示。多组间均数比较采用单因素方差分析,多重比较采用Bonferroni检验;率的比较采用卡方检验。以P<0.05为差异有统计学意义。
结 果
1 行为学的比较
PTX造模前(D0)测各组大鼠后足MWT,结果显示4组大鼠的MWT基础阈值相似,差异无统计学意义(P>0.05)。造模前测各组大鼠后足TWL,结果显示大鼠的TWL基础值相似,差异无统计学意义(P>0.05)。对照组比较,PTX组大鼠在造模后第7、12、21天后足MWT和TWL均显著降低(P<0.01),随着造模时间的延长,PTX组MWT和TWL均呈下降趋势,在造模第21天,达到最低点。PTX+FMT组较正常对照组大鼠MWT和TWL下降趋势,在造模第12、21天,PTX+FMT组MWT和TWL均较PTX组高(P<0.05)。PTX+Abx组大鼠饮用广谱抗生素后,MWT和TWL在第7、12、21天均呈现下降趋势,但与PTX组比较差异无统计学意义(P>0.05)。见表1、2。
表1 紫杉醇处理后大鼠机械痛反射阈值比较Table 1.Comparision of mechanical withdrawal threshold in rats after paclitaxel(PTX)treatment(g.Mean±SD.n=6)

表2 紫杉醇处理后大鼠热缩足潜伏期比较Table 2.Comparision of thermal withdrawal latency in rats after paclitaxel(PTX)treatment(s.Mean±SD.n=6)
2 肠道菌群差异的比较
使用16S rDNA基因测序技术测定各组大鼠肠道菌群的组成及丰度。PTX组、PTX+FMT组和PTX+Abx组的肠道菌群较对照组均发生改变。根据样本间群落丰度的相似性进行聚类,将结果呈现在以颜色梯度来表示群落物种组成的群落Heatmap图上。使高丰度和低丰度的物种分块聚集,通过颜色变化与相似程度来反映不同分组在各分类水平上群落组成的相似性和差异性,并根据得到的群落丰度数据,评估各组间物种丰度差异的显著性水平,结果显示各 组 间Muribaculaceae(P=0.001)、Romboutsia(P=0.003)、Turicibacter(P<0.001)、Corynebacterium(P<0.001)、Oscillospiraceae(P<0.001)、UCG-005(P=0.04)、UCG-014(P=0.04)等菌属均有显著差异,见图1。
3 大鼠TLR4和MAPKs家族蛋白的表达
Western blot显示,与对照组比较,PTX组大鼠TLR4、p-p38、p-JNK及p-ERK1/2蛋白水平均显著上调(P<0.05);与对照组比较,PTX+Abx组TLR4、pp38、p-JNK和p-ERK1/2蛋白水平均显著上调(P<0.01);PTX+FMT组TLR4、p-p38、p-JNK和p-ERK1/2蛋白水平与对照组比较无显著差异(P>0.05),见图2。
4 PTX模型大鼠鞘内注射TLR4激动剂LPS-PG Ultrapure、TLR4抑 制 剂TAK242或p38抑 制 剂SB203580对大鼠行为学及炎症因子表达的影响
PTX模型大鼠造模第1天(D1)鞘内单次注射LPS-PG Ultrapure,D7时大鼠MWT和TWL较对照组均显著下降(P<0.01);PTX模型大鼠D1鞘内单次注射TAK242或SB203580,均可逆转PTX大鼠MWT及TWL下降趋势,两组MWT和TWL均较PTX组显著升高(P<0.01),见表3,4。

表3 LPS-PG Ultrapure、TAK242或SB203580鞘内注射后大鼠机械痛反射阈值比较Table 3.Mechanical withdrawal threshold in rats after intrathecal injection of LPS-PG Ultrapure,TAK242 or SB203580(g.Mean±SD.n=6)
SD大鼠血清ELISA结果显示,PTX诱导的神经病理性疼痛大鼠模型中血清炎症因子TNF-α和IL-1β水平均高于对照组(P<0.01);PTX组大鼠D1鞘内注射LPS-PG Ultrapure后,大鼠血清中炎症因子IL-1β和TNF-α水平均显著高于对照组和PTX组(P<0.01);PTX模 型 大 鼠 鞘 内 给 予TAK242或SB203580,大鼠血清中炎症因子IL-1β和TNF-α水平较PTX组显著下降(P<0.01),但仍较对照组高(P<0.01),见表5。

表5 紫杉醇大鼠模型鞘内注射LPS-PG Ultrapure、TAK242、SB203580后大鼠血清ELISA指标检测结果Table 5.The ELISA results of serum inflammatory factors after intrathecal injection of LPS-PG Ultrapure,TAK242 and SB203580 in paclitaxel(PTX)model rats(ng/L.Mean±SD.n=6)
讨 论
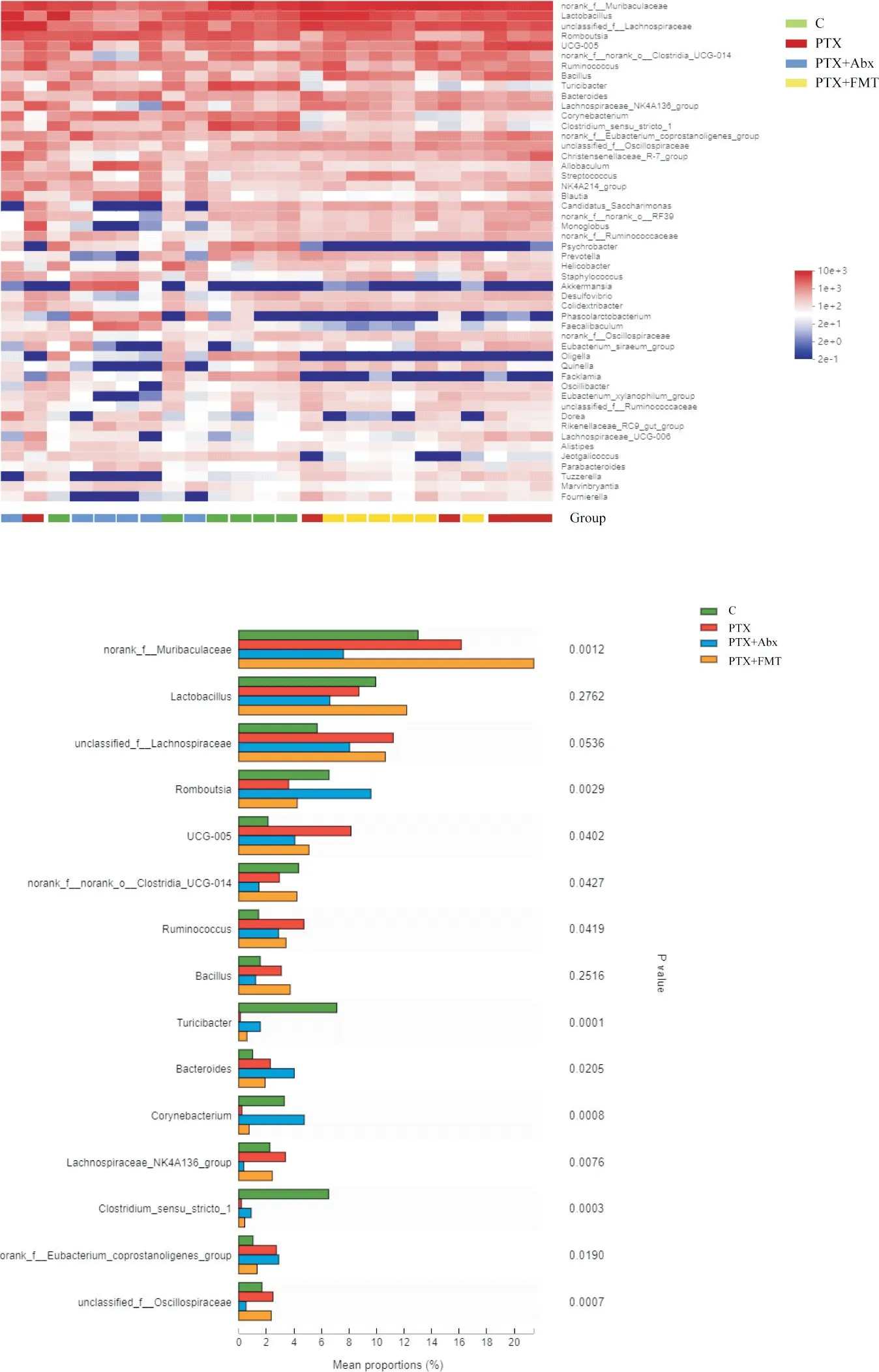
Figure 1.Differential profiles of gut microbiota among control,PTX group,PTX+Abx group and PTX+FMT group(n=6).A:heatmap of different levels among the groups;B:species difference analysis among groups.图1 各组肠道菌群群落组成差异图
PTX是一线的抗肿瘤药物,主要副作用是剂量依赖性的神经病理性疼痛[16]。高剂量PTX可引起轴突退行性改变,低剂量可触发过敏性疼痛,包括异位性疼痛和痛觉过敏[17]。肠道菌群与神经系统疾病(包括慢性疼痛)之间的关系越来越受到关注。肠道菌群是内脏疼痛的关键调节因子,而最近的证据表明,肠道菌群在许多其他类型的慢性疼痛中也可能发挥关键作用,包括炎症性疼痛、头痛和神经病理性疼痛等[18-19]。

Figure 2.The protein levels of TLR4,p-p38,p-JNK and p-ERK1/2 detected by Western blot.Mean±SD.n=6.*P<0.05,**P<0.001 vs control group;#P<0.05 vs PTX group.图2 TLR4和MAPKs家族蛋白的表达
在本研究中,我们以肠道菌群为切入点,通过干扰PTX模型大鼠的肠道菌群,探讨肠道微生物在PTX诱导的神经性疼痛模型中的作用,验证通过改变肠道菌群是否可以减轻PTX引起的神经病理性疼痛,并寻找可能的相关分子机制。实验通过建立PTX大鼠模型,分组给予广谱抗生素或移植正常大鼠粪便菌群,改变大鼠的肠道菌群的相对丰度。本实验通过喂饲PTX模型大鼠广谱抗生素,有效减少大鼠肠道内菌群,可降低大鼠的机械痛阈值和热缩足反射阈值,导致大鼠机械痛、热痛痛觉过敏,促进大鼠TLR4、p-p38、p-JNK及p-ERK1/2等信号蛋白的表达;而移植正常对照组大鼠粪便菌群的PTX模型大鼠,可减轻机械痛阈值和热缩足反射阈值下降趋势,缓解大鼠机械痛、热痛痛觉过敏,并抑制大鼠TLR4、p-p38、p-JNK及p-ERK1/2等信号蛋白的表达。16S rDNA分析各组大鼠肠道菌群,实验结果显示PTX治疗可引起肠道菌群失调,与既往的研究结果一致[20],各组大鼠肠道菌属丰度存在显著差异,其中Muribaculaceae[21]、Romboutsia[22]、Turicibacter[23]、瘤胃球菌UCG-005及UCG-014[24]与维持肠道上皮细胞功能的稳定、抑制炎症和减少上皮细胞的凋亡有关。以上实验结果显示,肠道菌群在PTX诱导的神经病理性疼痛中的重要作用,通过调整肠道菌群可改善PTX模型大鼠的神经病理性疼痛。我们的研究为预防PTX化疗引起的神经病理性疼痛提供了参考资料。

表4 LPS-PG Ultrapure、TAK242或SB203580鞘内注射后大鼠热缩足潜伏期比较Table 4.Comparision of thermal withdrawal latency in rats after intrathecal injection of LPS-PG Ultrapure,TAK242 or SB203580(s.Mean±SD.n=6)
既往研究显示,中枢神经系统中的TLR4在啮齿类动物神经性疼痛模型的行为超敏反应中发挥作用[14,25]。结合本实验结果显示,PTX造模后可促进结肠组织TLR4的激活和MAPKs家族相关蛋白的磷酸化,但移植对照组正常肠道粪便菌群后,可明显抑制TLR4及MAPKs家族相关蛋白的磷酸化表达。结合既往研究[14],本实验选择给予PTX模型大鼠鞘内注射TLR4抑制剂TAK242或p38抑制剂SB203580,结果显示均可抑制TLR4和p-p38蛋白的表达,说明TLR4与p38可能存在信号表达的上下游关系。PTX模型大鼠鞘内注射抑制剂还可减少炎症因子IL-1β和TNF-α的表达水平,并缓解大鼠的机械痛和热痛觉过敏,阻止PTX诱导的神经病理性疼痛的发展,但不能逆转大鼠行为学的改变。本实验结果提示TLR4-MAPKs信号通路可能参与PTX诱导的神经病理性疼痛的发生发展,是否还有其他信号通路参与神经病理性疼痛的发展还需要进一步研究。
综上所述,PTX治疗可改变大鼠肠道菌群种属及丰度,促进炎症因子的释放,激活TLR4和MAPKs,促进大鼠的机械痛和热痛痛觉过敏。我们的研究结果表明肠道菌群参与PTX诱导的大鼠神经病理性疼痛的发生与发展,可能通过激活TLR4-MAPKs信号通路,但仍需要进一步研究。

