桑寄生不同提取部位对黄嘌呤氧化酶的体外抑制活性
梁 圆 蔡毅朱意麟卢小慧钟夏瑜黎理
(1.广西中医药大学, 广西 南宁530200; 2.玉林市第一人民医院, 广西 玉林537099; 3.成都中医药大学, 四川 成都611137)
痛风是人体嘌呤代谢异常所致的一组综合症,由尿酸盐晶体聚积关节而引起[1]。现治疗痛风多以黄嘌呤氧化酶为切入点,该酶为尿酸生成的关键代谢酶。长期服用别嘌醇可能会引起过敏、肝肾损伤及骨髓抑制等不良反应,限制了其临床应用。中医认为“痛风”属于痹证或者痹病的范畴[2],由于风寒湿邪、风湿热邪痹阻经络导致气血运行不畅,或者是由于痰浊、瘀血阻滞经络所导致的,应及时采用祛风湿药来祛风通络、祛邪外出。同时因中药具有毒副作用低、多靶点、多组分的特点,适合以此寻找治疗痛风的天然活性物质。
桑寄生为桑寄生科桑寄生Taxillus chinensis(DC.)Danser 的干燥带叶茎枝[3⁃4]。桑寄生及其配伍复方对于治疗肝肾气血不足、不荣所致疼痛或外感风寒湿热等邪气所致的腰痛、痹证等肢体经络系常见病证具有良好的疗效,还具有提高软骨活力的作用[5⁃6]。同科植物红花寄生的提取物能一定程度缓解由尿酸钠所导致的急性痛风性关节炎,但对于桑寄生治疗痛风相关疾病的研究尚未见报道[7]。本研究采用紫外分光光度法结合高效液相色谱法以考察不同寄主的桑寄生药材不同提取部位对黄嘌呤氧化酶的体外抑制作用,为扩大桑寄生药用价值提供参考。
1 材料
桑寄生,共13 批药材,以桑树为寄主的药材分别采自广西梧州市安平镇富宁村、南宁市兴宁区药用植物园、河池市天蛾县、玉林市兴业县石南镇;以枫香树、黄皮树、大叶冬青树、山楂树和龙眼树为寄主的药材采自梧州市安平镇;以桃树和桂花树为寄主的药材采自南宁市西乡塘;以樟树为寄主的药材采自广西农业职业技术学院;以松树为寄主的药材采自百色市乐业县,自然阴干,经广西中医药大学药学院蔡毅教授鉴定为桑寄生科钝果寄生属植物桑寄生Taxillus chinensis(DC.)Danser 的干燥带叶茎枝。
磷酸盐缓冲液(PBS),江苏凯基生物技术股份有限公司,批号20 201201;黄嘌呤、尿酸、别嘌醇,上海阿拉丁生化科技股份有限公司,批号分别为E2008048、H1710084、L2 001123;二甲基亚枫(DMSO)、黄嘌呤氧化酶(XO),北京索莱宝科技有限公司,批号分别为1121E0316、227U013;磷酸二氢钾试剂为色谱纯;氢氧化钠、盐酸、石油醚(60~90 ℃)、三氯甲烷、乙酸乙酯和正丁醇等试剂均为分析纯;水为纯水。
ES2220M 型电子天平,瑞士普利赛斯公司;5810R 型冷冻离心机,德国艾本德公司;HWS⁃26型恒温水浴锅、ALPHA1⁃2LD plus 型冷冻干燥机,德国博励行公司;UV⁃2600 型可见光紫外分光光度计,日本岛津公司;e2695 型高效液相色谱仪,美国沃特世公司。
2 方法
2.1 溶液制备
2.1.1 提取物 取各批次桑寄生药材(叶、枝为2∶1),打粉,加入10、8、6 倍量60% 乙醇,各回流提取2 h,合并提取液,置于旋转蒸发仪中浓缩,溶于热水中,依次用石油醚、三氯甲烷、乙酸乙酯和正丁醇分别进行萃取,得到石油醚部位、三氯甲烷部位、乙酸乙酯部位、正丁醇部位和水部位。各部位减压浓缩、冷冻干燥,得到粉末,在阴凉处保存。
2.1.2 供试品 精密称取桑寄生各提取部位粉末适量,加入PBS(含1% DMSO),超声溶解,得4 000 μg/mL 溶液,用含1% DMSO 的PBS 进行稀释,得4 000、2 000、1 000、500、250、125 μg/mL的供试品。
2.1.3 酶溶液 取5 U/460 μL 的黄嘌呤氧化酶溶液适量,加入纯水稀释,得10、12.5、25、50、100、150、200、250、300 U/L 酶溶液,分装至EP 管中,置于-20 ℃冰箱中保存备用。
2.1.4 黄嘌呤底物溶液 精密称取黄嘌呤粉末适量,置于50 mL 量瓶中,加入1 mol/L 氢氧化钠适量,超声溶解,最后加入纯水定容至刻度线,得到1.2 mmol/L 底物贮备液,分装至EP 管中,于-20 ℃冰箱保存备用。
2.1.5 尿酸溶液 精密称取尿酸粉末适量,置于25 mL 量瓶中,加入少量PBS,超声溶解,得0.59 mmol/L尿酸对照品溶液。
2.2 反应体系建立
2.2.1 紫外反应体系 设定总反应体系为5 mL。样品组加入各供试品0.2 mL、PBS 2.3 mL、黄嘌呤溶液2.0 mL、黄嘌呤氧化酶溶液0.5 mL以启动反应;以不加黄嘌呤氧化酶溶液作为空白组;以不加供试品溶液为阳性对照组;以不加供试品和黄嘌呤氧化酶溶液作为阴性对照组[8]。
2.2.2 高效液相反应体系 流动相为含1% 甲醇的0.02 mol/L 磷酸二氢钾溶液;洗脱时间15 min;体积流量1.0 mL/min;柱 温25 ℃;检测波长254 nm;进样量10 μL。样品组加入各供试品0.2 mL、PBS 1.3 mL、黄嘌呤溶液2.0 mL、黄嘌呤氧化酶溶液0.5 mL 以启动反应,反应30 min 后加入1 mol/L盐酸中止反应;以不加黄嘌呤氧化酶溶液作为空白组;以不加供试品溶液为阳性对照组;以不加供试品和黄嘌呤氧化酶溶液作为阴性对照组[9]。
2.3 酶活力测定 在“2.2.1”项紫外反应体系中,向试管中加入2.5 mL PBS溶液、2 mL 1.2 mmol/L黄嘌呤溶液,将试管置于25 ℃水浴20 min,加入0.5 mL 50 U/L 黄嘌呤氧化酶溶液,混匀,迅速转移至比色皿中,于紫外分光光度计在200~800 nm 波长处进行扫描,确定尿酸产物特征吸收波长。在同一反应体系中,加入0.5 mL 不同浓度的黄嘌呤氧化酶溶液(10、12.5、25、50、100、150、200、250、300 U/L)以启动反应,酶加入的时间为0 s,每隔1 s 测定吸光度,连续测定10 min,平行测定3 次。单位时间内吸光度增长越大,说明酶的活性越高,以此筛选酶最佳反应浓度。
2.4 反应速率测定 在“2.2.1”项紫外反应体系中,取各供试品(160、80、40、20、10 μg/mL)、2.3 mL PBS 溶液,2 mL 黄嘌呤底物溶液,于25 ℃水浴20 min 后加入0.5 mL 黄嘌呤氧化酶溶液以启动反应,测定其反应速率。
2.5 黄嘌呤氧化酶抑制率及IC50测定 在“2.2.2”
项高效液相反应体系中,样品组加入各提取部位溶液(200.00、100.00、50.00、25.00、12.50、6.25 μg/mL)或别嘌醇溶液(50.00、25.00、12.50、6.25、3.125、1.563、0.781、0.391、0.195 μg/mL),再加入0.5 mL 黄嘌呤氧化酶溶液以启动反应,在25 ℃反应30 min后,加入1 mL 1 mol/L盐酸以终止反应。同时制备空白组、阳性对照组和阴性对照组溶液,各取10 μL 进行分析,采用SPSS 20.0 软件计算抑制率及IC50。
2.6 有效部位抑制类型判断 在“2.2.1”项紫外反应体系中,保持黄嘌呤溶液浓度不变,测定黄嘌呤氧化酶溶液为0.025、0.05、0.10、0.20 U/mL时,不同提取部位各质量浓度(1.0、2.0、4.0 mg/mL)对酶促反应速率的影响。以黄嘌呤氧化酶浓度为横坐标(X),反应速率为纵坐标(Y),判断有效部位对黄嘌呤氧化酶是否为可逆抑制。
3 结果
3.1 检测波长的确定 按“2.3”项下方法操作,制备溶液并转移至比色皿中,在紫外分光光度计中进行多次检测,根据结果选定291 nm 作为尿酸检测波长。
3.2 方法学考察 在“2.2.2”项色谱条件下进样测定,黄嘌呤底物与尿酸产物的保留时间分别为13.1、8.2 min,与其他组分分离度均大于1.5,峰型良好。其中黄嘌呤底物分离度最高,影响最小,故通过测定黄嘌呤的消耗量,以此来反映黄嘌呤氧化酶的活性,见图1。分别吸取适量1.0 mmol/L黄嘌呤溶液进样,重复测定3次,得到标准曲线方程为Y=1 579 588X-4 634,R2=0.999 8,表明黄嘌呤在0.239~7.66 mg/mL 范围内线性关系良好。取1.915 mg/mL 黄嘌呤溶液连续进样测定6次,测得峰面积RSD 为0.21%,表明精密度良好。取1.915 mg/mL 黄嘌呤溶液,每隔2 h 进样测定1次,共7次,测得峰面积RSD 为0.92%,表明溶液在12 h 内稳定性良好。精密吸取3.125 μg/mL别嘌醇溶液,按“2.2.2”项反应体系平行制备6组,测定黄嘌呤峰面积,得质量浓度为3.30 mg/mL,RSD 为1.8%,表明重复性良 好。精密吸取3.125 μg/mL别嘌醇溶液,按“2.2.2”项反应体系加入2 倍黄嘌呤溶液,平行制备6组,测定黄嘌呤峰面积,得平均回收率为101.3%,RSD 为2.1%。
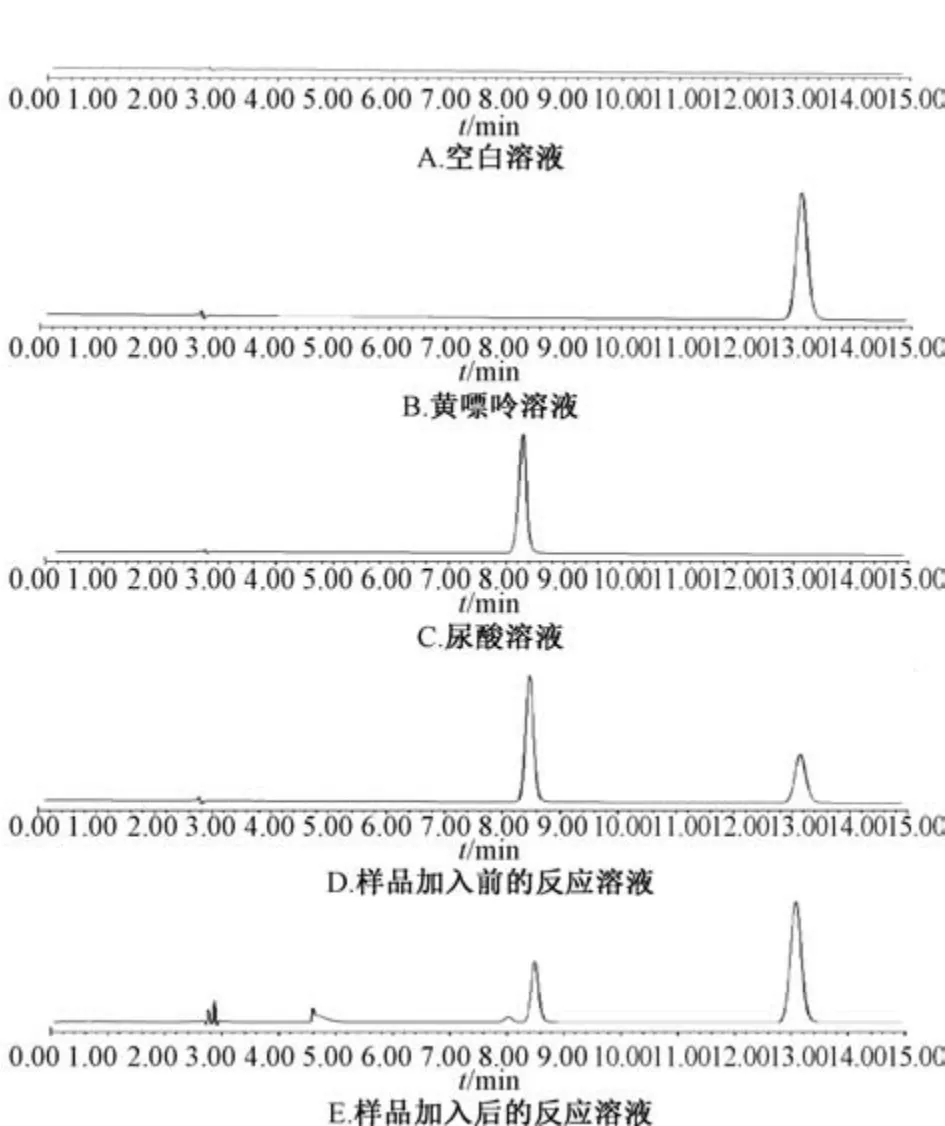
图1 各成分HPLC 色谱图Fig.1 HPLC chromatograms of various constituents
3.3 黄嘌呤氧化酶最佳反应浓度确定 在紫外反应体系中,相同的底物浓度下,不同的黄嘌呤氧化酶浓度其反应速率各不相同,可见随着黄嘌呤氧化酶浓度的增加,酶促反应初速度提高,其初速度和酶浓度呈正相关。当体系中黄嘌呤氧化酶浓度为10、12.5、25 U/L时,反应1 min 后速率趋向于零,可能因为黄嘌呤氧化酶浓度较低,与黄嘌呤底物反应后迅速失活导致。当黄嘌呤氧化酶浓度为200、250 U/L时,随着反应时间推移,反应速率显著降低,可能是由于黄嘌呤氧化酶浓度偏高,体系中底物消耗,导致速率降低。当体系中黄嘌呤氧化酶浓度为50、100、150、200 U/L时,反应速率都具有下降的趋势,但其中黄嘌呤氧化酶浓度为50 U/L 时的前5 min,变化幅度最小,因此用该条件进行下一步研究,见图2。

图2 黄嘌呤氧化酶浓度对反应速率的影响Fig.2 Effects of xanthine oxidase concentration on reaction rate
3.4 各提取部位对反应速率的影响 在黄嘌呤氧化酶浓度为50 U/L 的紫外反应体系中,加入桑寄生各提取部位,测定5 min 内平均反应速率,见图3。随着桑寄生质量浓度的增加,酶促反应速率均有不同程度的降低,说明各提取部位对黄嘌呤氧化酶抑制作用呈现一定量效关系。其中乙酸乙酯和正丁醇部位为6.25~100 μg/mL时,酶促反应速率显著降低,为100~200 μg/mL 时反应速率趋于平稳;石油醚和三氯甲烷部位对反应速率的影响较小。
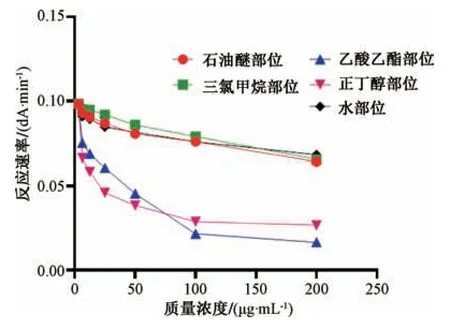
图3 提取部位对反应速率的影响Fig.3 Effects of extraction site on reaction rate
3.5 各提取部位对抑制率影响 随着桑寄生质量浓度的增加,其对黄嘌呤氧化酶的抑制率不断升高,说明对黄嘌呤氧化酶的抑制作用表现出一定的剂量依赖性,见表1。当质量浓度为0~100 μg/mL时,乙酸乙酯和正丁醇部位抑制率增长,为100 μg/mL时抑制率超过50%;其余部位对黄嘌呤氧化酶的抑制率较低。由表1 可知,石油醚部位、三氯甲烷部位、乙酸乙酯部位、正丁醇部位、水部位的IC50分别为338、466、73、67、1 424 μg/mL,可见乙酸乙酯和正丁醇部位的IC50远低于其他部位,因此选取乙酸乙酯部位和正丁醇部位进行后续实验。
表1 不同提取部位的抑制率(,n=3)Tab.1 Inhibition rates of different extraction sites(,n=3)
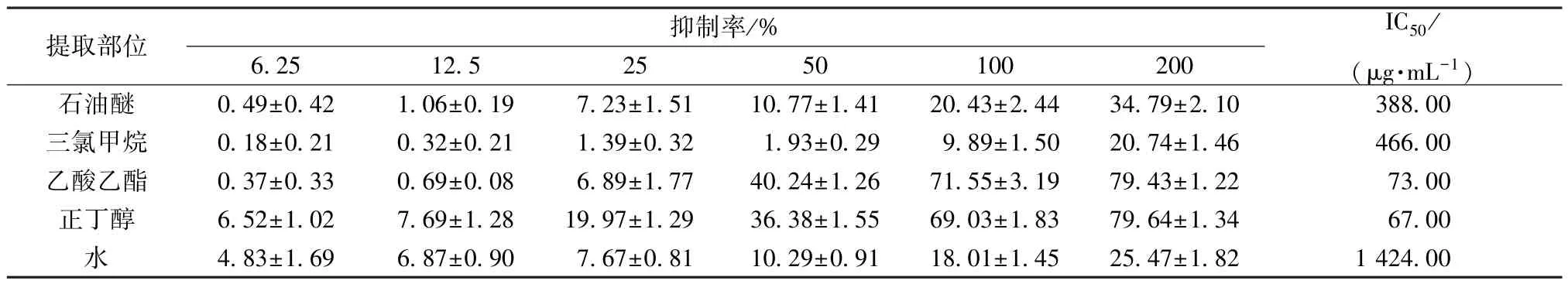
表1 不同提取部位的抑制率(,n=3)Tab.1 Inhibition rates of different extraction sites(,n=3)
3.6 乙酸乙酯和正丁醇部位对黄嘌呤氧化酶抑制率的影响 桑树为寄主的桑寄生乙酸乙酯和正丁醇部位的IC50均小于100 μg/mL,其中当各样品质量浓度大于100 μg/mL时,抑制率均大于50%。南宁产地的桑寄生乙酸乙酯部位质量浓度为200 μg/mL时,抑制率超过90%,其IC50值最小,为32.18 μg/mL;以河池产地的桑寄生正丁醇部位IC50值最高,为99.67 μg/mL。测定9 批不同寄主的桑寄生药材乙酸乙酯和正丁醇部位对黄嘌呤氧化酶的抑制率,结果得枫树上的桑寄生正丁醇部位质量浓度为200 μg/mL时,抑制率超过90%;其乙酸乙酯部位IC50值最低,为44.68 μg/mL。此外,除桑树、枫树、黄皮树上的桑寄生正丁醇部位和桃树、大叶冬青上的桑寄生乙酸乙酯部位外,其余寄主上的桑寄生乙酸乙酯和正丁醇部位IC50均大于100 μg/mL,见表2~3。
表2 不同产地桑寄生不同提取部位的抑制率(,n=3)Tab.2 Inhibition rates of different extraction sites from different origin of Taxilli Herba(,n=3)
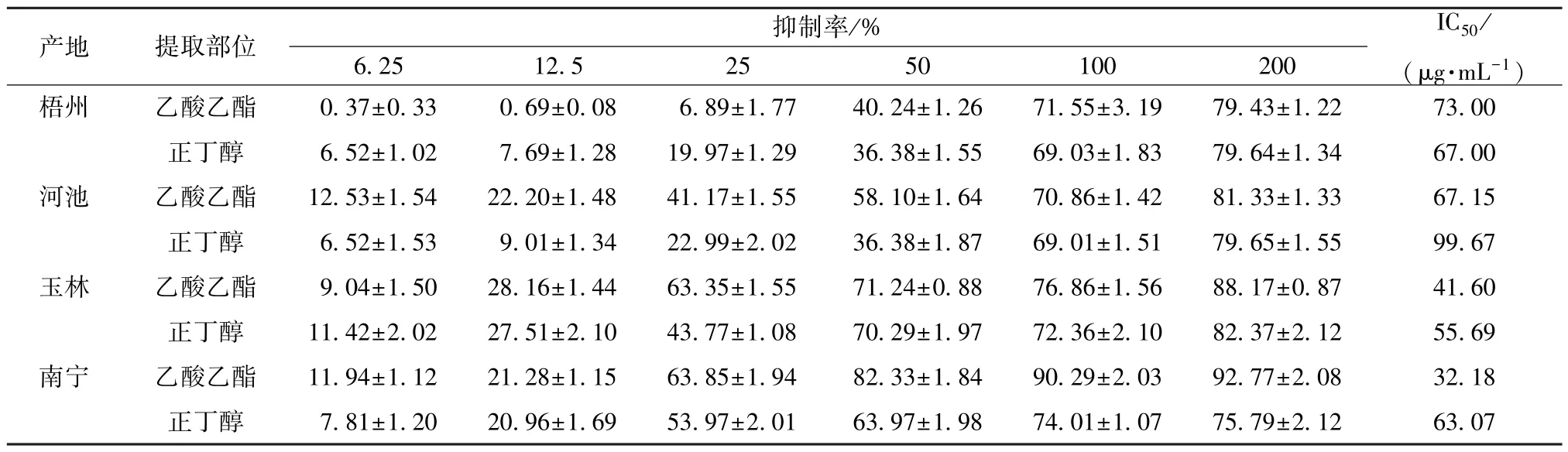
表2 不同产地桑寄生不同提取部位的抑制率(,n=3)Tab.2 Inhibition rates of different extraction sites from different origin of Taxilli Herba(,n=3)
3.7 黄嘌呤氧化酶抑制类型 图4 中各直线基本相交于原点,表明桑寄生乙酸乙酯和正丁醇部位对黄嘌呤氧化酶的抑制作用为可逆性抑制。
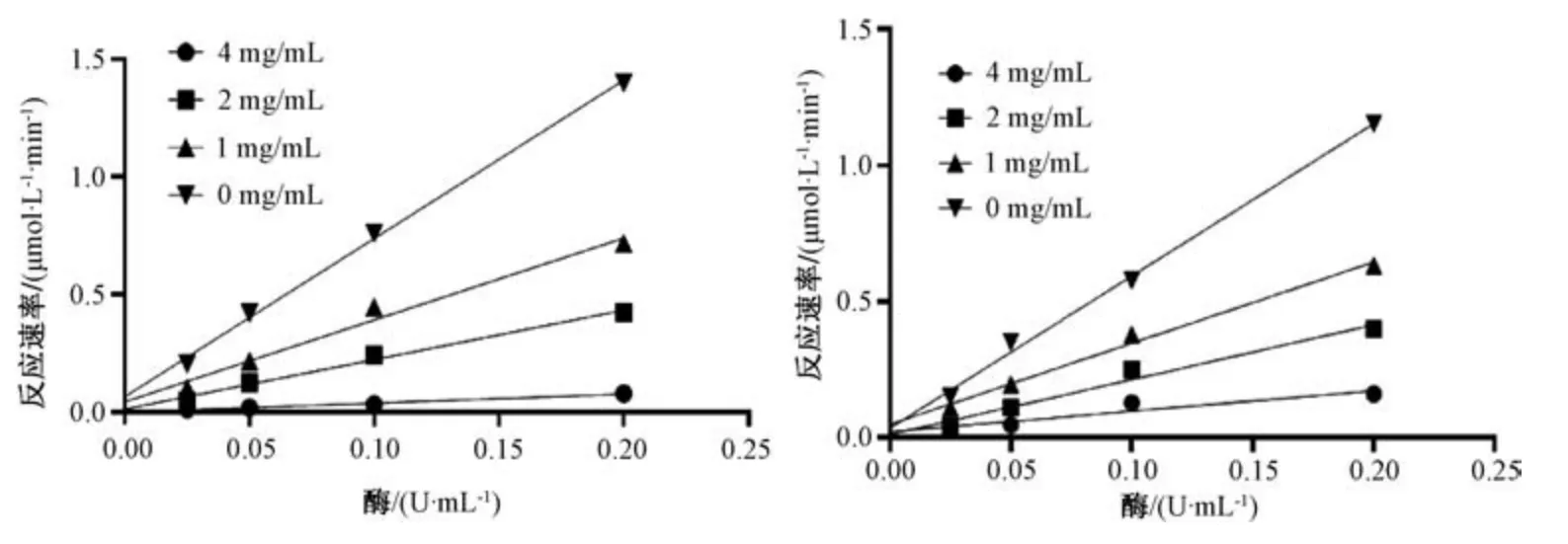
图4 乙酸乙酯和正丁醇部位对黄嘌呤氧化酶的抑制作用Fig.4 Inhibitory effects of ethyl acetate and n⁃butanol moieties on xanthine oxidase
4 讨论
黄嘌呤氧化酶为一种分布于脏器和血管的钼羟化酶,是能催化次黄嘌呤与黄嘌呤使之产生尿酸的关键酶[10⁃11]。当嘌呤代谢紊乱时,尿酸易积聚在各脏腑和关节中,引发高尿酸或痛风疾病。治疗手段多采用黄嘌呤氧化酶抑制剂来降低黄嘌呤氧化酶活性,进而减轻尿酸引起的危害。黄嘌呤氧化酶抑制剂的筛选[12⁃13]主要通过紫外分光光度法来检测酶促反应速率及相关酶动力学常数,但在以中药作为检测对象时,因其所含化合物众多,在紫外光下多具有较强的吸收,易超出仪器的检测灵敏范围,同时由于其专属性差,容易出现假阳性或假阴性的结果。可通过高效液相色谱法来分离样品成分、黄嘌呤底物和尿酸产物,从而建立其专属性检测[9]。本实验采用建立紫外与高效液相结合的方法,通过HPLC 的专属性来筛选出活性部位,并采用UV 法来探究其对黄嘌呤氧化酶的相关酶促反应动力学指数。利用该方法,初步证明桑寄生乙酸乙酯和正丁醇部位对黄嘌呤氧化酶具有较强的抑制活性,并且该抑制类型为可逆性抑制。同时,除桑树外,桑寄生亦可在多种植物上生长[14⁃16],因此本研究考察了几种常见植物[17]上的桑寄生对黄嘌呤氧化酶活性的抑制水平,结果发现,除枫树、桃树、黄皮树和大叶冬青这4 种植物外,其余植物上的桑寄生药材IC50均大于100 μg/mL,少数植物达到200 μg/mL 以上,证明了桑寄生对黄嘌呤氧化酶抑制活性受到寄主植物的影响,且以桑树为寄主的抑制作用最强。
表3 不同寄主的桑寄生不同提取部位的抑制率(,n=3)Tab.3 Inhibition rates of different extraction sites from different hosts of Taxilli Herba(,n=3)

表3 不同寄主的桑寄生不同提取部位的抑制率(,n=3)Tab.3 Inhibition rates of different extraction sites from different hosts of Taxilli Herba(,n=3)

