lncRNA⁃DINO靶向miR⁃141调控Keap1⁃Nrf2通路促进非小细胞肺癌化疗耐药的机制研究
夏瑶,徐蕾,唐志贤,谢春发,朱慎钰*
目前,肺癌的发病率和病死率均居各种肿瘤之首[1,2]。肺癌的主要病理类型包括非小细胞肺癌(non⁃smal1 cell lung cancer,NSCLC)和小细胞肺癌两大类,其中非小细胞肺癌占肺癌总数的85%左右,多数患者确诊时已为晚期,5年生存率极低[3]。化疗是晚期非小细胞肺癌全身治疗的主要手段,但是在治疗过程中,常常出现NSCLC细胞对多种化疗药物的抵抗,即化疗耐药[4]。因此,非小细胞肺癌的化疗耐药,成为治疗失败的主要原因和临床医生面临的重大挑战。长链非编码RNA(long non⁃coding RNA,lncRNA)曾经被认为是基因中没有功能的部分,但近年的研究发现,ln⁃cRNA可在多个水平参与基因表达调控,影响生长发育、细胞增殖、分化、代谢和凋亡等[5]。lncRNA的异常表达与肿瘤的发生、发展、侵袭及转移密切相关[6]。由于人类细胞中lncRNA种类众多、数量庞大,目前对lncRNA功能的研究还远远不够[7]。了解lncRNA在非小细胞肺癌耐药中的作用,并探索以其为调控靶点,意义重大。
1 材料与方法
1.1 一般资料
选择2020年1月至2020年6月在赣南医学院第一附属医院心胸外科进行化疗的NSCLC患者。对初治、化疗敏感的NSCLC患者行肿瘤组织活检,活检后立即液氮保存。纳入标准:均属于原发性NSCLC患者;均对初治、化疗敏感的NSCLC患者。排除标准:继发性肺癌患者;合并有其他癌症患者;对初治、化疗不敏感的NSCLC患者;凝血功能异常或有出血倾向者。本研究已通过医院伦理委员会审核批准;患者及家属均对本研究知情同意,并自愿签署知情同意书。
1.2 方法
1.2.1 RT⁃PCR,Western⁃blot技术对比检测A549与A549/DDP差异将A549细胞株和A549/DDP细胞株进行细胞培养,使用Trizol(Invitrogen公司)法提取总RNA,用lncRNA芯片对比检测两组细胞株间LncRNA的表达差异。通过在线软件(RNAhy⁃brid)预测和计算。将A549细胞株和A549/DDP细胞株进行细胞培养,使用Trizol(Invitrogen公司)法提取总RNA,RT⁃PCR验证两组细胞株间DINO、miR⁃141、Keap1、Nrf2、HO⁃1、NQO1。提取A549细胞株和A549/DDP细胞株的蛋白,采用Western⁃blot技术检测Keap1、Nrf2、HO⁃1、NQO1蛋白表达水平。
1.2.2 构建慢病毒表达载体上调、下调目的基因设计有效干扰DINO的序列,构建低表达DINO慢病毒表达载体、过表达DINO慢病毒表达载体,转染A549细胞株得到低表达DINO细胞株(A549⁃siDINO)、过表达DINO细胞株(A549⁃DINO),采用RT⁃PCR检测DINO、miR⁃141、Keap1、Nrf2、HO⁃1、NQO1表达,Western⁃blot技术检测Keap1、Nrf2、HO⁃1、NQO1的蛋白表达水平,MTT法检测细胞对化疗药物敏感性的改变。构建低表达miR⁃141慢病毒表达载体、过表达miR⁃141慢病毒表达载体,转染A549细胞株得到低表达miR⁃141细胞株(A549⁃simiR⁃141)、过表达miR⁃141细胞(A549⁃miR⁃141),采用RT⁃PCR检测miR⁃141、Keap1、Nrf2、HO⁃1、NQO1表达,Western⁃blot技术检测Keap1、Nrf2、HO⁃1、NQO1的蛋白表达水平。
1.3 统计学处理
对所有统计资料采用SPSS 13.0软件包进行统计分析:计量资料以均数±标准差()表示,组间比较采用t检验或方差分析,率的比较采用χ2检验,使用析因方差分析数据相关性。P<0.05为差异有统计学意义。
2 结果
2.1 lncRNA DINO与肺腺癌细胞株顺铂敏感性
将对顺铂耐药的肺腺癌细胞株A549/DDP与敏感的肺腺癌细胞株A549对比,提取总RNA进行lncRNA的芯片检测。结果发现,A549/DDP与A549细胞相比,399个lncRNA发生2倍以上的变化(156个下调,243个上调)。其中下调显著lncRNA中,包括新的lncRNA DINO,见图1A。RT⁃PCR对比检测腺癌耐药株A549/DDP与敏感株A549中DINO的表达差异显示,与肺癌敏感株A549相比,DINO在耐药株A549/DDP中表达显著降低(P<0.05),见图1B。
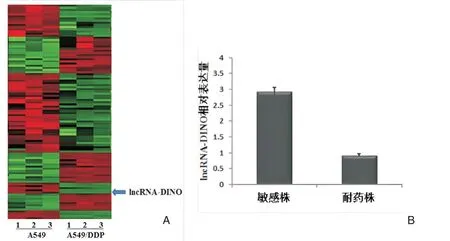
图1 顺铂耐药的肺腺癌细胞株lncRNA DINO表达水平下降
2.2 A549与A549⁃DINO细胞对顺铂的敏感性及miR⁃141与DINO的结合
合成DINO基因并克隆于逆转录病毒表达载体中,包装病毒后感染A549细胞,建立稳定过表达DINO的A549细胞株,命名为A549⁃DINO。MTT法对比检测A549与A549⁃DINO细胞对顺铂的敏感性差异。结果显示A549⁃DINO细胞对化疗药物顺铂的敏感性增高,耐药性降低(P<0.05),见图2A。通过在线软件预测和计算,发现DINO与miR⁃200a,miR⁃141,miR⁃200b等均可能结合,其中与miR⁃141的结合可能性最高。miR⁃141与DINO的配对位点和结合的二级结构,见图2B。

图2 A549⁃DINO细胞对顺铂敏感性增高;DINO与miR⁃141的结合可能性最高
2.3 miR⁃141、miR⁃200a、miR⁃200b、miR⁃200c、miR⁃429的表达
RT⁃PCR对比检测A549、A549/DDP中miR⁃141、miR⁃200a、miR⁃200b、miR⁃200c、miR⁃429的表达,发现A549/DDP中miR⁃141和miR⁃200c的表达明显升高,其中miR⁃141的升高更为显著,而其他microRNA的表达变化不明显(P<0.05),见图3A。在稳定过表达DINO的A549⁃DINO细胞和A549细胞中,RT⁃PCR对比检测miR⁃141、miR⁃200a、miR⁃200b、miR⁃200c、miR⁃42的表达,发现过表达DINO后miR⁃141表达下降,而其他microRNA的表达变化不明显。结果提示DINO可能是通过调控miR⁃141表达发挥作用的,见图3B。

图3 过表达DINO的A549⁃DINO胞中miR⁃141表达下降
2.4 A549、A549⁃DINO及A549⁃miR⁃141细胞中基因的表达差异
RT⁃PCR对比检测A549细胞和过表达DINO的A549⁃DINO细胞中,miR⁃141、Keap1、Nrf2、HO⁃1和NQO1的表达差异。结果证明过表达DINO后,miR⁃141表达下降,Keap1表达上调,Nrf2、HO⁃1和NQO1表达下调(P<0.05)。该结果证明DINO调控miR⁃141,进而调控Keap1⁃Nrf2通路的可能性,见图4A。将miR⁃141克隆入表达载体,转染A549细胞以过表达miR⁃141,命名A549⁃miR⁃141。而后RT⁃PCR对比检测A549和A549⁃miR⁃141细胞中Keap1、PTEN、MSH2等其可能靶基因的表达差异。结果发现,过表达miR⁃141后,Keap1基因表达明显下降,而其他基因表达无明显变化(P<0.05)。提示miR⁃141可能是通过调控Keap1基因的表达而发挥作用的,见图4B。
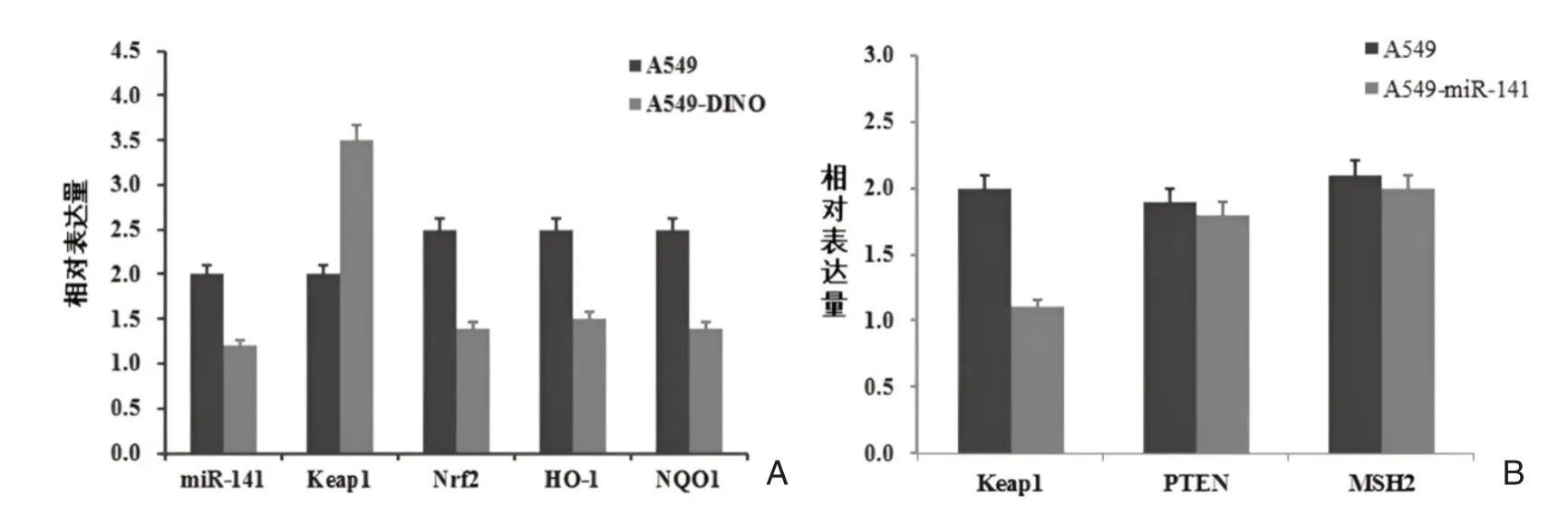
图4 A549⁃miR⁃141细胞中Keap1基因表达明显下降
2.5 Keap1、Nrf2和其下游基因HO⁃1、NQO1的表达差异
RT⁃PCR对比检测A549和A549⁃miR⁃141细胞中Keap1、Nrf2和其下游基因HO⁃1、NQO1的表达。结果证明过表达miR⁃141后,Keap1基因的表达下调,而Nrf2和其下游基因HO⁃1、NQO1表达上调(P<0.05),见图5A。Western⁃blot检测A549和A549⁃miR⁃141细胞中Keap1、Nrf2和其下游基因HO⁃1、NQO1蛋白表达水平,见图5B。
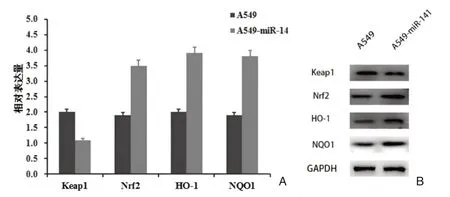
图5 过表达miR⁃141的A549⁃miR⁃141细胞中Keap1表达下调
3 讨论
肺癌是最常见的恶性肿瘤之一,肺癌发病率和病死率是癌症中增长最快的[8,9]。化疗是晚期非小细胞肺癌全身治疗的主要手段,在治疗过程中,经常出现对多种化疗药物的耐药。但DINO与肿瘤耐药的关系目前尚无研究报道。为了深入研究DINO对NSCLC化疗耐药的作用,在该研究中以RT⁃PCR法检测DINO表达,证实DINO在耐药细胞株中表达明显降低。Chang等学者[10]在Nature Genetics报道,DNA损伤可诱导CDKN1A基因上游转录出一长链非编码RNA,命名为DINO(damage induced noncoding),在人类细胞DNA受损伤时,DINO表达上调,并通过结合和稳定p53蛋白而促进损伤修复通路或细胞凋亡。进一步研究发现,通过合成、克隆和转染,在A549细胞中过表达DINO后,细胞对顺铂的敏感性显著提高。因此,我们推测,DINO的表达降低,可能促进了非小细胞肺癌的耐药。进一步实验证明,耐药的NSCLC细胞株中DINO表达较敏感细胞显著降低,过表达DINO使肿瘤细胞对化疗的敏感性增加。
lncRNA调控基因表达的机制中,最常见的是竞争性结合某些miRNA,成为miRNA的“吸附海绵”,从而调节游离miRNA的含量,进而影响靶基因的表达[11]。前期实验结果显示,DINO是通过与miR⁃141结合而发挥作用的。miRNA⁃141是miR⁃NA⁃200家族的一员,该家族由于与肿瘤的EMT和转移密切相关而“知名”[12,13]。miRNA⁃141与肿瘤的耐药关系,目前只有少数研究报道[14,15]。为进一步研究,对miRNA⁃141进行了生物信息学预测分析,发现过表达miR⁃141导致NSCLC细胞中Keap1(kelch like ECH associated protein 1)基因表达明显下降(P<0.05),而PTEN和MSH2的表达无明显改变。
Keap1是Nrf2,即人类NF⁃E2相关因子2(nu⁃clear factor E2⁃related fator 2)的胞质结合蛋白,Keapl⁃Nrf2信号通路在抗氧化应激过程中起重要作用[16]。在氧化应激等情况下,Keapl蛋白发生结构改变,引起Keapl和Nrf2解离,Nrf2激活入核,启动抗氧化反应元件(antioxidant response element,ARE)调控的Ⅱ相解毒酶、抗氧化酶等基因表达,增加细胞对氧化应激的抗性[17]。Keapl⁃Nrf2通路在保护细胞免受自由基损伤、防止细胞凋亡方面有着十分重要的意义[18]。最新的研究发现,肿瘤细胞在接受顺铂等化疗药物治疗时,细胞中ROS水平升高,可以促进DNA断裂等损伤,导致肿瘤细胞的死亡。而肿瘤细胞内游离Nrf2若上调,可激活ARE,促进抗氧化酶等基因表达,加速细胞内ROS的清除,可提高肿瘤细胞对化疗药物的耐受性,促进肿瘤细胞的耐药[19,20]。我们进一步研究发现在A549细胞株中过表达miR⁃141后,Keap1基因的表达下调,而Nrf2和其下游基因HO⁃1、NQO1表达上调。
实验结果显示,miR⁃141可能通过靶向Keap1基因而调控Keap1⁃Nrf2通路。RT⁃PCR对比检测发现,与A549细胞相比,过表达miR⁃141的A549⁃miR⁃141细胞中Keap1基因表达明显下降(P<0.05),而PTEN和MSH2表 达无 明 显变 化。RT⁃PCR对比检测显示,与A549细胞相比,A549⁃miR⁃141细胞中Keap1基因的表达下调,而Nrf2基因和其下游HO⁃1、NQO1基因表达显著上调(P<0.05)。正常情况下,Nrf2与Keapl结合被抑制,并与肌动蛋白结合被锚定在细胞浆中。在氧化应激等情况下,Keapl蛋白发生结构改变,引起Keapl和Nrf2解离,Nrf2激活入核,启动抗氧化反应元件ARE调控的基因表达。
综上所述,本研究表明非小细胞肺癌中ln⁃cRNA⁃DINO可靶向结合miR⁃141,进而调控Keap1⁃Nrf2通路而导致细胞的化疗耐药。即DINO低表达导致细胞内miR⁃141丰度升高,引起Keap1基因表达下调,从而促进细胞浆内Nrf2入核增加,激活其下游基因群的表达,从而促进肿瘤化疗耐药。阐明DINO在非小细胞肺癌化疗耐药中的作用机制,并为以DINO和miR⁃141为靶标设计逆转耐药策略提供科学依据。

