腹腔镜肝切除治疗肝细胞癌的安全性和长期疗效观察
罗发,严庆,陈焕伟,*
肝细胞癌是全球第四大最常见的恶性肿瘤,也是全球上升最快的癌症相关死亡原因,病死率位于恶性肿瘤的第二位[1]。手术切除一直是其最重要的治疗手段,但预后较差,5年复发率高达67.4%,5年的生存率低于50%[2]。随着微创技术的发展,腹腔镜肝切除治疗肝细胞癌的报道越来越多,但对于腹腔镜肝切除治疗肝细胞癌的安全性及疗效仍存在着一定的争议,目前的文献报道大多数都是短期疗效观察,对于其中长期疗效仍缺乏循证医学上的支持和印证。本研究回顾性分析本中心2014年至2019年间行腹腔镜肝切除治疗肝细胞癌患者的临床资料,观察其安全性及长期疗效,并结合相关文献进行讨论。
1 资料与方法
1.1 临床资料
回顾性分析2014年1月至2019年12月间在佛山市第一人民医院诊治的197例肝细胞癌患者临床资料,纳入标准:①病例临床资料客观完整,诊疗过程科学合理,符合国际诊疗指南;②在本中心诊断为肝细胞癌并且行腹腔镜肝切除手术的病人;③术后病理明确诊断为肝细胞癌;④患者及家属均积极配合治疗及随访信息真实可靠。排除标准:①术后病理提示局灶结节增生等良性肝脏占位性病变;②术后病理提示为胆管细胞癌或者胆管细胞癌和肝细胞癌混合型癌。共纳入197例肝细胞癌患者,男性158例,女性39例,平均年龄(53.8±12.2)岁。平均肿瘤最大径(4.3±2.9)cm,所有病例诊断均经术后病理证实为肝细胞癌。所有病例均签署由医院伦理委员会批准同意的手术知情同意书,符合医学伦理学规定。术前分期根据原发性肝癌诊疗规范(2019版)的中国肝癌分期(China liver cancer staging,CNLC),其中CNLC Ia期140人,CNLC Ib期50人,CNLC IIa期及以上7人。
1.2 术式及操作
主要根据肿瘤位置及术中条件行相应的腹腔镜肝段、亚肝段或半肝切除。全身麻醉后,常规消毒铺巾,于脐下置入腹腔镜做观察孔,建立12~14 mmHg气腹。病人取头高足低30°卧位。上腹部操作孔建立3~4个。主要手术过程:①常规腹腔镜B超探查肝脏,通过与术前影像学检查,核对及确定肿瘤位置及与主要血管的关系,并于肝脏表面标记好手术切缘;②游离肝脏周围主要韧带;③根据术式进行选择性肝脏血流阻断;本中心多采用Glission鞘外法:左右肝蒂鞘外阻断,右前叶、右后叶肝蒂鞘外阻断,肝Ⅱ、Ⅲ、Ⅳ段鞘外阻断。④选择超声或超吸刀配合百克钳进行肝实质的离断,粗的肝静脉或肝蒂使用切割闭合器进行离断;⑤断肝平面电凝或缝扎止血;⑥观察15 min断肝平面,如无出血和胆漏,再用止血纱覆盖即可,并放置引流。
1.3 术后随访
术后随访按照2020版腹腔镜肝切除术治疗肝细胞癌专家共识:术后2年内每2~3个月随访1次,术后2年后每3~6个月随访1次,复查内容包括肝功能、甲胎蛋白及影像学检查(B超、腹部CT、腹部MRI)。随访日期截至2021年6月1日。
1.4 统计分析方法
分析所有纳入患者的临床资料,包括手术时间,中转开腹率,术中出血及术中输血量,术后并发症(术后出血、胆漏、肝衰竭、腹腔感染、腹腔积液、胸腔积液、肺部感染、切口感染等),术后平均住院时间,肿瘤复发率,无瘤生存率,术后1、3、5年总的生存期。并用统计学方法对上述数据进行相关分析。采用SPSS 25.0 for windows统计软件进行数据分析,术后生存期、无瘤生存期的分析采用Kaplan⁃Meier法。检验水准α=0.05。
2 结果
本研究中纳入患者的手术方式分布如下(表1):腹腔镜左半肝切除23例,腹腔镜右半肝切除25例,腹腔镜扩大右半肝切除1例,腹腔镜扩大左半肝切除1例,腹腔镜左外叶切除36例,腹腔镜左内叶切除9例,腹腔镜右后叶切除9例,腹腔镜扩大右后叶切除7例,腹腔镜肝中叶切除33例,腹腔镜尾状叶切除3例,腹腔镜S7段切除4例,腹腔镜S8段切除9例,腹腔镜S6、7、8段切除3例,腹腔镜S2段切除2例,腹腔镜S3段切除5例,腹腔镜S5、6段切除27例。

表1 手术方式情况统计(n=197)
术中情况:纳入患者平均术中出血量为263.59±252.9 mL,平均手术时间为320.5±119.56 min。术中输血8例(4%),输血量中位数为600 mL(400~1600 mL)。
术后并发症情况(表2):本研究围手术期死亡1例,死于术后肝衰竭,无术后伤口感染,无Troca孔种植转移,无空气栓塞;术后发生腹腔积液9例,术后胸腔积液9例,术后胆漏3例,术后出血4例,术后肺炎发生2例。总体并发症发生率为14.2%(28/197)。术后平均住院时长为8.9±3.63 d。
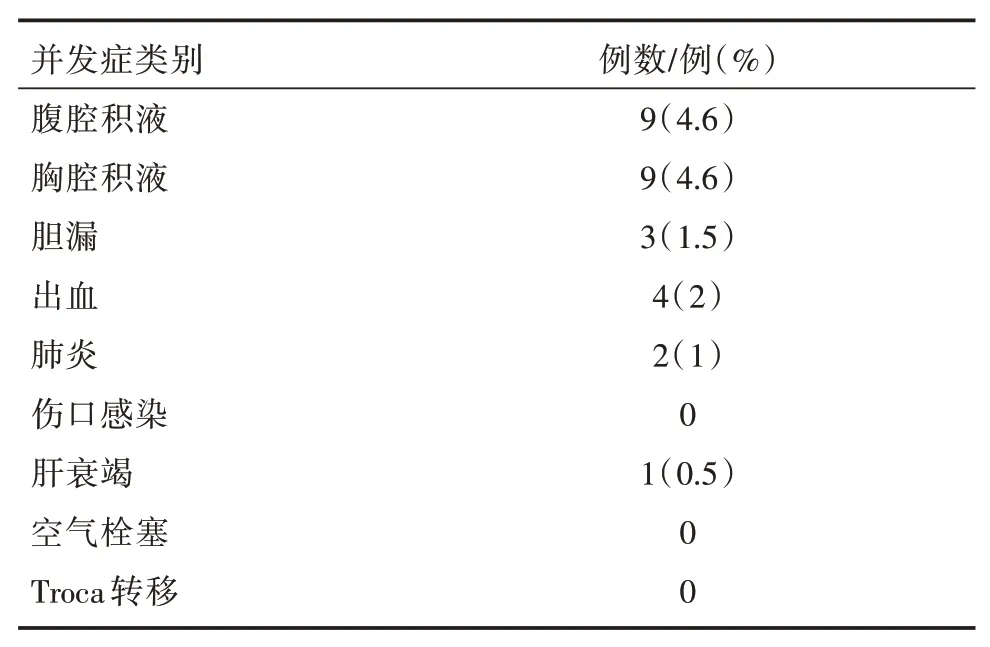
表2 术后并发症发生情况
术后病理结果均提示为肝细胞癌,所有患者均为R0切除,其中术后TMN分期中Ⅰa期35人,Ⅰb期103人,Ⅱ期58人,Ⅲa期2人,Ⅲb期1人。所有病例肝切缘均值为1.74±1.07 cm,窄切缘(<1 cm)的例数为27例(13.7%),中宽切缘(≥1 cm)的例数为170例(86.3%)。
随访至2021年6月1日,共有67例患者发生肿瘤复发,复发后患者接受射频消融、TACE、再次手术切除、肝移植及免疫靶向等治疗。患者术后1、3、5年总生存率分别为96.3%、86.8%、83.6%(图1)。患者整体无瘤中位生存时间为78个月,术后1、3、5年无瘤生存率分别84.2%、65.2%、59.4%(图2)。
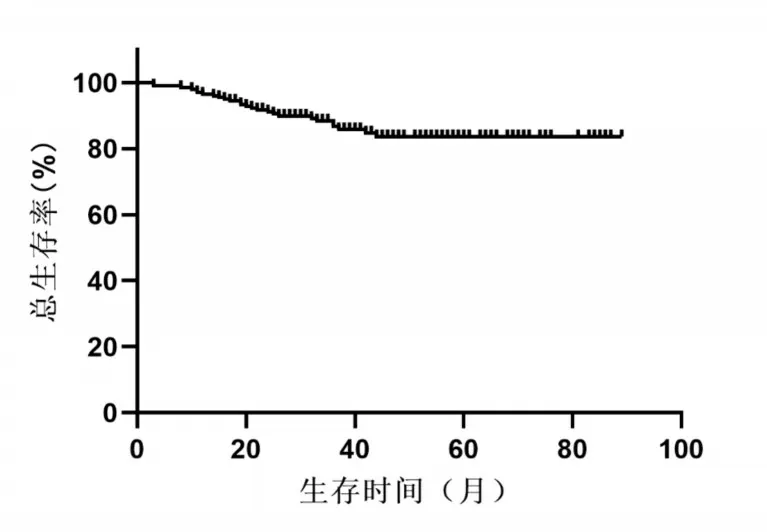
图1 腹腔镜肝切除患者术后总体生存情况
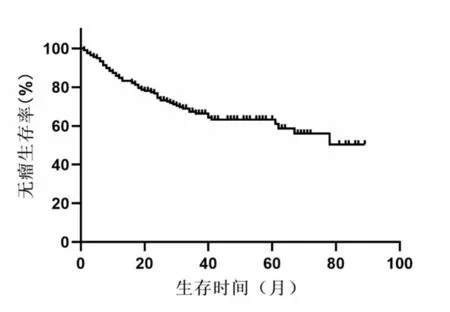
图2 腹腔镜肝切除患者术后无瘤生存情况
3 讨论
自1994年周伟平教授报道国内第一例腹腔镜肝切除以来[3],腹腔镜技术在肝脏外科发展迅猛,在临床中已广泛开展。腹腔镜肝切除治疗肝细胞癌的安全性及长期肿瘤疗效一直备受关注。由于受各种客观因素及临床相关伦理审查的限制,国内外对于腹腔镜肝切除与开放肝切除治疗肝细胞癌对比的RCT研究鲜有报道,大部分都是回顾性地研究观察手术安全性和近期疗效,缺乏多中心的大型RCT研究及术后长期随访数据。
随着腹腔镜技术的不断发展,腹腔镜肝切除治疗肝细胞癌的适应症也在逐渐扩展。2008年美国Louisville共识中认为腹腔镜肝切除最佳的适应证是指位于肝脏Ⅱ、Ⅲ、Ⅳ、Ⅴ和Ⅵ段≤5 cm的单发肿瘤[4],目前腹腔镜肝切除治疗肝癌中国专家共识(2020版)[5]认为肿瘤大小>10 cm的也可在有经验的中心行腹腔镜肝切除术。在肿瘤部位方面,各个肝段的腹腔镜解剖性肝切除在有经验的中心也都能开展[6]。2015年在日本盛冈举行的世界腹腔镜肝切除大会上更是提出根据肿瘤位置、切除范围、肿瘤大小、与周围管道关系以及术前肝功能评级制订了难度系数评价系统,以指导各级外科医师开展不同难度系数的手术[7]。并且随着设备的不断更新以及各种能量器械的应用,缩短了腹腔镜肝切除手术的学习曲线,进一步提升了腹腔镜肝切除手术的安全性。
腹腔镜肝切除术的安全性主要与下列因素相关:①如何保证足够的手术切缘;②术中出血的控制;③空气栓塞及种植转移的风险;④术后并发症的发生率。
在肝脏肿瘤手术切缘方面,既往一直是依靠二维影像学检查加上术者自身的手术经验及空间想象力。而现在,随着三维可视化技术及设备的不断更新,通过术前3D重建及剩余肝脏体积的精准评估,从而使得术后发生肝衰风险大大降低,提升了手术的安全性[8]。除了术前影像学检查的帮助,在术中,更是能通过术中超声定位及吲哚氰绿(indocyanine green,ICG)荧光成像系统,进行准确的肿瘤定位,确定手术切缘,并且能发现术前未能发现的一些微小病灶[9,10]。本中心大多数病例在确定切缘方面都是依靠术中超声定位肿瘤并在肝脏表面做好标记线或者是通过Glisson鞘外解剖,根据缺血线实现解剖性肝段、亚肝段以及半肝的切除[11,12]。
对于术中出血控制问题,随着手术技术的不断提升以及经验的不断积累目前已得到显著改善,另外能量器械的合理应用也是减少术中出血的重要手段。本研究术中出血量为(263.59±252.9)mL,术中输血8例(4%),输血中位数为600 mL(400~1600 mL),而我们中心更是提出腹腔镜下通过下降肝门板Glisson鞘外解剖实施区域性血流阻断用于半肝以及各肝段切除[13]。对于肝静脉出血目前主要是通过控制性低中心静脉压技术来实现,其相关研究也已经证实其对减少术中出血有着较大的作用[14,15]。
对于空气栓塞及种植转移,通过检索国内外的相关报道,两者的发生率都是极低的。腹腔镜手术中建立的气腹环境,当出现相关粗的肝静脉出血,因为其腹内压及建立的低中心静脉压导致的压力差,更加容易导致空气栓塞。术中出血的及时处理以及手术技巧的提升对于预防空气栓塞的发生极为关键。至于肿瘤种植转移的发生也是与建立气腹相关的烟囱效应有关,因此术中注意无瘤原则显得极为重要。
在手术并发症方面,肝切除术后较为严重并发症为术后出血、胆漏及肝衰。本组术后发生胆漏3例;术后出血4例;无术后肝衰发生。对于术后胆漏的发生,目前各中心数据不尽相同,大体范围为3.6%~33.3%,Smith等通过纳入1388例患者,统计胆漏发生率为39例(2.8%)[16],本组胆漏发生率为1.5%(3/197)。Troisi等报道腹腔镜肝切除手术主要并发症总体发生率为7%,而开腹肝切除为21%[17];日本学者通过纳入来自66个中心的4122名患者,统计得出主要并发症发生率为5%[18],本组统计的主要并发症发生率为8.1%(16/197)。以上研究结果均显示腹腔镜肝切除术后并发症发生率要低于开腹肝切除术,这可能与腔镜下视野放大,能够更精细地进行止血、缝合等操作有关。
除手术的安全性外,腹腔镜肝切除术的远期疗效也值得关注。通过检索国际上相关文献报道发现,多个中心的报道均提示腹腔镜肝切除与开腹肝切除术后患者总体生存情况无统计学差异[19-21]。Cheung等通过比较209例腹腔镜手术病例与627开腹手术病例,腹腔镜组的1、3、5年生存率分别为98.3%、90.5%、82.4%,1、3、5年无瘤生存率为分别为84.1%、60%、54.6%[22]。Yoon等报道264例腹腔镜手术病例与2071例开腹手术病例,其腹腔镜组的1、3、5年总生存期为98.1%、87.0%、78.6%,其1、3、5年无瘤生存率分别为81.0%、62.0%和49.1%[23]。Wu等报道纳入腹腔镜和开腹组各86例,其腹腔镜组的1、3、5年总生存率为93.0%、81.4%和69.8%,开腹组的1、3、5年总生存率为88.4%、75.5%和62.8%,认为腹腔镜组与开腹组肿瘤远期疗效无显著差异[24]。本研究共纳入197例肝细胞癌患者,术后1、3、5年总生存率分别为96.3%、86.8%、83.6%。无瘤中位生存时间为78个月,术后1、3、5年无瘤生存率分别为84.2%、65.2%、59.4%;从术后生存结果来看,本研究中腹腔镜肝切除患者术后的5年总生存率和无瘤生存率均略高于国际上的报道,这可能与选择的病例中肿瘤早期的患者比例较高有一定的相关性,术后TMN分期中Ⅰ期患者占比高达70%;这也提示腔镜肝切除对于早期肝癌患者的疗效更佳。Tsai等[25]也认为腹腔镜肝切除与开腹肝切除长期疗效相当,但对于早期肝癌,接受腹腔镜肝切除手术的病人能有更好的获益。
总的来说,腹腔镜肝切除治疗肝细胞癌不仅能减少术中出血、降低术中输血率、减少围手术期并发症的发生率,缩短住院时间,而且患者术后长期疗效与开腹肝切除无显著差异。在未来,希望能进一步开展腹腔镜肝切除治疗肝细胞癌的随机对照试验,以佐证腹腔镜肝切除手术的优势,后期的研究仍是任重而道远。

