东星斑循环水养殖系统的水体营养盐及微生物群落结构特征
刘 鑫,康建平,林 岗,3 ,缪 凡,叶 翚,饶小珍,3,钟传明
(1.福建师范大学生命科学学院,福建 福州 350117;2.福建省水产技术推广总站,福建 福州 350001;3.福建省特色海洋生物资源可持续利用重点实验室,福建 福州 350117)
0 引言
【研究意义】东星斑(Plectropomus leopardus)又名豹纹鳃棘鲈、花斑刺鳃鲈、七星斑、红条等,鲈形目(Perciformes)、鳍科(Serranidae)、石斑鱼亚科(Epinephelinae)、鳃棘鲈属(Plectropomus)[1]。东星斑既可作为观赏鱼类,也可作为高食用价值的经济物种[2]。循环水养殖系统通过处理和再利用大大减少了用水量,并能够实现集约化养殖,减少了处理、收获和加工的劳动力,是鱼类室内养殖的理想选择模式[3]。探究循环水养殖石斑鱼过程中营养盐及微生物的变化特征具有重要意义。【前人研究进展】利用高通量测序技术对循环水养殖系统微生物群落结构的研究较多,如健康与患病养殖水体的微生物群落结构差异、生物滤池微生物群落结构以及石斑鱼养殖系统微生物群落结构等[4-6]。养殖水体中的氨氮对鱼类有非常强的毒性,在浓度很低的情况下就能使鱼类中毒甚至死亡。循环水养殖系统利用生物膜可以降低水体中的氨氮浓度,从而降低氨氮浓度过高对养殖鱼类带来的危害[7]。弧菌病对海水鱼类养殖造成巨大威胁,引起海水养殖动物弧菌病的病原菌有数十种之多,许多致病菌可以引起养殖对象出现皮肤溃烂、烂尾、烂鳍、出血等一系列不良症状[8]。弧菌数量的高峰期也是鱼病的频繁发生期,某些弧菌可能受环境影响而转化为致病弧菌,因此通过检测水体中的弧菌数量变化可以提前预报海水养殖鱼类病害的发生情况[9],而目前对海水循环水养殖系统中弧菌群落变化的相关报道较少。关于东星斑养殖技术方面的研究较多[10,11],但对其养殖水体的研究较少。福建平潭综合试验区东庠乡位于沿海,具有得天独厚的海水养殖条件,适宜东星斑的养殖。【本研究切入点】东星斑循环水养殖中营养盐、弧菌的变化特征以及RAS系统中对微生物群落结构影响的关键单元的调控作用等都有待更深入的研究。【拟解决的关键问题】本文利用高通量测序技术对东星斑海水循环水养殖系统进水、养殖池、出水、生物滤池、紫外消毒池水样的营养盐以及微生物群落结构特征进行了分析,并对弧菌的数量变化进行分析,探讨水体中微生物的功能,以期为海水循环水养殖系统提供理论依据和技术参考。
1 材料与方法
1.1 循环水养殖系统
循环水养殖系统(图1)位于福建省平潭综合试验区东庠乡的一家水产公司,其一套循环水养殖系统由10个大小规格一致的八角形养殖池、微滤机、生物滤池、紫外消毒池等组成,每个养殖池的占地面积为43 m2,水体体积为56 m3;生物滤池面积为15 m2,水深2 m,可处理水体积为30 m3;供氧系统由纯氧机、罗茨鼓风机等组成。养殖池水体溶氧(DO)控制在(8.6±0.5) mg·L-1,水温由空气能控温系统控制在(26±1) ℃,养殖系统水体每2.5 h循环一次。2020年9月开始养殖东星斑,养殖过程中投喂东星斑配合饲料(日清丸红鱼类配合饲料),初始养殖密度为20 kg·m-3,平均体重约为300 g·尾-1,鱼的生长状况良好。
1.2 样品采集
2021年6月,按照循环水养殖系统的结构组成,采集养殖池进水、养殖池池水、养殖池出水、生物滤池池水、紫外消毒池池水以及经过处理的外源海水(用于循环系统的补水)样品,并依次编号为PTA1~6。样品保存于500 mL无菌聚乙烯瓶中,所有样品采集后立即低温保存带回实验室进行分析。
1.3 水质指标检测
依据《海洋监测规范第4部分:海水分析》(GB 17378.4—2007)[12],检测水温、溶氧、盐度、pH、氨氮(NH4+-N)、亚硝酸盐氮(NO2--N)、硝酸盐氮(NO3--N)、磷酸盐(PO43--P)等水质指标。其中硝酸盐氮(NO3--N)采用离子色谱法[13]进行检测。每个指标测定3个重复,结果取平均值。
1.4 16S rRNA基因片段的PCR扩增及测序
本试验采用16S rRNA基因的V3~V4区域作为目标DNA序列,进行PCR扩增。所用引物为338R(5'-ACTCCTACGGGAGGCAGCAG-3')和 806R(5'-GG ACTACHVGGGTWTCTAAT-3')。PCR 反应条件为94 ℃预变性 5 min;94 ℃变性 30 s,50 ℃退火 30 s,72 ℃延伸60 s,30个循环;72 ℃延伸7 min。扩增结束后,PCR扩增产物使用1%琼脂糖进行凝胶电泳,检查扩增效果,对扩增产物进行测序,测序工作由北京奥维森基因科技有限公司完成。
1.5 序列分析
利用 Trimmomatic(v0.36)、Pear(v0.9.6)对数据进行质控,根据标记序列和扩增引物序列从原始数据中拆分出各样品数据,截去标记序列和引物序列后利用 Fash(v1.20)、Pear(v0.9.6)进行拼接(Merge)处理。Qiime(v1.8.0)对拼接后数据进行过滤处理,用Uchime方法去除嵌合体序列。
利用Uparse软件对处理后的有效序列以97%的一致性聚类成操作分类单元(Operational taxonomic units,OTUs)。用 RDP Classifier(v2.13)等软件对OUT代表序列进行比对分析,并在各分类水平上注释群落的物种信息。采用Qiime(v1.8.0)软件计算α-多样性指数和覆盖度指数,其中α-多样性指数包括Chao1指数、Shannon指数和Simpson指数。用Mother作Rarefaction分析,用R语言工具绘制Veen图,使用Qiime(v1.8.0)软件计算unweighted unifrac距离和构建UPGMA样品聚类树。运用SPSS 20.0软件进行One-way ANOVA分析,分析不同样品中优势菌含量显著性差异(α取0.05)。
1.6 弧菌的数量变化
弧菌采用硫代硫酸盐-柠檬酸盐-胆盐-蔗糖(Thiosulfate-citrate-bile-salts-sucrose,TCBS)特异性弧菌分离培养基培养,样品用无菌海水稀释10倍后取0.1 mL均匀涂布在培养基上,在28 ℃恒温条件下培养24 h后对弧菌进行计数。运用One-way ANOVA检验不同环节样品中弧菌数量差异的显著性,如果差异显著再进行多重比较。
2 结果与分析
2.1 水体理化性质分析
循环水养殖系统不同环节水体的盐度、pH、氨氮(NH4+-N)、亚硝酸盐氮(NO2--N)、硝酸盐氮(NO3--N)、磷酸盐(PO43--P)等检测结果见表1。循环水养殖系统各环节水体的硝酸盐、亚硝酸盐、磷酸盐均高于外源海水。养殖池出水经过水处理阶段后氨氮、硝酸盐、磷酸盐均得到有效降低,养殖池进水水质完全符合东星斑的养殖要求。
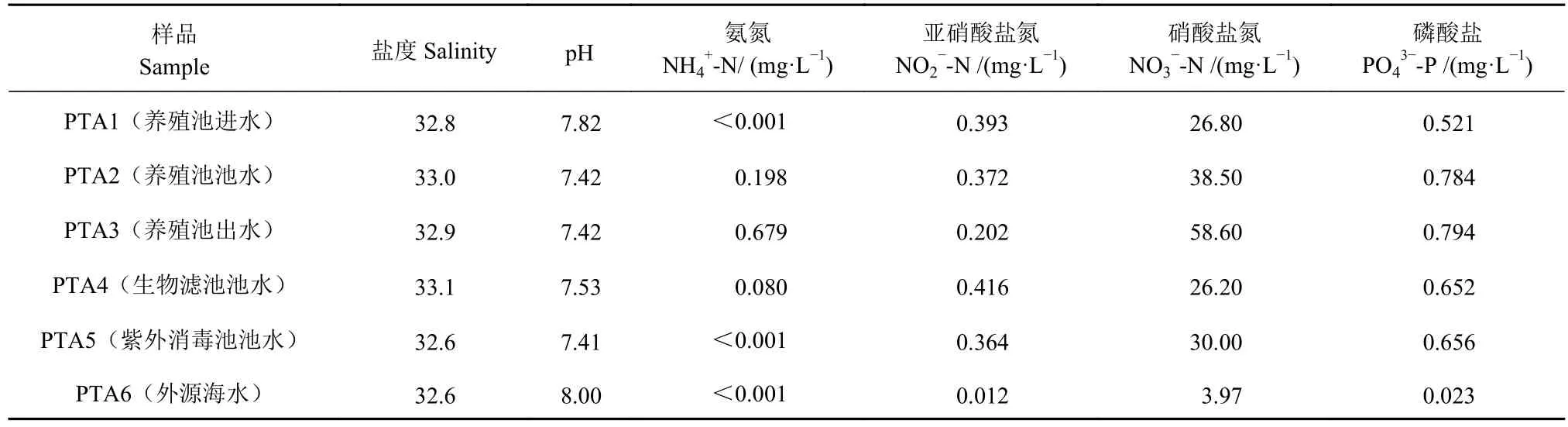
表1 循环水养殖系统不同环节的水质指标Table 1 Water quality indicators for functional stages of RAS
2.2 微生物群落多样性分析
对测序结果的微生物序列进行分析,6个样品总计得到467 241个原始条带,平均每个样品得到77 874个原始条带,经过去除低质量、Barcode和引物序列后,6个样品总计得到405 840个有效条带,平均每个样品得到67 640个有效条带。序列的有效覆盖率全部达到99%以上,说明测序深度足够,能够很好反映微生物群落的总体状况。
经过均一化之后,经16S rRNA基因序列97%相似性聚类,各样品的微生物丰富度、物种均一度的α-多样性指标结果如表2所示。采用Chao1指数对微生物物种的丰富度进行评估,采用Shannon指数和Simpson指数对微生物群落的多样性进行评估。结果显示,Chao1指数从大到小依次是PTA5>PTA1>PTA6> PTA4>PTA2>PTA3,其中 PTA5 的 Chao1指数最大为2 213.58,PTA3的最小为1 769.79。PTA1的Shannon指数最大为8.21,PTA2的最小为7.02。

表2 不同样品细菌群落的多样性Table 2 Microbial community diversity at sampling spots
2.3 微生物群落相似性分析
6个样品平均发现1 448个OUT,PTA1的OTU数目最多,有1 663个;其次是PTA4,有1 588个;PTA6的OTU数目相对较少,只有1 170个。为了解样品中细菌的共有情况,绘制了Veen图(图2),由图2可见,PTA1、PTA2、PTA3、PTA4、PTA5 和 PTA6特有的OUT数目分别为427、185、170、285、225和294,6组样品共有的OTU数目是678种,平均占每个样品OUT总数的46.82%,说明6组样品的相似度较高,循环水养殖系统不同环节水体的微生物群落总体上有很大的相似性。
为了了解各个样品之间的群落结构差异,对各个样品进行聚类分析,用Bray-Curtis距离算法对样品进行无度量多维度标定法(Non-metric multi-dimensional Scaling,NMDS)分析,基于OTU水平的NMDS分析如图3所示,基于此算法下的胁强系数(Stress)为0.063 0,表明结果具有较好的拟合度,能够很好地反映样品菌群的组成情况。样品在图中的距离越远,表明样本的微生物群落结构组成差异越大,图中PTA1、PTA6与其他样品距离最远,表明PTA1、PTA6菌群群落组成与循环水养殖系统其他各环节菌群群落组成有较大差异,PTA3、PTA4在图中距离较近,也表明PTA3、PTA4菌群群落组成差异较小。
2.4 微生物群落组成分析
经过物种注释,6个样品在门分类水平的微生物群落分布见图4,6个样品中Proteobacteria(变形菌门)、Bacteroidota(拟杆菌门)、Firmicutes(厚壁菌门)、Actinobacteriota(放线菌门)、Verrucomicrobiota(疣微菌门)、Patescibacteria(髌骨细菌门)、Fusobacteriota(梭杆菌门)、Planctomycetota(浮霉菌门)、Chloroflexi(绿弯菌门)、Bdellovibrionota(蛭弧菌门)、Cyanobacteria(蓝藻门)总计占细菌OTU总数的97.10%。6组样品中含量最多的均是Proteobacteria,在各样品中占31.79%~59.49%,在PTA2中含量最大,在PTA5中含量最小,其相对丰度依次为 PTA2>PTA1>PTA3>PTA4>PTA6>PTA5;Bacteroidota在各样品中占21.66%~29.75%,在PTA4中含量最大,在PTA2中含量最小,其相对丰度依次为PTA4>PTA5>PTA1>PTA6>PTA3>PTA2;Firmicutes在各样品中占3.33%~25.39%,在PTA5中含量最大,在PTA1中含量最小,其相对丰度依次为PTA5>PTA4>PTA6>PTA3>PTA2>PTA1。Firmicutes在养殖池进水中含量较少,Fusobacteriota主要存在于养殖池出水中。
在属分类水平上(见图5),各样品中主要含Pseudoalteromonas(假 交 替 单 胞 菌 属 )、Photobacterium(发光杆菌属)、Vibrio(弧菌属)、Lactobacillus(乳 杆 菌 属 )。Pseudoalteromonas在各样品中占0.98%~14.10%,在PTA2中含量最大,在PTA6中含量最小,其相对丰度依次为PTA2>PTA4>PTA3>PTA5>PTA1>PTA6;Photobacterium在各样品中占0.64%~9.07%,在PTA2中含量最大,在PTA6中含量最小,其相对丰度依次为PTA2>PTA3>PTA5>PTA4>PTA1>PTA6;Vibrio在各样品中占0.81%~5.30%,在PTA3中含量最大,在PTA6中含量最小,其相对丰度依次为PTA3>PTA4>PTA2>PTA1>PTA5>PTA6;Lactobacillus在各样品中占0.04%~8.98%,在PTA5中含量最大,在PTA2中含量最小,其相对丰度依次为PTA5>PTA4>PTA6>PTA3>PTA1>PTA2。除此外,各样品中还含有较多的未培养或未分类的细菌类群。
Photobacterium和Vibrio含量较多,分别占Vibrionaceae(弧菌科)总量的59.51%、40.48%,其中Vibrio主要包含Vibrio ponticus、Vibrio marisflavi(黄海弧菌)、Vibrio harveyi(哈维氏弧菌)、Vibrio penaeicida(杀对虾弧菌)以及少量的Vibrio vulnificus(创伤弧菌),分别占Vibrio总量的 66.17%、1.26%、0.90%、0.30%、0.02%。Vibrio ponticus数量在养殖池出水样品中最高,占Vibrio总量的75.86%,在紫外消毒池样品中为62.75%。
为了了解各样品中的优势菌属,统计了各个样品中含量大于1%的菌属(如表3)。从表中数据可知,不同环节水体样品中优势菌种类、数量有所差异,各样品中优势菌的含量存在明显差异。包括未分类或未培养的菌属,各样品中优势菌属数量共有29种。一些菌属只在某一环节水体样品中为优势菌属,如Acinetobacter(不动杆菌属)、Bacillus(芽孢杆菌属)、Bifidobacterium(双歧杆菌属)、Klebsiella(克雷伯菌属)是PTA5中的优势菌属;Aquimarina(海水杆菌属)、Sva0996_marine_group是PTA1中的优势菌属;Cetobacterium(鲸杆菌属)是PTA3中的优势菌属;Nautella、Roseovarius(玫瑰变色菌属)、Rubidimonas、Sulfitobacter(亚硫酸杆菌属)是PTA2中的优势菌属。还有一些菌属在各个环节水体样品中均为优势菌属,如Clostridium_sensu_stricto_1(艰难梭菌属)、Photobacterium、Pseudoalteromonas、Ruegeria(鲁杰氏菌属)、Thalassotalea(深海杆菌属)、Vibrio和一些未分类或未鉴定的菌属。其中,Clostridium_sensu_stricto_1、Vibrio含量从 PTA1至PTA5呈现先上升后下降的变化趋势,均在PTA3中含量较高,分别为7.20%、5.30%;在PTA5中含量较低,分别为1.07%、2.88%。

表3 循环水养殖系统不同环节中优势菌的分布情况(属水平)Table 3 Distribution of dominant bacteria at stages of RAS at genus level
在属分类水平上,选取所有样品丰度排序前17的菌群构建丰度热图,进行聚类分析,并对不同样品中各菌群的含量作显著性分析(P<0.05),结果如图6所示,可见样品的主要差异菌属为Pseudoalteromonas、Ruegeria、Cetobacterium、Clostridium_sensu_stricto_1、Lactobacillus、Candidatus_Actinomarina;Actibacter、Polaribacter、Thalassobius、Thalassotalea、Bacillus、Prevotella相对差异较小。根据聚类结果可以明显看出,样品被分为两组,PTA1、PTA2及PTA3为一组,PTA4、PTA5及PTA6为一组。
2.5 弧菌数量变化分析
循环水养殖系统不同环节水体样品中弧菌的数量如图7所示,水中的弧菌数量PTA3>PTA2>PTA4>PTA5>PTA1。外源海水样品中弧菌数量很低接近零,循环系统不同环节样品中PTA3的弧菌数量最高,PTA1的弧菌数量最低。PTA1与PTA3的弧菌数量具有显著性差异(P<0.05),PTA3与PTA5弧菌数量有显著性差异(P<0.05),弧菌数量从PTA1到PTA5总体呈现先升高后降低的变化趋势,从PTA1到PTA3,弧菌数量出现显著升高,增幅为516.67%,从PTA3到PTA5,弧菌数量发生明显降低,降幅为80.68%。可以看出水体中的弧菌数量经过养殖池会急剧增加,而净化处理可以明显降低弧菌数量。
3 讨论
海水循环水养殖模式的构建是为了解决传统养殖模式直接将养殖尾水排入附近环境水体中而引起的环境问题,从而实现“零污染”的目的。本研究中,海水循环水养殖系统能够很好地维持水体盐度的稳定,使循环水体环境指标保持在适宜的范围,为养殖经济动物提供基本的养殖条件。氨氮对鱼类的毒害作用主要归因于其所包含的非离子氨(NH3-N),NH3-N能够影响鱼类的生长、渗透压平衡、代谢活动等,当池塘中所含的氨氮总量多于消散量时,池塘中氨氮的含量会随着时间的推移而不断积累,到达一定程度时就会对鱼体造成危害[14]。养殖池出水经过生物滤池处理后,氨氮和硝酸盐氮的浓度有所降低,亚硝酸盐氮的浓度有所升高,其浓度升高可能是养殖池出水中氨氮浓度较大,硝化过程中生成NO2-的速率更快[15],同时,循环水养殖系统中含有的Nitrosomonas(亚硝化单胞菌属)、Nitrospira(硝化螺菌属)等氨氧化菌可将氨氮转化为亚硝酸盐氮[16]。氨氧化菌的最佳生长温度为22~27 ℃,最佳pH值为7.8~8.3,与本研究中的水体条件非常接近[17]。除此之外,本研究中还发现了少量的Candidatus,其属于厌氧氨氧化菌[5],在氨氮转化方面也发挥了一定作用。各样品中含量较为丰富的菌属有Pseudoalteromonas和Photobacterium,其中Pseudoalteromonas在生物滤池水体中含量较高(8.06%),Pseudoalteromonas中一些菌株具有拮抗弧菌和去除氨氮的作用,在pH为7-8时,其具有较强的抗弧菌及脱氮能力,应用于养殖中能够显著降低水体中的氨氮浓度[18]。Photobacterium在生物滤池池水样品中含量较高,Photobacterium被证明具有去除水体总氮的能力,但是一定浓度的铵盐浓度会完全抑制Photobacterium的亚硝酸盐还原作用[19]。除此之外,Bacteroides(拟杆菌属)在生物滤池中含量较高,是生物滤池中的优势菌属,Bacteroides为厌氧菌,对去除水体中的氮磷发挥着重要作用,其参与含氮物质的利用等多种过程[20]。Firmicutes(厚壁菌门)的含量从养殖池进水到紫外消毒池池水样品中含量呈升高趋势,在紫外消毒池池水样品中的占比最大,Firmicutes能分泌多种消化酶和抗生素,也能直接利用水中硝酸盐和亚硝酸盐从而净化水质[21]。紫外消毒池池水样品中磷酸盐的含量明显高于养殖池进水样品,在紫外消毒池中,Acinetobacter为优势菌属,Acinetobacter能够超量摄取废水中的磷,使胞内磷的含量占到10%-30%,此类能够过量摄取磷的功能性细菌被广泛应用于生物除磷[22]。本研究中,生物滤池水体中氨氮、硝酸盐氮以及磷酸盐含量的降低明显,与各种菌群的去氮除磷作用相关。该循环水养殖系统通过微滤机、硝化作用和曝气等有效途径可以显著降低养殖池出水中的氨氮浓度,使养殖池中水体中氨氮浓度降低至对鱼体无害水平,防止了氨氮的积累和对养殖经济动物的毒害作用。同时,该系统能够有效去除养殖池出水中的磷酸盐,为维持养殖池中磷酸盐在一个较低水平发挥了较大作用。同时,在海水循环水养殖系统运行中如何更加有效实现亚硝酸到硝酸盐的转化以及降低水体中磷酸盐的含量还有待更深入的研究。
弧菌是海水养殖中非常重要的一类有害菌群,弧菌数量变化可以用来监测水体中有害菌群的变化规律,对养殖生产做出指导。海水循环水养殖系统对弧菌的处理效果是判断系统有效性的重要因素,防止弧菌的过度增殖是防控鱼类疾病的重要措施。石斑鱼所感染的细菌性病原大部分属于弧菌,包括创伤弧菌、溶藻弧菌、河流弧菌、哈维氏弧菌等[23]。在本次研究中,循环水养殖系统中弧菌数量与外源海水中弧菌数量具有显著差异,同时弧菌数量在循环水养殖系统中出现规律性变化,经过养殖池,弧菌呈现上升趋势,经过净化处理,弧菌呈现下降趋势,测序结果中弧菌的变化趋势与鉴别培养基计数结果相同。养殖池出水样品中弧菌数量最大,是因为养殖池有饲料等有机质的输入,会导致碎屑、浮游生物及微生物的增加,另外,水体中沉积物中生物的密度和有利的环境条件有助于弧菌的增加和维持[24]。循环水养殖系统中弧菌属物种主要为Vibrio ponticus,其为海水养殖中的常见致病弧菌,能导致大黄鱼出现烂鳃病[25],也可引起日本鲈鱼出现体表溃烂症状[26]。
弧菌数量的下降与多种因素有关,其中包括弧菌拮抗菌的抑制作用。循环水养殖系统中紫外消毒处理对弧菌的去除率较高[27,28],本试验中经过紫外消毒池后的进水样品中仍含有一定数量的弧菌,与紫外消毒处理的强度和作用时间等有关,对于弧菌的控制还与其他拮抗菌的作用有关。在生物滤池中含有丰富的Pseudoalteromonas,其对多种海水养殖动物病原弧菌具有拮抗作用[29]。本研究中养殖池进水样品、养殖池池水样品中的Lactobacillus数量很低(0.08%、0.04%),从养殖池出水到紫外消毒池,其数量逐渐增大,在紫外消毒池池水样品中的数量达到最大(8.98%),数量明显升高。Lactobacillus是水产饲料中常用的益生菌,其对水体中的有害病原菌具有一定的抑制作用[30],与弧菌具有拮抗作用[31]。本试验中Lactobacillus数量在生物滤池以及紫外消毒池中含量较高,其与生物滤池及外源海水中Lactobacillus含量较高相关,对于外源海水中Lactobacillus含量较高的现象有待进一步的探究。生物滤池中弧菌的减少与其拮抗菌属有关,生物滤池中含有丰富 的Allobaculum、Clostridium_sensu_stricto_1、Faecalibacterium、Prevotella、Ruegeria等益生菌属,其中Ruegeria属于变形菌门、α变形菌纲,Ruegeria中的某些物种经常在海水海洋生物表面分离得到,有的物种具有抗菌活性[32],Allobaculum属于支原体科,是生物体内具有保护性作用的微生物[33]。本研究中发现的一些菌属在水体微生物方面没有相关报道,但是在其他生物体中发挥着重要作用,如Faecalibacterium主要存在于人的肠道中,并对基因表达、炎症、分化和凋亡起着重要的作用[34],Prevotella可以通过促进糖原的储存从而改善葡萄糖代谢[35],这些菌属可能在对降低弧菌数量方面可能发挥重要作用,这有待进一步探讨。本研究中弧菌的数量变化可以说明,循环水养殖系统可以显著降低养殖池出水中的弧菌数量,从而降低弧菌引起鱼类疾病的机率。
在门分类水平上,各水样的菌群组成有明显区别,循环水养殖系统中含量明显较多的两种细菌门类为Proteobacteria、Bacteroidota。其中Bacteroidota在循环水养殖系统各个环节的数量没有明显变化,但数量均较大(21.66%~29.75%),其数量与外源海水中的Bacteroidota数量(24.53%)接近,说明此门类可能是海水水体中数量较为稳定的菌群,具体有待进一步论证。Proteobacteria在整个循环水养殖系统中为最优势菌群,这与其他研究者的结论一致[4-6],其在养殖池中的数量最高,与养殖池中的蛋白质和有机物的含量较高有关,而Actinobacteriota在养殖池池水样品、养殖池出水样品以及生物滤池池水样品中的数量较小,在养殖池进水样品(7.84%)和紫外消毒池池水样品(7.05%)中的数量较大,与Actinobacteriota不易在蛋白质、有机质含量较高的环境中生长有关[36]。在属分类水平上,生物滤池池水样品中还含有较多的Cryomorphaceae,其包含4个海洋起源的属,处于黄杆菌科和拟杆菌科之间,与Flavobacteriaceae(黄杆菌属,属于弧菌科)具有很大的相似性[37],黄杆菌属中的柱状黄杆菌、鳃部黄杆菌等是引发淡水鱼类疾病的重要物种[38]。循环系统中Cryomorphaceae数量较高,可能会成为不利于实际鱼类生长的环境因素之一。除此外,本研究中各样品中均含有Clostridium_sensu_stricto_1,其数量在循环水养殖系统各环节中呈现先上升后下降的规律性变化,这可能与水体中蛋白质的浓度有关,相关研究表明其在生物体内的结肠部位的浓度随着日粮中的蛋白质浓度的增加而降低[39]。本研究中各类菌群与循环养殖系统中营养盐之间的相互作用还需要进一步深入研究。
4 结论
通过对东星斑循环水养殖水体的理化因子以及微生物群落组成分析,揭示了循环水系统不同环节微生物组成特征,说明了循环水养殖系统可以有效降低养殖池出水中氨氮、硝酸盐氮以及磷酸盐的浓度以及降低弧菌数量,提高生物滤池中假交替单胞属、乳杆菌属、Allobaculum属等菌属丰度可以更好地维持循环水养殖系统的运行,保障养殖效果。

