TNF-α、IL-6对青光眼大鼠视网膜的影响*
曾朝霞, 陈王灵, 陈海波, 史贻玉, 丁 辉, 陈运信, 郑海生, 陈 翩
中山大学中山眼科中心海南眼科医院(海南省眼科医院),海南省眼科学重点实验室,海口 570311
青光眼(glaucoma)是以视网膜神经节细胞、视功能进行性丧失为特征的视神经变性疾病,是常见的不可逆致盲性眼病之一,严重威胁视觉健康。预计到2040年全球青光眼患者数量将增至1.118亿[1]。高眼压直接损害视神经轴突,并导致视网膜神经节细胞(retinal ganglion cells,RGC)不可逆性丧失。临床治疗青光眼尚无有效的方法,多以控制眼压或进行外科手术来保护视力,但青光眼相关的视神经损伤却存在不可逆的特点,加之手术也可损伤视神经,因而青光眼患者从手术中的受益仍存在争议,且目前尚无公认的有效视神经保护措施[2-3],以上关于青光眼的困惑均与人们尚未理清青光眼的视神经病变机制存在一定的相关性[4]。
肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)是一种能够直接杀伤肿瘤细胞而对正常细胞无明显毒性的细胞因子,是迄今为止所发现的直接杀伤肿瘤作用最强的生物活性因子之一。报道显示,青光眼患者视网膜TNF-α呈高表达,且与多种蛋白及多个信号通路相关并促发网膜神经节死亡[5]。白细胞介素-6(interleukin-6,IL-6)是一种细胞因子,能够刺激参与免疫反应的细胞增殖、分化并增强其功能。研究显示,IL-6可以抑制细胞死亡[6]。Wang等[7]认为TNF-α与IL-6参与骨关节炎、免疫系统及RANK-RANKL等通路调节,可能存在靶向关系。青光眼属于免疫系统疾病,关于TNF-α与IL-6在青光眼病变中扮演怎样的角色,尤其对视网膜组织和细胞的影响怎样等问题的报道较少。本研究制备青光眼大鼠模型,分离培养新生大鼠的视网膜神经节细胞,采用外源性TNF-α与IL-6分别在体内与体外细胞水平进行干预,借助分子生物学技术探讨两种炎症因子对青光眼视网膜的影响。
1 材料与方法
1.1 主要仪器与试剂
AVIA型接触式眼压笔(美国Reichert公司)、台式高速冷冻离心机(美国赛默飞公司)、P-330-31型超微量紫外分光光度计(德国Implen公司)、DMI6000B型活细胞工作站(德国Leica公司)、Sterrad 100型过氧化氢低温等离子系统(美国强生公司)、BX900型裂隙灯显微镜(瑞士Haag-Streit AG公司)、Lumera700型眼科手术显微镜(德国蔡司公司)。
重组大鼠TNF-α和重组大鼠IL-6均购自美国Sigma公司,Annexin Ⅴ-FITC/PI细胞凋亡检测试剂盒、胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)与神经元特异性烯醇化酶(neurospecific enolase,NSE)单克隆抗体均购自美国赛默飞公司,盐酸丁卡因注射液为浙江九旭药业有限公司产品,苏木精-伊红(HE)染色试剂盒购自威奥生物。
1.2 实验动物及分组处理
3~5月龄SD大鼠64只,雌雄各半,购自北京维通利华实验动物技术有限公司(许可证号:SCXK(京)2021-0006),体质量180~220 g,健康且无眼部疾患。实验动物正常饮食饮水,饲养温度21~26℃,相对湿度40%~70%,12 h光照12 h黑夜。动物使用与处理符合中华人民共和国国家卫生研究院实验动物保护法和使用指导要求。
1.2.1 青光眼大鼠模型制备 采用单眼造模。实验大鼠腹腔注射10%水合氯醛2 mL/kg麻醉,再以丁卡因表面麻醉眼球,测量双眼眼压,右眼上直肌与下直肌悬吊并固定眼球,于6点至2点位角巩膜缘后剪开球结膜,分离球结膜下筋膜组织,暴露巩膜上静脉,游离每丛上巩膜静脉总支,采用齿镊将总血管提离巩膜面,避开巩膜面灼烧远端角巩膜侧血管,近端血管扩张充血,远端血管消失为烙闭合格,每丛逐一烙闭后,向球结膜滴氯霉素眼药水,缝合球结膜,剪去直肌吊线,复位眼球。仅制备右眼为青光眼模型,左眼不做任何处理,双眼均涂抹金霉素眼膏,待清醒,放回饲养笼,自由摄食饮水。
1.2.2 动物分组与处理 以随机数字表法将64只SD大鼠分为8组:空白组、空白+TNF-α组、空白+IL-6组、空白+TNF-α+IL-6组、青光眼组、青光眼+TNF-α组、青光眼+IL-6组、青光眼+TNF-α+IL-6组。按分组,在复制单眼青光眼模型或不造模的基础上,腹腔注射TNF-α 3.0 μg/kg[8]或IL-6 250 ng/kg[9],或腹腔注射2 mL生理盐水为对照。给药2次/周,连续6周。
1.2.3 眼压测量 分别于造模前、造模后、给药3周及给药6周后检测所有组别大鼠左右眼的眼压,局部麻醉鼠眼,采用眼压笔每眼测压3次,取均值。
1.2.4 组织切片制备和HE染色 给药结束,安乐处死大鼠,在大鼠右眼球3点位置标记,显微镜下迅速摘除眼球,保留视神经,采用梯度乙醇脱水、二甲苯透明,浸蜡、石蜡包埋、切片、烤片等步骤制备眼球组织切片,切片经脱蜡、HE染色后于200倍放大倍数下观察视网膜组织病变。
1.2.5 TUNEL法检测视网膜组织细胞凋亡 眼球组织切片以二甲苯脱蜡,梯度乙醇水化,3% H2O2室温封闭15 min,枸橼酸盐缓冲液修复抗原,滴加TUNEL反应液50 μL 37 ℃孵育60 min,转化剂-POD混合液50 μL湿盒37 ℃孵育30 min,DAB显色,苏木精复染,盐酸乙醇分化,烘干,封片。荧光显微镜下观察视网膜组织的细胞凋亡情况(绿色荧光为TUNEL染色阳性),以绿色荧光平均荧光强度值代表组织细胞凋亡指数。
1.3 细胞培养与处理
1.3.1 视网膜神经节细胞培养 取出生3~5 d的新生大鼠,低温麻醉,浸泡于75%乙醇中消毒,无菌条件下摘除眼球,安乐处死大鼠。采用D-Hank’s液冲洗眼球血污,将眼球置于显微镜下去除晶状体、玻璃体与角膜。分离视网膜神经上皮层置于D-Hank’s液中,加入胰酶,于5%CO2、37℃的培养箱中孵育15 min,终止消化,离心去上清。细胞沉淀中加入IMDM培养液制备为细胞悬液,调整细胞浓度为8×106/mL接种于培养皿,置于5%CO2、37℃的培养箱中培养,隔天换液。连续培养7 d的细胞以多聚甲醛固定,采用GFAP与NSE荧光抗体染色鉴定其是否具有神经元特性,染色阳性即判定为视网膜神经节细胞。
1.3.2 细胞实验分组 将对数生长期视网膜神经节细胞制备为1×105/mL的悬液,接种于96孔板,分为5组:对照组、谷氨酸组、谷氨酸+TNF-α组、谷氨酸+IL-6组及谷氨酸+TNF-α+IL-6组。其中对照组以含10%胎牛血清的DMEM低糖培养液进行培养;其余按分组分别加入终浓度为10 μmol/mL的谷氨酸、终浓度为10 μg/L的TNF-α和(或)终浓度为0.1 μg/mL的IL-6,作用24 h。
1.3.3 细胞增殖检测 采用MTT法检测细胞增殖,将分组处理后的细胞分别接于96孔板,2000细胞/孔,每组设6个复孔,培养24、48和72 h,在终止培养前4 h每孔加入20 μL 5 mg/mL的MTT,继续培养4 h后吸弃培养液,加入100 μL DMSO,振荡均匀,在酶标仪上检测490nm处的吸光度值。
1.3.4 细胞凋亡检测 将分组处理的细胞用不含EDTA的0.25%胰酶消化、重悬,300目细胞过滤网过滤细胞,多聚甲醛固定后以Annexin Ⅴ-FITC/PI染色,流式细胞仪检测细胞凋亡。
1.4 统计学方法
2 结果
2.1 各组大鼠眼压比较
造模前,所有大鼠的左右眼压差异无统计学意义(均P>0.05)。造模后、给药3周及给药6周,空白组、空白+TNF-α组、空白+IL-6组、空白+TNF-α+IL-6组差异无统计学意义(均P>0.05);青光眼组、青光眼+TNF-α组和青光眼+TNF-α+IL-6组的右眼眼压均明显高于左眼眼压(均P<0.05)。给药6周,与青光眼组右眼比较,青光眼+TNF-α组右眼眼压明显增高(P<0.05);与青光眼+TNF-α组比较,青光眼+IL-6组和青光眼+TNF-α+IL-6组右眼眼压明显降低(均P<0.05);与青光眼+IL-6组比较,青光眼+TNF-α+IL-6组右眼眼压明显增高(P<0.05)。见表1。
2.2 各组大鼠视网膜HE染色结果
空白组、空白+TNF-α组、空白+IL-6组和空白+TNF-α+IL-6组各组视网膜组织结构相似,视网膜神经节细胞,内核层、外核层细胞排列整齐均匀;青光眼组、青光眼+TNF-α组、青光眼+IL-6组、青光眼+TNF-α+IL-6组视网膜神经节细胞均有不同程度的水肿,内外核层细胞排列紊乱,存在空泡,其中青光眼+IL-6组水肿较轻,内外核层细胞排列相对整齐,空泡较少,青光眼组和青光眼+TNF-α组水肿明显,伴有核浓缩,内外核层细胞紊乱、核浓缩并伴随空泡。见图1。
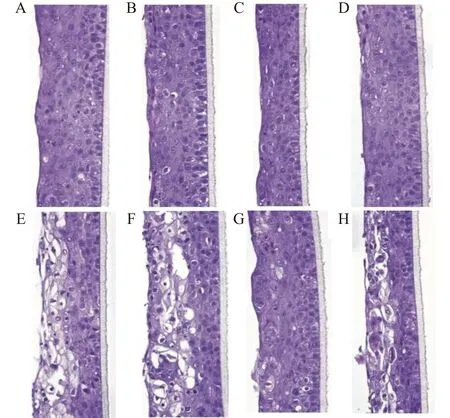
A:空白组;B:空白+TNF-α组;C:空白+IL-6组;D:空白+TNF-α+IL-6组;E:青光眼组;F:青光眼+TNF-α组;G:青光眼+IL-6组;H:青光眼+TNF-α+IL-6组图1 各组大鼠视网膜组织HE染色(×200)Fig.1 HE staining of rat retinal tissue in each group(×200)
2.3 各组大鼠视网膜组织细胞凋亡情况
给药6周,空白组、空白+TNF-α组、空白+IL-6组和空白+TNF-α+IL-6组各组视网膜组织的凋亡指数差异无统计学意义(P>0.05);与青光眼组比较,青光眼+TNF-α组凋亡指数明显增高(P<0.05),与青光眼+TNF-α组比,青光眼+IL-6组和青光眼+TNF-α+IL-6组凋亡指数明显降低(均P<0.05),与青光眼+IL-6组比,青光眼+TNF-α+IL-6组凋亡指数明显增高(P<0.05)。见图2和表2。

A:空白组;B:空白+TNF-α组;C:空白+IL-6组;D:空白+TNF-α+IL-6组;E:青光眼组;F:青光眼+TNF-α组;G:青光眼+IL-6组;H:青光眼+TNF-α+IL-6组图2 TUNEL法检测各组大鼠视网膜组织细胞凋亡(×100)Fig.2 Retinal tissue apoptosis of rats in each group detected by TUNEL method(×100)
表2 各组大鼠视网膜组织细胞凋亡指数Table 2 Retinal tissue apoptosis index of rats
2.4 体外培养视网膜神经节细胞鉴定
分离培养的细胞中(4.6±1.2)%为GFAP阳性,(85.7±4.5)%的细胞为NSE阳性,说明培养细胞中以神经细胞为主,提示视网膜神经节细胞分离及培养成功。见图3。

A:GFAP阴性;B:GFAP阳性;C:NSE阴性;D:NSE阳性图3 视网膜神经节细胞的鉴定(免疫荧光染色,×100)Fig.3 Identification of retinal ganglion cells(immunofluorescent staining,×100)
2.5 TNF-α、IL-6对视网膜神经节细胞增殖的影响
所有组别的细胞随着培养时间的延长均有不同程度的增殖(P<0.05)。与对照组比较,谷氨酸组、谷氨酸+TNF-α组、谷氨酸+IL-6组及谷氨酸+TNF-α+IL-6组增殖均有不同程度的降低(均P<0.05);与谷氨酸组比,谷氨酸+TNF-α组增殖明显降低(P<0.05),谷氨酸+IL-6组增殖明显增高(P<0.05),谷氨酸+TNF-α+IL-6组增殖程度相当(P>0.05);与谷氨酸+TNF-α组比,谷氨酸+IL-6组增殖增高(P<0.05)。见表3。
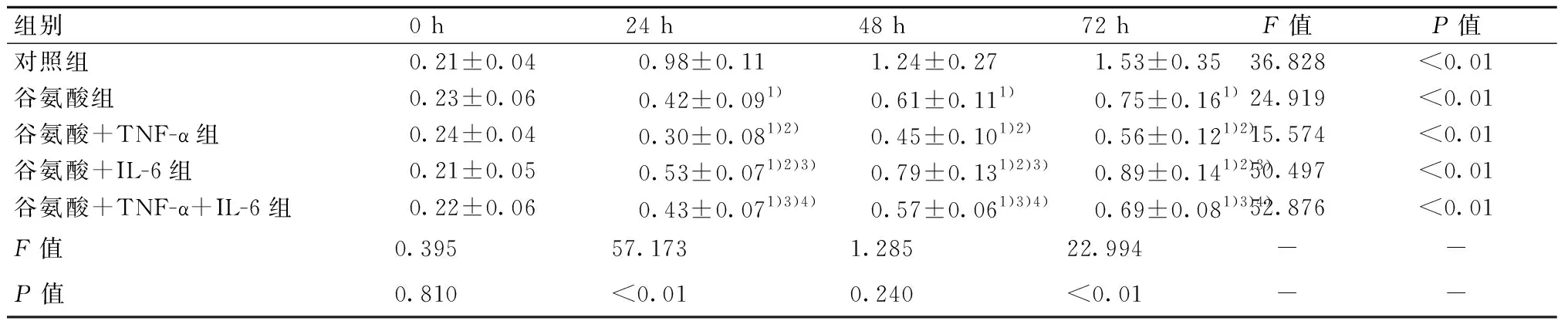
表3 TNF-α、IL-6对视网膜神经节细胞增殖的影响(A490nm,n=6)Table 3 Effect of TNF-α and IL-6 on proliferation of retinal ganglion cell(A490nm,n=6)
2.6 TNF-α、IL-6对视网膜神经节细胞凋亡的影响
与对照组比较,谷氨酸组、谷氨酸+TNF-α组、谷氨酸+IL-6组及谷氨酸+TNF-α+IL-6组凋亡均有不同程度的增加(均P<0.05);与谷氨酸组比较,谷氨酸+TNF-α组凋亡明显增加(P<0.05),谷氨酸+IL-6组凋亡明显降低(P<0.05),谷氨酸+TNF-α+IL-6组凋亡程度相当(P>0.05);与谷氨酸+TNF-α组比,谷氨酸+IL-6组凋亡降低(P<0.05)。见图4和表4。

A:对照组;B:谷氨酸组;C:谷氨酸+TNF-α组;D:谷氨酸+IL-6组;E:谷氨酸+TNF-α+IL-6组图4 TNF-α、IL-6对视网膜神经节细胞凋亡的影响Fig.4 Effect of TNF-α and IL-6 on apoptosis of retinal ganglion cells
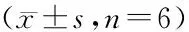
表4 TNF-α、IL-6对视网膜神经节细胞凋亡的影响Table 4 Effect of TNF-α and IL-6 on apoptosis of
3 讨论
近年来,研究者们对青光眼相关的视网膜神经节细胞凋亡密切关注,凋亡发生时细胞收缩、染色质和细胞质浓缩,进而细胞核裂解,细胞膜逐渐内陷形成包裹细胞内容物的凋亡小体,被吞噬细胞迅速吞噬,从而防止细胞内成分暴露于免疫系统,避免炎症反应的发生[1-3]。由此可见,炎症与视网膜神经节细胞的凋亡密切相关,一方面,促炎因子通过促进细胞凋亡导致视网膜组织持续性损伤,甚至功能丧失,加之促炎介质的大量释放可促进炎症细胞浸润,进一步扩大了视网膜的病变程度;另一方面,通过干扰炎症反应,减缓或抑制视网膜神经节细胞的凋亡途径可有效保护视网膜神经节细胞[10-11]。
本研究显示,TNF-α、IL-6对正常眼的眼压几乎无影响,但对青光眼眼压存在两种不同的作用,前者对青光眼的眼压有增高作用,后者有降低作用,当TNF-α与IL-6联用干预则表现出IL-6可抑制TNF-α的增压效果。进一步对大鼠右眼进行HE染色,TNF-α与IL-6单用或联用均不影响正常眼视网膜的显微结构,但TNF-α可增加青光眼的视网膜神经节细胞水肿及内外核层细胞排列的紊乱性,增加核浓缩,IL-6可缓解青光眼的视网膜的上述病变,有助于缓解TNF-α对视网膜损伤,凋亡指数也得到了类似的结果。体外研究亦显示,通过谷氨酸干预制备视网膜神经节细胞受损的细胞模型,分别给予TNF-α与IL-6单用或联用干预,结果显示,TNF-α可抑制视网膜神经节细胞的增殖,促进细胞凋亡,IL-6可翻转TNF-α的效应,保护视网膜神经节细胞,体外研究也佐证了体内研究的结果。类似的研究也有报道,如青光眼较高的眼压也可上调TNF-α水平,眼压与TNF-α呈正相关关系[12],采用抗TNF-α一致性抗体沉默TNF-α或敲除TNF-α基因的小鼠可预防高眼压导致IDE胶质细胞变性及视网膜神经节细胞损伤[13]。但对IL-6与视神经的关系仍存在争议,如Inomata等[14]向玻璃体腔内给予外源性IL-6可明显减少视网膜神经节细胞的凋亡;吕红丽等[15]认为IL-6与视网膜神经节细胞上的IL-6受体结合后,通过JAK/STAT3和PI3K/Akt/mTOR 2种途径,增加热休克蛋白表达,解除抑制性髓磷脂基质对受损神经轴突再生的抑制效应,抵抗凋亡因子TNF-α作用,刺激再生相关基因Sprrla和Gap-43等途径发挥保护视网膜神经节细胞的作用。
本研究存在的不足在于,一是尽管体外研究显示IL-6可抑制TNF-α对视网膜神经节细胞活性的影响,但并未应用细胞转染技术或基因敲除技术干预IL-6和(或)TNF-α表达途径分析及比较IL-6和(或)TNF-α对视网膜神经节细胞活性的影响,一定程度上影响到本研究结论的客观性;二是本研究体内或体外研究均以单一浓度IL-6进行干预,因而下一步的研究有必要设置IL-6的梯度浓度进行比较。
综上所述,TNF-α可能参与青光眼的发病过程,IL-6可能具有保护青光眼所致视网膜细胞损伤的作用,其机制或与抑制青光眼的视网膜神经细胞TNF-α相关的炎性病变有关。

