血清miR-216a、ANGPTL4水平与新生儿急性呼吸窘迫综合征病情严重程度和预后的关系
姜梨梨,付杰,郑爱华,刘军
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是由肺泡表面活性剂的原发性或继发性减少引起的一种以气体交换异常和急性低氧性呼吸衰竭为特征的呼吸系统疾病,进展快、预后差,严重威胁新生儿生命安全,病死率9.6%~15.2%[1-2]。研究表明,失控性炎性反应介导的弥漫性肺泡损伤、肺通透性增加等参与ARDS发生发展[3]。微小RNA(microRNA,miRNA)参与多种细胞因子转录调控,在炎性反应中扮演重要角色[4]。miR-216a是一种高度保守的miRNA,研究报道miR-216a能通过增加内皮细胞通透性参与急性胰腺炎并发急性肺损伤[5]。血管生成素样蛋白4(angiopoietin like 4,ANGPTL4)是一种血管生成刺激因子,在空气污染诱导的小鼠肺损伤中,ANGPTL4表达上调与小鼠肺部炎性反应、肺泡数量减少和肺功能损伤有关[6]。然而,关于miR-216a、ANGPTL4在人类ARDS中的临床意义尚无研究报道,现分析ARDS新生儿血清miR-216a、ANGPTL4水平与病情严重程度及预后的关系,以确定miR-216a、ANGPTL4是否可以作为ARDS新生儿预后的生物标志物,报道如下。
1 资料与方法
1.1 临床资料 选取2019年7月—2022年3月亳州市人民医院新生儿重症监护室(NICU)收治的ARDS新生儿160例为ARDS组,男106例,女54例,日龄3~17(9.96±2.71)d;胎龄25~41(36.61±3.72)周;分娩方式:阴道分娩77例,剖宫产83例;出生体质量1.98~3.71(2.65±0.51)kg;ARDS病因:误吸36例,脓毒症61例,肺炎36例,胎粪吸入15例,其他原因12例;出生后5 min时Apgar评分:4~10[8.00(7.00,9.00)]分;机械通气时间:1~15[7.00(5.00,9.00)]d。另选取同期健康新生儿36例为健康对照组,男23例,女13例,日龄1~20(10.03±1.98)d;分娩方式:阴道分娩20例,剖宫产16例;出生体质量2.15~4.41(2.83±0.79)kg。2组新生儿性别、日龄比较差异无统计学意义(P>0.05)。本研究经医院伦理委员会批准(2019亳伦字0154),受试儿家属或监护人知情同意并签署知情同意书。
1.2 病例选择标准 (1)纳入标准:①符合2017年国际性多中心多学科协作组“新生儿急性呼吸窘迫综合征蒙特勒标准”[7]诊断标准;②发病(明确或可疑临床损伤出现后)时间≤7 d。(2)排除标准:①先天性疾病;②膈疝、肺发育不良、肺腺瘤样畸形等遗传性缺陷;③脑性过度换气;④恶性肿瘤;⑤严重肝肾功能障碍;⑥资料不全。
1.3 检测指标与方法
1.3.1 血清miR-216a、ANGPTL4水平检测:收集ARDS新生儿入NICU后6 h内、健康新生儿入组时股静脉血3 ml,离心留取血清分置2份,保存于-80℃冰箱中待测。一份血清标本用于qPCR,Trizol试剂盒(武汉科昊佳生物科技有限公司)提取血清总RNA,纯度、浓度合格后反转录试剂盒(日本TaKaRa Bio公司)逆转录合成cDNA,根据SYBR Green qPCR Mix试剂盒(南京欧凯生物科技有限公司)进行PCR扩增:miR-216a上游引物:5′-TAATCTCAGCTGGCAACTGTGA-3′,下游引物:5′-TCACAGTTGCCAGCTGAGATTA-3′;以U6为内参;反应条件:95℃预变性90 s、95℃变性30 s、63℃退火30 s、72℃延伸15 s,循环40次后采用2-ΔΔCT法计算血清miR-216a表达量。另一份血清标本采用ELISA试剂盒(武汉伊莱瑞特生物科技股份有限公司)检测ANGPTL4水平。
1.3.2 病情和预后分组:ARDS新生儿入NICU后首次机械通气时计算氧指数(oxygenation index,OI)=吸入氧浓度×平均气道压×100/动脉血氧分压,参考“新生儿急性呼吸窘迫综合征蒙特勒标准”[7]将ARDS新生儿分为轻度亚组62例(OI 4~<8)、中度亚组53例(OI 8~<16)、重度亚组45例(OI≥16)。所有ARDS新生儿均参考文献[8]接受机械通气、高频振荡通气、肺表面活性物质替代、体外膜肺氧合等治疗,根据病情危重放弃治疗、转院、死亡或痊愈出院分为预后良好亚组103例和预后不良亚组57例。

2 结 果
2.1 2组血清miR-216a、ANGPTL4水平比较 ARDS组血清miR-216a水平低于健康对照组(1.95±0.32 vs.3.84±0.49),而ANGPTL4水平高于健康对照组[472.84(201.47,743.10)μg/L vs.61.70(52.89,87.69)μg/L](t/U=21.964、9.242,P均<0.001)。
2.2 不同病情严重程度ARDS新生儿血清miR-216a、ANGPTL4水平比较 轻度亚组、中度亚组、重度亚组新生儿血清miR-216a水平依次降低,而ANGPTL4水平依次升高(P均<0.01),见表1。

表1 不同病情严重程度ARDS新生儿血清miR-216a、ANGPTL4水平比较
2.3 ARDS新生儿血清miR-216a、ANGPTL4水平与OI的相关性 160例ARDS新生儿OI为4.23~23.50[9.91(6.60,16.49)],Spearman相关系数分析显示,ARDS新生儿血清miR-216a与OI水平呈负相关(rs=-0.635,P<0.001),血清ANGPTL4水平与OI呈正相关(rs=0.693,P<0.001)。
2.4 不同预后ARDS新生儿的临床/病理特征比较 预后不良亚组患儿胎龄、出生体质量、Apgar评分及血清miR-216a水平低于预后良好亚组,机械通气时间、OI及血清ANGPTL4水平高于预后良好亚组(P<0.01),2亚组患儿性别、日龄、ARDS病因、剖宫产比例比较差异无统计学意义(P>0.05),见表2。
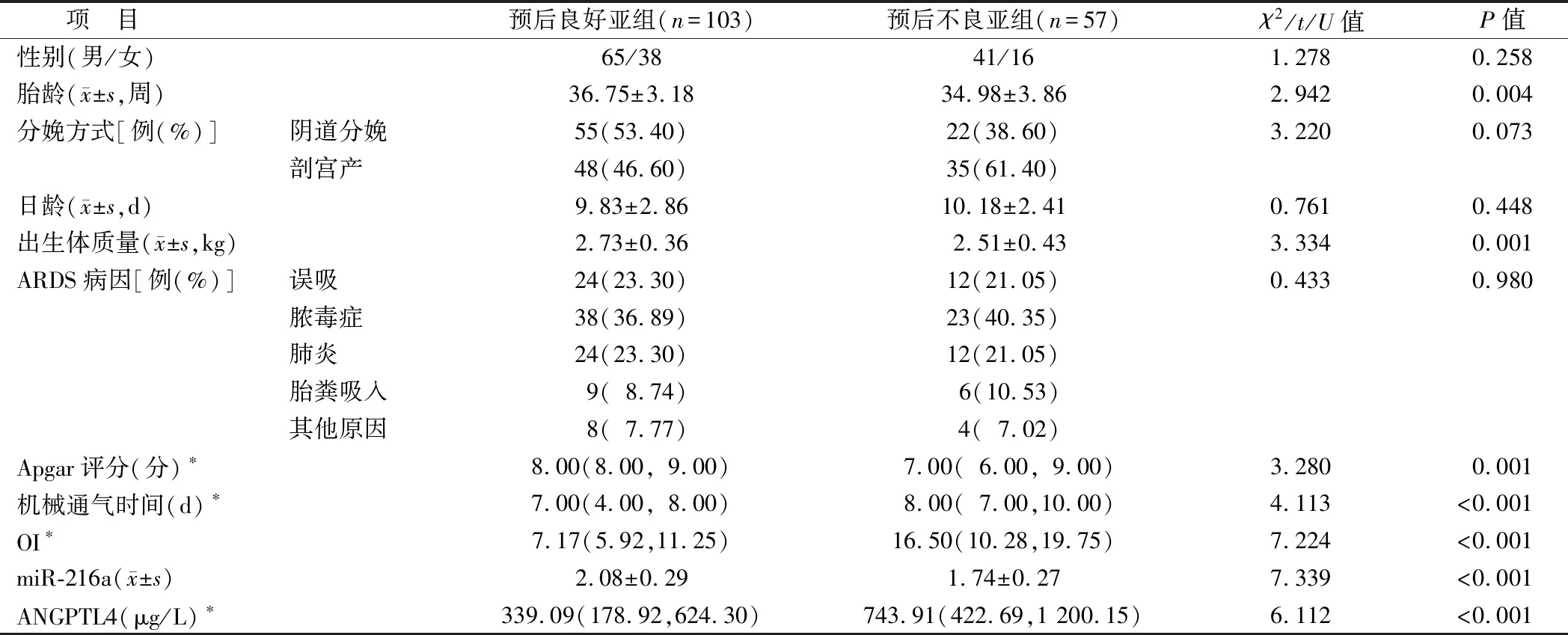
表2 不同预后ARDS新生儿临床/病理特征比较
2.5 ARDS新生儿预后不良的多因素Logistic回归分析 以预后情况(不良为“1”,良好为“0”)为因变量,以胎龄、出生体质量、Apgar评分、机械通气时间、OI、miR-216a、ANGPTL4为自变量,多因素Logistic回归分析显示,胎龄延长、Apgar评分增加及血清miR-216a 升高为ARDS新生儿预后不良的独立保护因素,机械通气时间延长、OI升高及血清ANGPTL4升高为其独立危险因素(P<0.05),见表3。
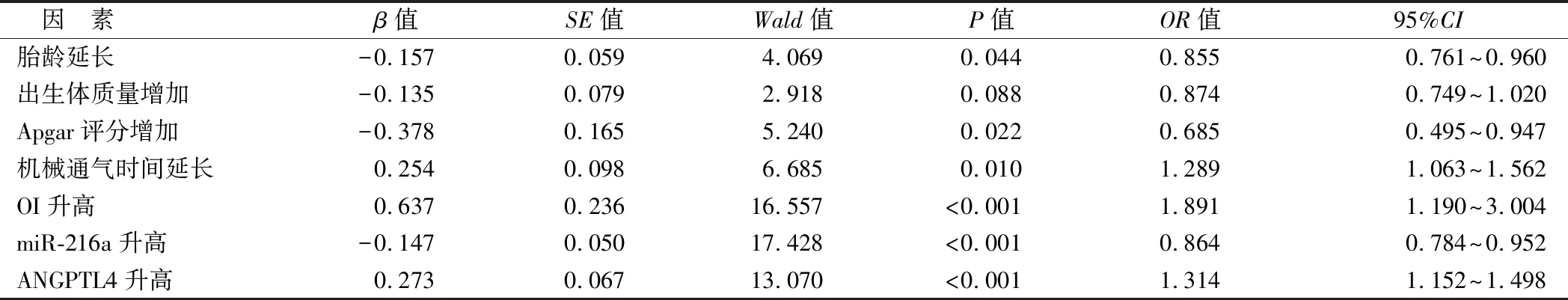
表3 ARDS新生儿预后不良的多因素Logistic回归分析
2.6 血清miR-216a、ANGPTL4水平预测ARDS新生儿预后不良的价值 绘制ROC曲线结果显示,血清miR-216a、ANGPTL4及二者联合预测ARDS新生儿预后不良的AUC分别为0.796、0.792、0.902,二者联合预测价值较单独预测高(Z=3.818、3.484,P均<0.001),见表4、图1。
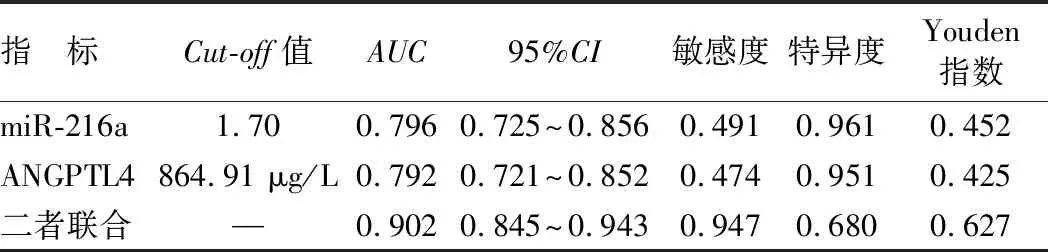
表4 血清miR-216a、ANGPTL4水平单独与联合预测ARDS新生儿预后不良的价值

图1 血清miR-216a、ANGPTL4水平单独与联合预测ARDS新生儿预后不良的ROC曲线
3 讨 论
ARDS是临床常见的危重症,不同于儿童和成人的ARDS以肺容积减少,肺顺应性降低,通气/血流比值失常为主要病理特征,新生儿ARDS以广泛性肺泡萎陷和嗜伊红透明膜形成为主要病理特征,且新生儿ARDS具备免疫功能低下、支气管肺发育不良易感性、肺生物学和成熟度差等差异和胎粪吸入综合征、呛奶、新生儿窒息、坏死性小肠结肠炎等独特触发因素[9]。尽管2017年世界上首次将新生儿ARDS与儿童和成人ARDS分离,并开发了独立的“蒙特勒标准”[7],但新生儿ARDS仍然缺乏特异性的治疗方式,病死率较高[10-12]。研究表明,各种病因能直接或间接通过炎性反应损伤肺泡上皮细胞和血管内皮细胞,同时黏附于受损血管内皮的中性粒细胞能迁移至肺泡腔和肺间质,进一步促进炎性介质释放,引起失控性炎性反应,加重肺泡损伤和肺血管通透性,恶化肺功能[3]。
miRNA是一类长度为18~25个核苷酸的小分子,通过与mRNA的3'-非翻译区互补配对调控基因表达,在ARDS发生发展中发挥重要作用[13-15]。miR-216a定位于人染色体2p16.1,是先天和适应性免疫反应的调节剂,多项研究报道miR-216a在炎性反应相关疾病中异常表达,如Liu等[16]研究报道,miR-216a在支气管肺炎中表达下调,能通过下调转化生长因子β受体2抑制转化生长因子β1信号传导减轻脂多糖诱导的支气管上皮细胞炎性反应。贾磊等[17]研究报道,miR-216a在表皮葡萄球菌感染致腹膜透析相关腹膜炎中表达下调,能靶向高迁移率族蛋白B1抑制腹膜炎性反应。上述研究表明,miR-216a在多种疾病中具有抗炎作用。且近年一项细胞实验也显示,miR-216a高表达可能通过抑制炎性反应改善肺内皮细胞通透性[5]。本研究中观察到ARDS新生儿血清miR-216a表达下调,提示miR-216a可能参与ARDS发生。“蒙特勒标准”认为氧合指数易受呼吸机压力参数影响,且在高频振荡通气下不能有效获得呼气终末正压,因此推荐使用OI量化评估新生儿ARDS严重程度,OI越高反映ARDS新生儿低氧血症和呼吸窘迫症状越严重[7]。本研究结果显示,ARDS新生儿血清miR-216a水平随着病情加重而降低,其水平升高为ARDS新生儿预后不良的独立保护因素,说明miR-216a水平与新生儿ARDS病情严重程度和预后密切相关,分析与miR-216a能通过抗炎作用抑制肺部炎性反应发展,减轻肺泡损伤和肺血管通透性有关,miR-216a水平越高肺功能越好,因此预后不良风险降低,其机制可能与miR-216a能抑制相关信号通路传导有关。Janus激酶2/信号转导和转录激活子3(JAK2/STAT3)和核因子-κB(nuclear factor-κB,NF-κB)信号通路是参与ARDS的重要促炎信号通路[18-19]。Kong等[20]通过脂多糖诱导急性肺损伤发现,miR-216a能通过降低JAK2/STAT3和NF-κB磷酸化信号,抑制JAK2/STAT3和NF-κB信号传导减轻肺部炎性反应损伤。
ANGPTL是一类结构与血管生成素相似的分泌蛋白家族,ANGPTL4主要由肝脏和脂肪表达,能通过抑制脂蛋白脂肪酶调节脂代谢,在代谢相关疾病中发挥重要作用[21]。近年研究发现,ANGPTL不仅参与脂代谢调节,还具有调节炎性反应和血管通透性等作用,敲低ANGPTL4通过抑制NF-κB信号通路抑制促炎细胞因子表达,上调ANGPTL4能通过增强炎性反应导致血管内皮通透性增加[22-23]。在肺损伤研究模型中发现,ANGPTL4在无菌性急性肺损伤过程中被大量激活和转录,参与肺部炎性反应和肺泡损伤[24]。另一项肺炎球菌性肺炎研究中,外源性给予ANGPTL4抗体治疗能减轻肺炎球菌性肺炎的肺水肿和肺损伤[25]。上述研究表明,ANGPTL4在肺损伤中发挥重要作用。本研究结果显示,ARDS新生儿血清ANGPTL4水平升高,提示ANGPTL4可能参与ARDS发生,可能与ARDS发生后ANGPTL4被激活和转录有关。进一步分析发现,ARDS新生儿血清ANGPTL4随着病情加重而升高,是ARDS新生儿预后不良的独立危险因素,说明血清ANGPTL4水平与新生儿ARDS病情严重程度及预后密切相关,分析与ANGPTL4能通过激活NF-κB信号通路参与肺部炎性反应和增加肺血管通透性有关。Guo等[26]通过脂多糖诱导急性肺损伤发现,沉默ANGPTL4能靶向沉默信息调节因子2相关酶1抑制NF-κB信号激活,改善肺部炎性反应和肺通透性。本研究结果还显示,胎龄延长、Apgar评分增加为ARDS新生儿预后不良的独立保护因素,机械通气时间延长、OI升高为独立危险因素,分析是胎龄越长的ARDS新生儿肺部发育更成熟,Apgar评分越高反映ARDS新生儿供氧状况更好,因此预后更好,而机械通气时间越长和OI越高反映ARDS新生儿病情越危重,因此预后越差。本研究ROC曲线分析显示,血清miR-216a、ANGPTL4水平单独预测ARDS新生儿预后不良的AUC分别为0.796、0.792,均不足0.80,而二者联合预测ARDS新生儿预后不良的AUC增加至0.902,说明血清miR-216a、ANGPTL4水平均能作为ARDS新生儿预后不良的辅助预测指标,且联合检测血清miR-216a、ANGPTL4水平对ARDS新生儿预后不良的辅助预测价值更高。
综上所述,ARDS新生儿血清miR-216a水平降低,ANGPTL4水平升高,二者与ARDS新生儿病情严重程度及预后密切相关,可作为ARDS新生儿预后评估的生物标志物。但本研究样本量较少,还需多中心大样本研究进一步证实。
利益冲突:所有作者声明无利益冲突
作者贡献声明
姜梨梨:设计研究方案,实施研究过程,收集整理资料,论文撰写;付杰:课题设计,监督研究过程,进行统计学分析,论文修改;郑爱华、刘军:提出研究思路,分析试验数据,论文审核

