生物3D打印在大面积骨骼肌损伤中应用研究进展
潘昕瑶 李婷 吴耀彬 李严兵 黄文华,2
1南方医科大学基础医学院医学生物力学广东省重点验室,人体解剖学国家重点学科广东省医学3D打印应用转化工程研究中心(广州 510515);2南方医科大学第三附属医院3D打印应用翻译广东医疗创新平台(广州 515510)
骨骼肌(skeletal muscle)约占人体质量的45%[1],通过对骨骼收缩牵拉参与骨骼的运动与支持。骨骼肌有着丰富的血管与神经网络,调节肌肉的物质交换营养代谢活动,常因疾病或创伤等受损导致部分功能障碍,较小损伤骨骼肌组织可自行修复再生,但大面积损伤超过肌组织再生能力需手术介入治疗[2]。大面积骨骼肌损伤(volumetric muscle loss,VML)是一种由于创伤、骨折固定或退行性疾病等病因[3],导致其损伤超出组织自身修复再生能力的慢性功能损害[4],严重可导致终生的功能缺陷。目前临床促进骨骼肌再生的治疗主要有手术介入、纳米技术等[5],然而上述方法无法产生完整的血管及神经连接使组织完全再生及功能恢复[6]。
骨骼肌组织工程(skeleton muscle tissue engineering,SMTE)旨在修复缺损重建骨骼肌结构与功能[7],为目前的临床治疗提供一种组织修复再生的新方案。3D生物打印技术作为一种增材制造技术,基于三维数字模型设计,采用活性生物材料可以在特定的条件下以微米级的精确度对细胞或生物材料进行有序排列。生物3D打印可模拟组织复杂的微观结构并精确控制细胞材料沉积及细胞的排列分布[8],在骨骼肌组织工程应用中有得天独厚的优势,已广泛应用于SMTE骨骼肌构建[9-10]。此外,3D打印技术分辨率在10~10 000 μm,能够构建更精细的仿生结构[11]。体内外骨骼肌构建工程方法已被应用于骨骼肌再生策略,体外通常包括肌原细胞分化成肌管并在植入体内前通过生物反应器进行预处理,生成分化成熟的功能性收缩骨骼肌[12]。此外,通常使用细胞或多能诱导干细胞分化后共培养来促进血管网络和神经肌肉接头的形成。体内多移植黏附在支架上的细胞,并在移植部位刺激体内肌组织和血管神经的再生及与宿主的整合。此外,骨骼肌组织功能恢复需要血管及神经网络进行物质交换,在体内骨骼肌血管化可通过刺激现有血管向内生长形成新的毛细血管,目前常用血管生长因子(VEGF)[10]释放支架或具有特定结构及化学成分的支架来构建血管网络。
本文首先介绍主要的生物3D打印技术,并回顾了近年来生物3D打印技术和组织工程在VML中的研究进展,其中重点探讨了3D打印骨骼肌组织在临床中的应用进展,最后进行了生物3D打印骨骼肌组织工程修复VML的未来展望,以期为骨骼肌再生修复提供具有临床潜力的创新成果。
1 生物3D打印技术
目前常用于骨骼肌组织工程的生物3D打印工艺主要为挤出成型打印(extrusion-based bioprinting)、立体喷墨打印(stereoscopic inkjet printing)及激光辅助打印(laser-based bioprinting)[11](图1)。表1总结了三种主要技术,并对比了三种技术的生物性能、打印性等各种优缺点。
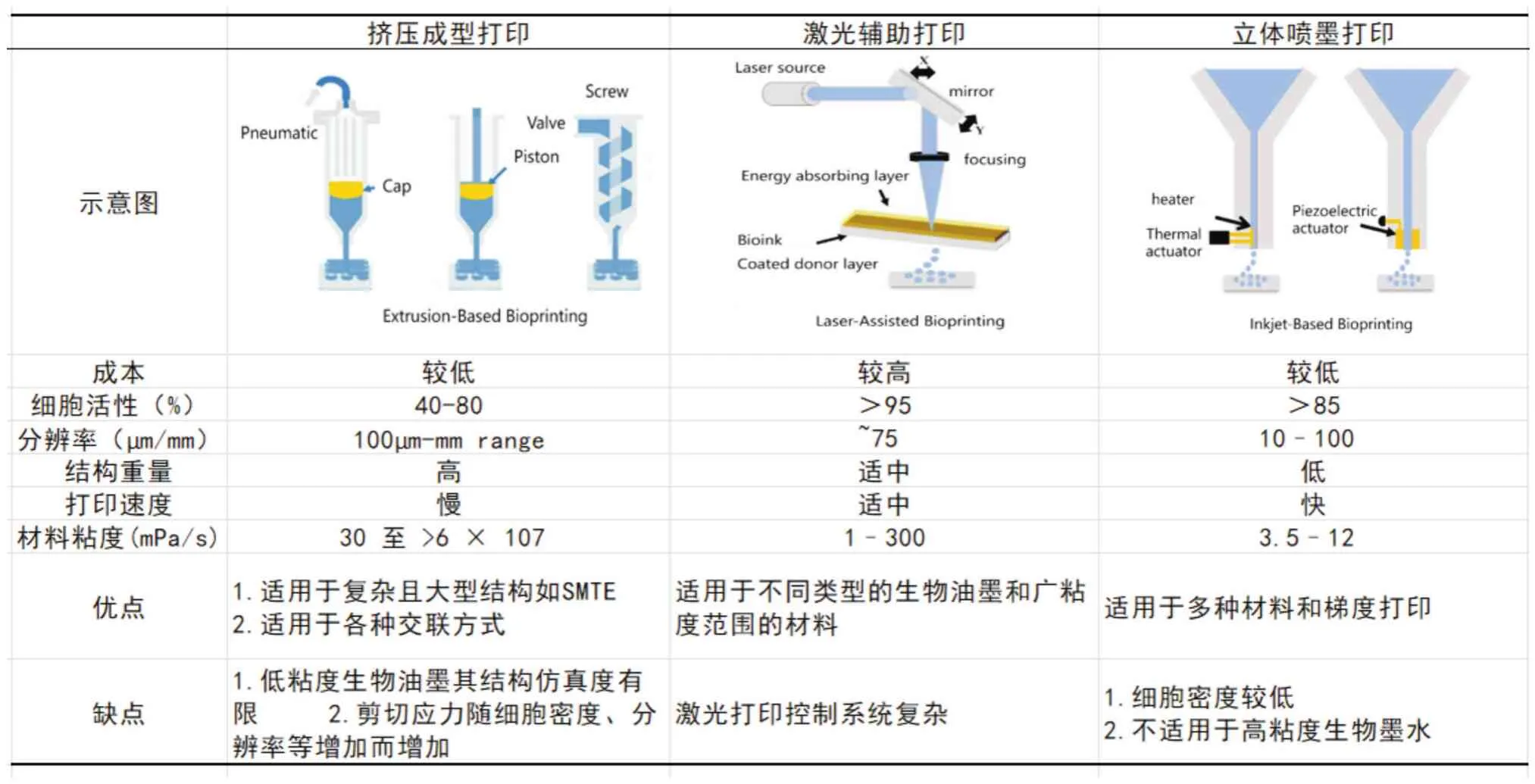
表1 常用的3D生物打印技术比较[16]Tab.1 Common 3D Bioprinting techniques[16]
1.1 挤出成型打印(extrusion-based bioprinting)挤出成型打印技术广泛应用于骨骼肌组织工程,采用气动或机械动力挤压生物材料或生物墨水,并逐层沉积打印[13],可兼容多种材料多梯度打印以及粘性范围广泛的生物材料(< 6 × 107mPas)[7],然而较强压力会影响细胞活性且低粘度的生物墨水打印的其结构仿真度有限。FAN等[14]采用气动挤压打印技术,构建不同直径骨骼肌肌束,采用MHC抗体染色、低温电子显微镜和phalloidin染色等方式直观地显示了纤维蛋白水凝胶系统中的骨骼肌组织三维构建的动态变化过程,并进行了小鼠成肌细胞(C2C12)的空间排列及分化的力学测试与数据分析。结果显示高压作用下,肌束较厚的细胞成熟度小于薄束的细胞成熟度,每单位面积较细的骨骼肌肌束纤维可承受更大的力,这种3D打印策略为体外3D骨骼肌组织的构建提供了理论参照。KIM等[15]开发神经-骨骼肌整合结构,旨在治疗大面积骨骼肌损伤及功能恢复,他们利用气动挤压打印含人类肌肉祖细胞(human muscle progenitor cells,hMPCs)和人类神经干细胞(human neural stem cells,hNSCs)骨骼肌结构并分析了神经细胞对肌肉细胞的活性、增殖及分化的影响,评估肌源性及神经元的分化和体外结构中神经骨骼肌肌肉接头(neuromuscular junctions,NMJs)的形成。结果表明,神经营养因子和神经递质在预形成的NMJs中释放,增加了细胞肌源性分化并诱导NMJ的形成,促进TA缺陷小鼠模型骨骼肌功能快速恢复,从而印证了hMPCs和hNSCs细胞间相互作用可促进肌肉的成熟和发育以及体内与宿主神经的快速整合以增加骨骼肌细胞的增殖和分化。
1.2 立体喷墨打印(stereoscopic inkjet printing)立体喷墨打印也可兼容多材料梯度打印,与挤出成型打印不同的是,立体喷墨打印设备简单、成本低廉,可采用喷墨喷射打印流体材料(通常使用低粘度<15 mPas生物墨水)进行打印,获得较高(>85%)的细胞活力,且在打印速度上更胜一筹(1~10 000滴/s)[16]。然而,打印结构分辨率和精确度受到不同喷嘴喷射形态及生物材料特性[17]的限制,在打印过程中生物墨水需作为具有适当的粘度的液体状态。此外,这种打印技术还存在生物墨水喷溅现象。
1.3 激光辅助打印(laser-assisted bioprinting)激光辅助打印是利用激光脉冲诱导金属薄膜(如金、钛)汽化,形成高压气泡,将生物墨水推向基地,需要粘度(<300 mPas)的生物墨水,成本高、速度快(< 1 600 mm/s),打印细胞活性高(95%)[18]。
2 3D生物材料/生物墨水在骨骼肌组织工程中的应用
在3D生物打印过程中,用于封装细胞的一种或几种生物材料的混合物称为生物墨水,可进行交联生成仿生组织结构[16]。GROLL等[19]提出生物墨水的新定义:“一种具有生物活性成分的、能够使用于生物制造技术的细胞墨水”,即适用于所有生物制造技术,如细胞打印、组织或器官构建、体外模型构建等。生物墨水主要根据细胞类型和生物打印技术等决定,理想的生物墨水应与组织结构、机械等特性相似或相同[7]。细胞是生物墨水中必不可少的组成部分,基于细胞的生物墨水的研究与开发是目前研究的重要领域[20]。
2.1 海藻酸盐(Alginate)海藻酸盐得益于良好的亲水性和生物相容性,可与大多天然和人工合成的聚合物及生物活性物质混合,创造出细胞生长的适宜环境,也可快速离子凝胶化并根据需要调节流变性及力学性能,较适用于挤压生物打印。目前,海藻酸盐已被用作肌细胞载体生物打印的主要生物墨水材料[21-23],常与明胶、纤维蛋白等结合,将其应用于3D生物打印[24]。DISTLER等[22]使用氧化藻酸明胶(oxidized alginate-gelatin,ADAGEL)水凝胶包裹C2C12细胞并调节喷嘴尺寸和挤压力,挤压C2C12细胞所产生剪切力可促进细胞定向排列并在细胞密度高的区域分化为有序的肌管段,研究表明ADA-GEL生物墨水成本低、可降解。此外,海藻酸盐常作为溶液增稠剂或结构稳定剂来调节生物墨水流变性,构建复杂结构,但配置过程中常因浓度过高而对细胞活性产生负面影响[7]。BOLÍVAR-MONSALVE 等[25]提出一种连续混合打印概念的挤压打印技术,结合明胶-甲基丙烯酰-海藻酸盐与成肌细胞,打印出仿生肌肉模型并展示出整齐排列的分层肌管结构,打印后显示高细胞活性(>85%)且打印后28 d仍保持高细胞活性。
2.2 甲基丙烯酰化明胶(gelatin methacrylate,GelMA)GelMA含固有RGD和MMP序列并提供细胞结合位点,与骨骼肌生物相容,有巨大研发潜力,具有可生物降解及可调节机械特性等优点,可设计用于控制各种细胞行为,如黏附、增殖和分化。相较高浓度GelMA,低浓度的GelMA水凝胶(≤5%W/V)更适合用作促进细胞高存活率、增殖及分化的生物墨水。然而,由于低浓度的GelMA打印性差且堆积能力有限因而限制了应用[26]。RONZONI等[27]等选用了三种不同的水凝胶生物墨水:(1)明胶甲基丙烯酸酯和海藻酸盐加紫外光交联;(2)甲基丙烯酸明胶、黄原胶与海藻酸纤维蛋白原;(3)氯化钙和凝血酶交联的纳米纤维化纤维素(nanofibrillated cellulose,NFC)/藻酸盐纤维蛋白原,对比了各自对C2C12细胞产生的影响。研究显示使用NFC/海藻酸纤维蛋白原为基础的水凝胶在培养7~14 d后成肌细胞开始融合,第21天和第28天在3D生物打印结构内形成广泛排列的多核肌管,研究表明细胞生长并成熟。此外,GelMA已作为负载细胞的水凝胶打印材料,广泛应用于体外血管形成及组织再生,然而GelMA预聚体原位紫外线交联可能会引起体内免疫抑制并加速组织老化或癌变[28]。NOSHADI等[29]设计了一款可注射、光交联的GelMA水凝胶:以伊红Y为光引发剂,三乙醇胺(TEA)为共引发剂,n-乙烯基己内酰胺(VC)为共单体并光交联,用于心肌组织修复。进一步评估力学性能、孔隙度及生物相容性的研究显示,可见光交联的GelMA水凝胶可促进细胞生长和功能恢复,在心脏、血管等多种软组织的修复与临床转化应用有巨大潜力。LEE等[30]使用含有hMPCs肌细胞外基质的生物墨水结合聚乙烯醇开发了一种可自我校对肌纤维排列的骨骼肌模型,混合生物墨水共同促进了hMPCs增殖与肌源性分化,且这种自我校对的结构整合了血管与神经网络,加速骨骼肌功能恢复,有效修复并重建大面积骨骼肌损伤。LUO等[31]提出利用低温保护生物墨水的技术:通过冷冻板精确控温在垂直方向上直接进行挤压生物打印,3D低温打印水凝胶结构中的成肌细胞具有更强的活性、增殖及分化,以期应用于组织工程及再生医学方面。
3 生物3D打印技术制备骨骼肌组织工程支架
三维生物材料支架可为细胞提供人造ECM并模拟组织特性来诱导组织再生,掺入生长因子和蛋白质等生物活性剂可促进细胞粘附分子和生长因子的释放来引导细胞黏附、生长、增殖及分化。目前常用的支架主要有脱细胞支架、水凝胶、纳米/导电支架等[32-33],国外已有研究证实支架在体外和体内均支持成肌细胞生长成熟[34-35]并促进血管生成[36]。QIU等[37]利用脱细胞神经基质水凝胶(decellularized nerve matrix hydrogel,DNMG)和神经胶质源性神经营养因子(glial-derived neurotrophic factor,GDNF)修饰脱细胞神经基质支架促进神经的修复。实验桥接50 mm坐骨神经损伤并对修复结果进行电生理评估和再生骨骼肌组织检查等实验,结果证实DNMG和GDNF修饰的DNM-S支架增强了神经再生和功能恢复,在移植后的6个约肢体功能、电生理反应及组织学形态均有所改善,为治疗长神经缺损提供了有效的参考。
QUINT等[10]采用体内交联GelMA水凝胶制作支持黏附支架,在体内利用Laponite纳米黏土控制血管内皮生长因子(VEGF)的释放,用以打印骨骼肌结构。实验结果对比未经治疗的VML小鼠,打印支架可促进肌细胞生长及骨骼肌功能恢复,并增加代谢、减少纤维化的发生,该支架的外科植入为各种情况下的软组织损伤提供了快速有效的临床疗法。DU等[38]在支架中加入还原氧化石墨烯RGO以改善其力学性能及导电性,并借此开发了一种新型高弹性、可拉伸可降解、具有导电性的聚(柠檬酸-辛二醇-聚乙二醇)-石墨烯(graphene,PCEG)纳米复合材料,用于肌源性分化和骨骼肌再生。研究显示,不影响亲水性的前提下加入RGO石墨烯可显著提高抗降解及抗肿胀能力,增加了支架的肌纤维和体内的毛细血管密度,PCEG纳米复合材料的拉伸强度和模量均显著提高,材料保持了良好的弹性和拉伸性能。与PCE聚合物和PLGA相比,PCEG纳米复合材料显著增强了成肌细胞的附着、增殖及分化和体内骨骼肌组织修复。该研究为骨骼肌组织工程提供了一种具有良好电活性和生物相容性的高弹性、可吸收的纳米复合材料用以制备支架。
4 生物3D打印骨骼肌组织工程的组织修复及临床应用
4.1 组织修复在KIM等[11]的工作中进行了打印骨骼肌结构的体内研究,结果显示在植入后8周大鼠胫骨前(TA)肌肉缺损模型的3D仿生骨骼肌完成了82%的功能恢复,并且与宿主的血管和神经网络相互整合。其团队后续的研究中,更是将神经细胞整合到生物打印的骨骼肌结构中促进其与宿主神经快速整合,以及体内肌纤维的神经肌肉接头NMJ的形成[15]。尽管选用的大鼠TA模型免疫功能低下,仍需进一步研究炎症和免疫反应等相关宿主反应,但上述研究为功能性仿生骨骼肌植入治疗VML提供了成功的参考。骨骼肌功能恢复需要脉管系统来供应营养物质,运输代谢废物,因此在没有血管神经支持环境下,难以修复受损的骨骼肌组织结构,促进功能恢复,因此构建骨骼肌血管化和神经支配对SMTE骨骼肌再生及体外肌肉建模至关重要[6]。目前主要有两种方式诱导产生血管化及神经支配:一是体内进行血管化/神经连接;二是预血管化/神经连接[6,39](图2)。基于前期实验研究[15],KIM等[40]开发了一种由多层肌束和AChR簇组成的3D生物打印骨骼肌结构并对预形成的功能性AChR簇的作用、体内结构及神经支配情况进行评估。在大鼠盆底肌损伤模型中,植入预先制成的AChR簇可促进打印结构中功能性骨骼肌重建,并增加体内NMJ形成,为肌间神经网络连接以及盆底骨骼肌功能恢复重建提供了创新疗法。近年,脱细胞细胞外基质(decellularized extracellular matrix,dECM)支架及脱细胞生物支架已被广泛应用于VML及骨骼肌功能恢复等相关研究。组织特异性dECM生物墨水可提供复杂的相关微环境,模拟组织环境中的特定条件,然而在大型组织结构制作应用方面,dECM的机械性能和分辨率受限。LEE等[30]报道3D生物打印采用含有hMPCs的生物墨水仿制了可自动对齐的骨骼肌dECM结构,用于促进骨骼肌缺损的功能恢复,将hMPCs和聚乙烯醇混合出可光交联的骨骼肌细胞外基质dECM-MA生物墨水。体外研究表明,聚乙烯醇(PVA)纤维化或浸出后产生的微拓扑结构可诱导hMPCs进行自排列,生物墨水中的组织特异性生化信号以及聚乙烯醇纤维中获得排列引导的协同作用可改善hMPCs的分化,打印结构中显示宿主神经网络加速整合、体内血管内向生长,促进了骨骼肌功能快速恢复。dECM-MA结构中自对齐肌纤维显示出大鼠TA肌肉缺损模型的骨骼肌功能快速恢复,可促进宿主的血管化及神经整合,用以治疗VML、加速骨骼肌功能恢复。国外报道了开发了一种基于颗粒的打印容器,利用dECM生物墨水制作大体积骨骼肌结构治疗VML的新策略[39]。研究显示,相较于dECM海绵和dECM水凝胶结构,3D打印的骨骼肌结构在细胞活性、肌管形成及肌纤维重建等方便表现更为突出。此外在探究预血管化肌肉结构促进功能恢复方面,他们发现使用同轴喷墨打印将mdECM、vdECM和人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)掺入不同的生物墨水打印制造预血管化的骨骼肌结构可防止缺氧并促进VML大鼠模型功能恢复。实验显示,vdECM生物墨水在培养14 d时表现出最好的细胞增殖及血管生成相关的基因表达,植入的预血管化肌肉组织在VML大鼠模型中促进了骨骼肌新生以及85%的VML损伤的骨骼肌功能恢复。综上,骨骼肌结构的血管化和神经连接对肌肉打印结构的细胞活性、肌细胞成熟以及损伤后骨骼肌的功能恢复都是必要的。
4.2 临床应用生物工程所构建的3D骨骼肌模型已应用于药物筛选和疾病模型构建[41-42],并模拟组织或器官的正常生理机能在特定的环境中评估健康和患病状态[43]以改善患者的长期预后。此外还用于评估新研发的化妆品成分扩增肽的功效以验证打印测试平台,三维仿生骨骼肌的构建为肌肉疾病治疗[44]、药品研发和化妆品成分检测等领域提供了创新策略。在长期给药过程中,药物注射进肌肉组织并在一定时间内缓慢释放作用于靶组织,而现有的为口服用药研发的系统由于缺少复杂的肌肉组织生理环境,其结果往往不能充分反应肌肉注射(IM)给药在体内的缓释及代谢过程。GHOLOBOVA等[45]研发可预测肌内注射(IM)药代动力学及毒性的体外三维骨骼肌模型,人类生物人工肌肉(the human bio-artificial muscle,BAM)是由排列的肌纤维组成的肌肉束,可在电刺激或机械刺激下收缩活动,BAM测试并显示了荧光化合物5(6)-羧基-2',7'-二氯荧光素二乙酸酯(CDFDA)和pro-NanoLuc底物在体内的水解和还原反应,提高了对IM用药体内代谢的可预测性,降低了药物研发成本。然而BAM器官模型仅限于肌肉组织,并无其他器官如肝脏或免疫系统的参与以及血管神经网络系统,仍具有一定局限性。对于血管及神经网络系统的缺失,可以利用人源诱导多能干细胞(ihPSCs)衍生的ECs,PC和肌原细胞共培养,构建含有等基因hiPSC衍生的血管内皮细胞和运动神经元的多向人工肌肉[46]。
杜氏肌营养不良症(duchenne muscular dystrophy,DMD)是一种遗传性肌肉疾病,目前对此疾病研究常用的动物模型是拥有与DMD相同遗传模型的23号外显子的无效突变导致肌营养蛋白完全缺失的mdx小鼠系,但仍存在表型差异性且研究成本昂贵等缺点。EBRAHIMI等[47]使用健康来源及DMD患者来源肌细胞构建人类骨骼肌微组织(human skeletal muscle microtissues,hMMTs)可用于研究外显子跳跃及肌细胞保护收缩损伤机制等,首次在体外环境中从头形成了抗肌萎缩蛋白阳性肌管并概括了DMD部分的病理生理学特征和功能表型,但可能由于肌管成熟度不足或实验方法的局限性等原因没有再现DMD的肌膜缺损。动物模型的“B计划”研究导致器官芯片系统(organ-on-a-chip systems,OoC)应运而生,得益于其动态灌注,体积微小,高精度高通量等特性,多已应用于构建体内多器官微生理系统及药物筛选。AGRAWAL等[41]通过微流体装置创建了一个可灌注的3D骨骼肌OoC用以评估组织形成和损伤变化,不仅可构建健康人源细胞的仿生生理环境,更可以通过特定患者的病源细胞,如DMD干细胞,来开展个性化药物研发及疗效评估。
5 前景与展望
VML产生的负性微环境可抑制成纤维细胞的正常凋亡,并伴有慢性炎症及产生显著瘢痕组织,严重可导致终生的功能缺陷。目前临床治疗手术干预包括瘢痕清创、肌肉移植及假体植入等,尽管自体肌瓣移植可恢复部分肌肉功能,但常导致供区病变等因而无法产生完整的血管及神经连接使组织完全再生及功能恢复[7]。当前构建功能性仿生骨骼肌组织的一个重要的挑战是血管化和神经支配的形成,肌组织需要血管网络进行营养物质交换,而神经元-骨骼肌相互作用的关键是NMJ的形成。对于骨骼肌血管与神经的整合,目前研究分别报道了利用神经细胞(PC)和内皮细胞(EC)诱导血管网络[48]及神经连接[15]的形成,目前鲜有文献报道生物打印技术用于血管化或神经化骨骼肌构建,二者与宿主的整合仍需进行大量的体内研究与评估;此外,大量研究显示导电生物材料可促进电刺激诱导细胞的增殖与分化[33,49],对血管形成也有积极影响,然而电刺激尚未应用在体外改善肌体的血管化。宿主的免疫反应是仿生骨骼肌组织应用于临床的主要挑战之一,使用免疫原性低的材料,如纤维蛋白、特异性来源的生长因子等[50],可减少仿生组织植入后产生的不良反应。此外,开发高免疫相容性生物材料并在免疫相容模型中报道应用数据也将是未来主要研究热点之一。对于未来研究还应研究组织再生状态与功能改善之间的相关性,研究肌管发育的相关物理和生化机制。在临床应用方面,VML治疗后血管和神经再生的潜在协同效应进一步研究以改善临床治疗,最终实现骨骼肌组织的完全修复再生及功能恢复。

