谷子SiCBL3对非生物胁迫响应特征分析
赵晋锋,余爱丽,李颜方,杜艳伟,王高鸿,王振华
(山西农业大学谷子研究所,特色杂粮种质资源发掘与育种山西省重点实验室,山西 长治 046011)
钙离子(Ca2+)作为植物细胞第二信使,在植物生长发育和逆境胁迫响应的许多生理生化过程中发挥重要作用[1]。植物细胞内的Ca2+感应蛋白能感知由外界胁迫引起的Ca2+含量变化,并把钙信号传递给靶标蛋白以启动级联反应使植物应对各种逆境胁迫[2]。钙调磷酸酶B蛋白(calcineurin B-like proteins,CBL)是植物中重要的Ca2+感受器,其保守核心区域含4个EF-hand结构,每个EF-hand结构含有2个α-螺旋,由12个典型氨基酸残基构成的环连接,形成螺旋-环-螺旋典型结构[3]。另外,CBL的C端含有1个保守氨基酸残基组成的PFPF基序,其中丝氨酸残基可被CIPK磷酸化,其他残基可作为分子调控的开关[4-6]。CBL通常与其靶蛋白CIPK(CBLinteracting protein kinase,CIPK)构成CBL-CIPK信号途径,在植物逆境响应过程中发挥重要作用[7]。植物CBL是多基因家族,目前在许多植物中都发现了CBL基因家族,如拟南芥、水稻,玉米,高粱、杨树、棉花、苜蓿、甘草、黄瓜、梨等[8-14]。拟南芥AtCBL4参与SOS途径,把多余的Na+排出细胞以提高植物对盐胁迫的耐受性[15],水稻、谷子中的同源CBL4基因也参与SOS途径,并行使AtCBL4相类似的功能[16-17]。玉米ZmCBL4可以显著提高转基因拟南芥的耐盐性[18];GhCBL2和GhCBL3在调节棉纤维的伸长方面发挥重要作用[19];AtCBL1和AtCBL9参与调控拟南芥在低钾状态下K+吸收和转运[20];AtCBL2和AtCBL3参与拟南芥胚和种子发育以及高水平离子胁迫响应[21-22];水稻OsCBL2与大麦HvCBL2表达受赤霉素(gibberellins,GA)诱导上调,在籽粒糊粉细胞的糊粉体中特异表达,在糊粉体的形成中具有正调节作用[23];拟南芥AtCBL1/9参与植物响应干旱胁迫信号途径[24],AtCBL9参与磷酸化硝酸盐转运体CHL1,使其从低亲和性转变为高亲和性来发挥调控作用[25];AtCBL1/9还参与拟南芥活性氧信号调节过程[26];AtCBL2不仅负调控细胞膜上的H+-ATPase,而且参与了光信号途径[27]。越来越多的研究表明,CBL在植物逆境胁迫应答以及调节植物的生长和发育,硝酸盐、铵和铁的吸收和运输,维持K+、H+稳态,活性氧信号转导等方面发挥重要作用。
谷子[Setaria italica(L.)P.Beauv.]起源于我国,是抗旱、耐瘠、广适的C4禾本科重要粮食和饲草作物,在我国粮食生产及安全方面占有重要地位。CBL基因参与调节植物生长发育,尤其在响应植物逆境应答发面发挥重要作用,因此谷子CBL基因值得进一步研究。本课题组前期利用生物信息学方法鉴定了谷子CBL基因家族,并证明了SiCBL4可以和SiCIPK24互作调控植株的耐盐性[17]。在此基础上,本文重点分析SiCBL3在非生物逆境胁迫下的表达情况,旨在进一步揭示其在谷子逆境应答中的功能。
1 材料与方法
1.1 试验材料
谷子材料为豫谷1号,保存于山西农业大学谷子研究所生物技术课题。旱棚生长管理同大田;组培室温度为(22±2)℃,湿度60%,光照周期为16 h光照/8 h黑暗,光照强度约为130μmol·m-2·s-1。
1.2 材料处理
在谷子幼苗三叶一心期进行PEG(20%PEG-6000)、盐(250 mmol·L-1NaCl)、ABA(100μmol·L-1)、低温(4℃)和高温(42℃)胁迫处理,处理后0、1、3、6、12和24 h整株取样。旱棚对照生育期内正常浇水,干旱处理在进入相应生育阶段前1周开始,其他时间采用自然控水[28]。
1.3 SiCBL3基因特征分析
参考赵晋锋等[28]方法,对SiCBL3基因结构、蛋白特征及启动子区域顺式元件等参数进行分析。
1.4 总RNA提取、cDNA合成及引物设计
用生工生物工程(上海)股份有限公司TRIzol试剂盒提取植物总RNA,第1链cDNA合成试剂盒合成cDNA。引物利用Primer Primer 5.0设计,由生工生物工程(上海)股份有限公司合成。本文使用引物序列详见表1。
1.5 亚细胞定位
使用引物A、B(表1)扩增SiCBL3,反应体系20.0μL,包含10.0μL 2×PCR Mix、正反向引物(10μmol·L-1)各1.0μL、1.0μL cDNA模板、1.0μLTaqDNA Polymerase,无菌水补足至20μL。程序为95℃2.5 min;95℃15 s,60℃30 s,72℃45 s,30个循环;72℃10 min,4℃保存。目的片段回收后与线性化PCAMBIA2301-KY-GFP载体骨架重组,将连接产物转化大肠杆菌DH5α感受态细胞涂布于含有卡那霉素(Kan,50μg·mL-1)的LB固体平板,37℃倒置培养。单克隆菌株于含有相应抗性的LB液体培养基中,37℃、260 r·min-1过夜培养,将经PCR检测的菌液送生工生物工程(上海)股份有限公司测序验证。用生工生物工程(上海)股份有限公司质粒提取试剂盒提取含GFP空载体与含目的基因载体的质粒DNA并纯化备用。拟南芥原生质体准备参照Zhang等[29]描述方法,拟南芥原生质体转化参考Gu描述方法[30]。利用Nikon C2-ER激光共聚焦显微镜观察、拍照。
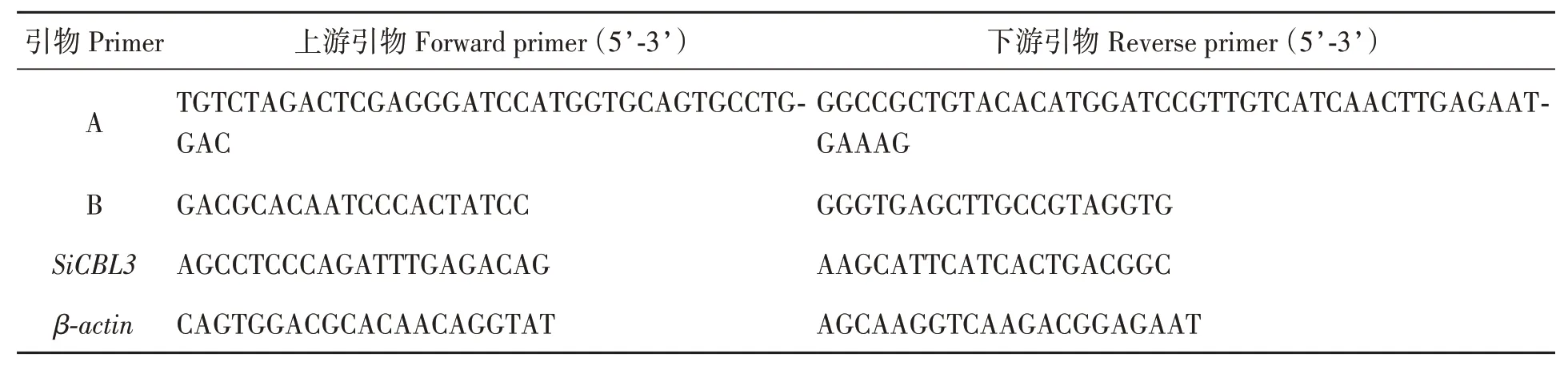
表1 本文实验使用引物Table 1 Primers used in this study
1.6 荧光实时定量PCR分析
以谷子β-actin基因(Seita.7G294000)为参照进行Real-time PCR,反应体系20μL,包含10μL 2×荧光染料混合液、0.4μL正向引物(10μmol·L-1)、0.4μL反向引物(10μmol·L-1)、2μL cDNA模板、7.2μL无菌水。程序为95℃,3 min;95℃,5 s,60℃,10 s,72℃,15 s,45个循环。试验设计3次重复,采用相对定量2-ΔΔCT方法[31]计算相对表达。
2 结果与分析
2.1 SiCBL3基因特征参数
Phytozome数据库显示,SiCBL3基 因ID为Seita.3G375800,位于3号染色体的47 858 843~47 863 510 bp位置,基因组序列长4 667 bp,有2个转录本(Seita.3G375800.1和Seita.3G375800.2),长度分别为1 492和1 364 bp,蛋白质编码区(coding sequence,CDS)序列均为678 bp,编码226个氨基酸。2个转录本在编码区均含7个内含子以及3个典型的EF-hand功能域;而转录本2在5’非翻译区还含有1个内含子。SiCBL3分子式为C1163H1829N301O352S7,预测编码蛋白质分子质量为25.88 kD,等电点为4.87,不稳定指数(the instability indexⅡ)为33.51,脂 肪 系 数(aliphatic index)为95.69,平均疏水指数(grand average of hydropathicity)为-0.240。SiCBL3基因启动子区域顺势元件分析发现植物激素应答、逆境应答、光应答和其他应答等顺势元件(表2)。

表2 SiCBL3基因启动子区域顺式元件预测Table 2 Putative cis-elements in the promoter of SiCBL3
2.2 SiCBL3蛋白亚细胞定位分析
利用携带BamHⅠ酶切位点的PCAMBIA2301-KY-GFP为载体骨架构建SiCBL3亚细胞定位载体。通过酶解液法得到转基因拟南芥原生质体。观察SICBL3-GFP表达结果(图1),发现与GFP对照相比SICBL3-GFP表达强度较弱,推测其发光位于液泡膜上。
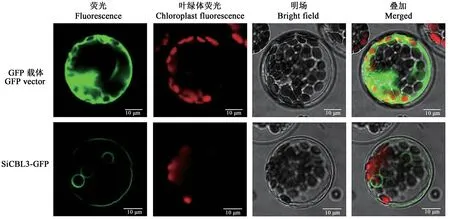
图1 SiCBL3亚细胞定位Fig.1 Sub-cellular localization of SiCBL3
2.3 SiCBL3苗期逆境胁迫及组织表达分析
如图2所示,SiCBL3在苗期所有逆境胁迫处理下表达量均有所上调。ABA胁迫下,在1、3、6 h表达量明显提升,在6 h达峰值,为对照的2.74倍,随后下降到对照相近水平;盐胁迫下,表达量呈升降升降趋势,在12 h达峰值,为对照的2.15倍;高温胁迫下呈升降趋势,在6 h达峰值,为对照的12.79倍;低温胁迫下呈升降升趋势,在3 h达峰值,为对照的2.93倍;PEG胁迫下呈降升降趋势,在12 h达峰值,为对照的2.57倍。
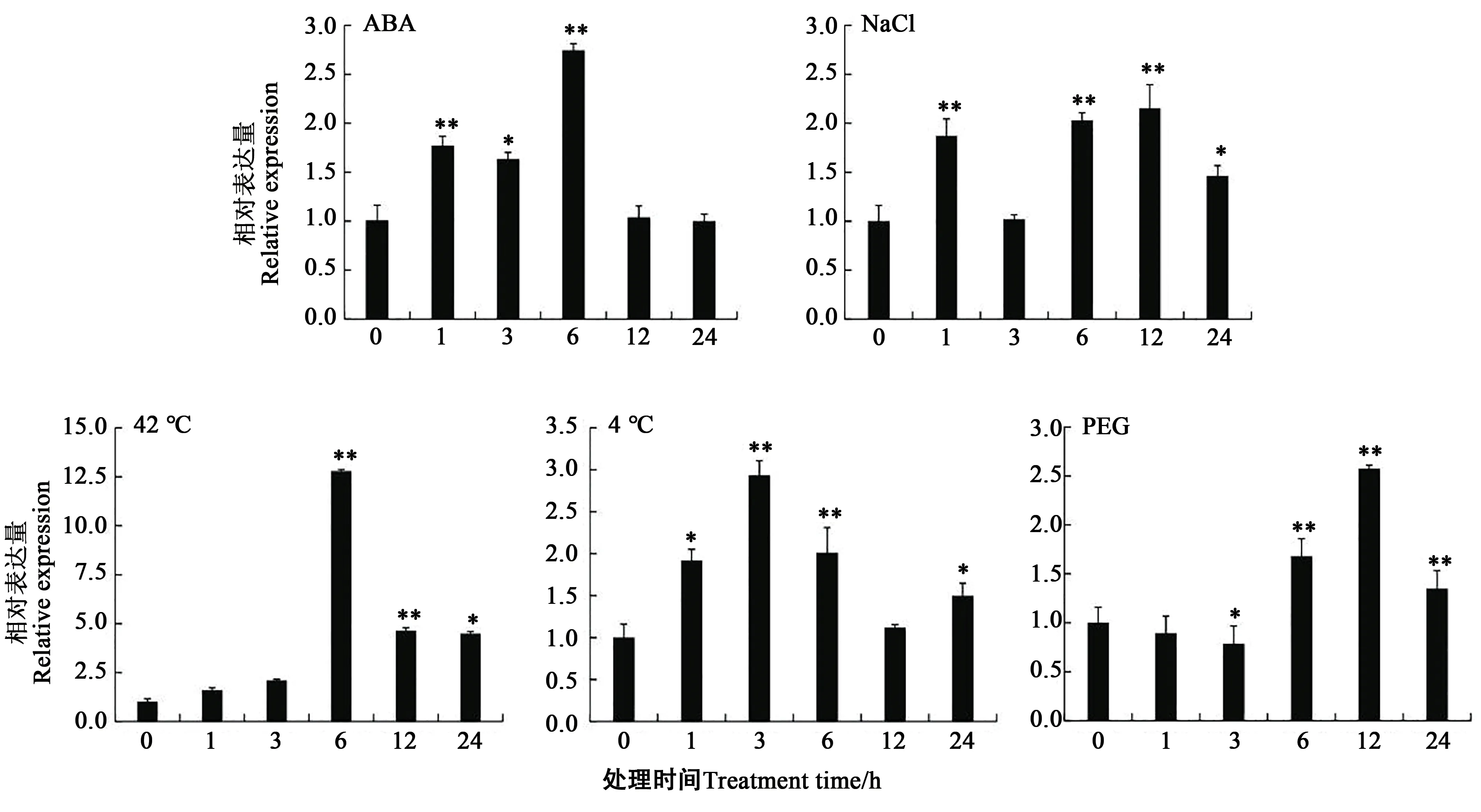
图2 SiCBL3苗期不同逆境胁迫表达分析Fig.2 Expression analysis of SiCBL3 under different stresses in seedling
不同组织器官表达分析(图3)表明,SiCBL3在倒2叶、茎杆、穗轴、幼穗、成穗、叶鞘中表达量相对较高,分别为旗叶表达量的12.04、3.37、2.37、2.25、2.07、2.63倍,在根中表达量相对较低,为旗叶的0.62倍。上述结果表明,SiCBL3在地上部组织中表达量较高,参与了谷子苗期干旱、盐、低温、高温和ABA等逆境胁迫响应,在非生物逆境胁迫信号途径中起重要作用。

图3 SiCBL3组织表达分析Fig.3 Expression analysis of SiCBL3 in different tissues
2.4 关键生育阶段干旱胁迫下SiCBL3表达分析
拔节期、抽穗期和灌浆期是谷子生长发育中的关键需水期,因此检测了SiCBL3在干旱胁迫下茎叶和根中的表达情况。如图4所示,在正常条件下,抽穗和灌浆期茎叶中SiCBL3表达量较拔节期均有较大上升,分别为拔节期的2.76和6.63倍,表明该基因随着植物生长发育其表达量逐步增加。在干旱胁迫下,3个生育阶段茎叶中SiCBL3表达量较对照同生育阶段均有大幅提升(干旱下拔节期、抽穗期和灌浆期表达量分别为对照拔节期的4.74、3.80和14.00倍)。根中SiCBL3表达量在对照和干旱胁迫下不同生育阶段整体趋势变化不大,对照中灌浆期最高,为对照拔节期茎叶的1.23倍;干旱胁迫下抽穗期比对照同期略有下降,而拔节期和灌浆期较对照同期略有上升,分别为对照灌浆期的1.24和1.84倍。不同生育阶段干旱胁迫分析表明,SiCBL3参与了谷子拔节期、抽穗期和灌浆期的干旱胁迫应答,而且其表达主要在地上部的茎叶等组织器官中。
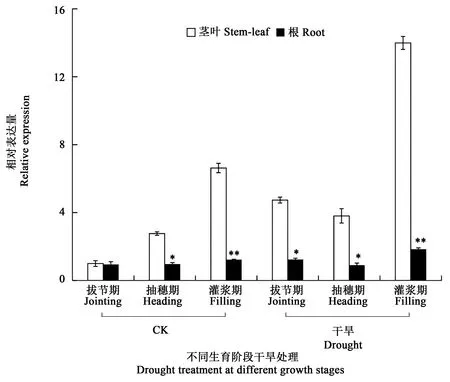
图4 关键生育阶段干旱胁迫下SiCBL3表达分析Fig.4 Expression analysis of SiCBL3 under drought stress at key growth stages
2.5 灌浆期干旱胁迫下不同组织SiCBL3表达分析
为进一步了解SiCBL3地上组织表达情况,分析了灌浆期干旱胁迫下SiCBL3在不同组织中表达情况(图5)。可以看出,正常条件下拔节期SiCBL3在倒2叶、茎、穗轴、叶鞘、籽粒中表达量相对较高,分别为旗叶的16.04、7.37、4.37、4.63和3.07倍,而在根中表达较低,为旗叶的1.64倍。在干旱条件下,SiCBL3在旗叶、倒2叶、穗轴、叶鞘和籽粒中比对照相应组织中表达量有显著提升,分别为旗叶对照的2.54、35.04、12.24、10.86和9.24倍,而茎和根中SiCBL3表达较对照相应组织略有降低。该结果表明,灌浆期无论是否受到干旱胁迫,SiCBL3都主要在地上部器官中表达;在灌浆期受到干旱胁迫时,SiCBL3在大部分地上组织中都被大量诱导表达,而在根中表达量变化不大。
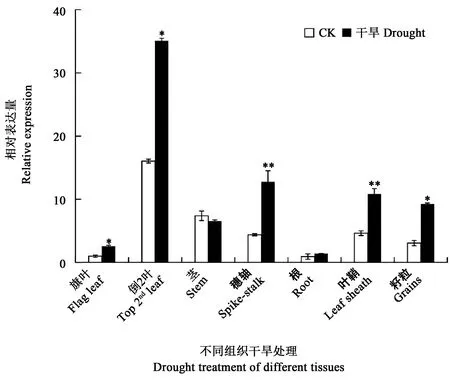
图5 灌浆期旱胁迫下SiCBL3组织表达分析Fig.5 Expression analysis of SiCBL3 in different tissues under drought stress at filling stage
3 讨论
谷子SiCBL3基因位于第3号染色体,含有CBL家族典型EF-hand功能域。检索发现,SiCBL3有2个转录本,转录长度不同,但其CDS序列长度和编码氨基酸完全一致。2个转录本编码区含7个内含子,2号转录本在其5’非翻译区还含有1个内含子,推测可能对其遗传信息表达具有某些调控作用。
苗期不同逆境胁迫分析揭示,SiCBL3表达受盐、高温、低温、PEG和ABA的诱导,胁迫下SiCBL3表达量具有不同程度增加。研究表明,AtCBL9的表达不仅受干旱、低温和盐的诱导,也受ABA的强烈诱导,主要在幼苗期参与拟南芥对逆境的胁迫应答[27]。ZmCBL4受盐、LiCl、PEG和ABA诱导,在盐胁迫应答中起重要作用[19]。梨的7个候选PbCBLs中,2个基因受盐胁迫诱导,3个基因分别受干旱、低温与ABA诱导表达[15]。本研究结果与已有报道不同物种CBL基因逆境表达结果相似,表明CBL家族基因受多种逆境诱导,揭示了SiCBL3广泛参与谷子苗期逆境应答。
CBL蛋白通常和其靶蛋白CIPK互作构成CBL/CIPK信号网络系统调控植物生长发育以及逆境应答。由于CBL和CIPK是成员之间彼此有较高同源性的多基因家族,而且CBL、CIPK以及不同CBL/CIPK之间有互作,因此CBL/CIPK系统介导的Ca2+调控体系非常复杂。同一家族的CBL基因受不同非生物逆境诱导表达的种类和程度以及表达组织都有所不同。SiCBL3的组织和关键生育阶段表达分析揭示,SiCBL3在地上部如倒2叶、茎秆、叶鞘等组织中表达较高,尤其是倒2叶中表达量最高,而在地下部根中表达较低,揭示SiCBL3在这些组织中高效表达以应对非生物逆境胁迫,在生长中后期更积极地参与植物对干旱胁迫的响应,特别是在灌浆期干旱胁迫应答中起重要作用。顺式应答元件分析表明,在SiCBL3启动子区域发现低温应答、干旱诱导以及脱落酸、水杨酸、茉莉酸甲酯、赤霉素等激素相关顺式应答元件。该结果不仅佐证了SiCBL3基因参与谷子逆境应答,也揭示SiCBL3可能在水杨酸、茉莉酸甲酯、赤霉素等激素调节介导的生物应激反应中起作用。大量光顺式元件以及昼夜节律控制、厌氧诱导、玉米醇溶蛋白代谢等顺式元件的发现表明,SiCBL3可能参与调控谷子的光温应答和相应的生理生化过程。
干旱、盐、低温是导致作物减产的主要限制因素,CBL基因家族在植物响应逆境胁迫、激素应答等植物生长和发育过程中发挥着重要作用,尤其与非生物逆境胁迫的信号传导密切相关[7]。谷子是我国典型的抗旱耐瘠特色作物,发掘谷子中的重要逆境相关基因并研究其功能具有重要意义。因此本文聚焦谷子SiCBL3基因,对其基因结构、蛋白特征、启动子区域顺式元件等参数进行了系统的分析和预测,并分析了其在苗期不同逆境、关键生育阶段和灌浆期不同组织干旱胁迫下的表达,结果表明SiCBL3在谷子苗期、拔节期、抽穗期和灌浆期干旱条件下参与了对干旱胁迫的响应,推测该基因参与谷子对非生物逆境的应答,尤其在抽穗期和灌浆期干旱胁迫应答中发挥重要作用。本研究结果为进一步分析CBL基因功能以及利用基因工程方法改善谷子抗逆性和提高产量提供了后备基因和理论支持。

