基于实时荧光环介导等温扩增技术同时检测副溶血弧菌与金黄色葡萄球菌
刘丹,谢加玲,张孟雨,陈松,李孜,钟青萍
(广东省食品质量安全重点实验室,华南农业大学 食品学院,广东 广州,510642)
近年来,食源性致病菌引发的食品安全问题在全球范围内造成了相当大的公共卫生负担,根据世界卫生组织2020年数据显示,全球每年有5.5亿人因食源性疾病引起腹泻、呕吐等,其中约23万人导致死亡[1-2]。据统计,超过70%的食源性疾病都是由食源性致病菌引起的,而其中又以细菌引起的食源性疾病居多[3-4]。副溶血弧菌(Vibrioparahaemolyticus)及金黄色葡萄球菌(Staphylococcusaureus)是其中2种重要的食源性致病菌,对于这2种致病菌的检测,传统培养方法仍是公认且可靠的方法,但需要经过细菌分离培养、形态学观察、生化鉴定等多个步骤,通常需要4~7 d,导致检测周期长且繁琐[5-6];常规PCR检测方法检测时间较长,不能满足现场检测的要求[7];基于免疫学技术的检测不能对死活细胞进行区分[8];而基于生物传感器的检测方法成本高,需要专业人士操作。
环介导等温扩增技术(loop-mediated isothermal amplification, LAMP)是由NOTOMI等[9]于2000年提出的一种核酸扩增技术,其具有灵敏度高、特异性强、快速、成本低、不依赖精密仪器的特点。目前,LAMP已经在动植物病原菌[10]、食源性致病菌[11-12]、转基因食品[13]及临床检测[14]等领域得到广泛应用。与常规聚合酶链式反应(polymerase chain reaction,PCR)相比,LAMP具有特异性好、灵敏度高、反应时间短的显著优势,其不足主要在于多重LAMP检测存在一定的挑战,由于多重LAMP是在一个反应体系中同时检测多个目的基因,要求反应期间不能出现引物自联、错配的情况,这就提高了引物设计难度,需要精确设计多个复合引物,但由于其具有较高的特异性和敏感性,仍是研究最广泛的等温扩增技术之一[15]。
副溶血弧菌编码β-内酰胺酶的基因blaCARB-17与其对青霉素的固有耐药性有关,且研究发现blaCARB-17在副溶血弧菌检测中具有较好的特异性[16]。金黄色葡萄球菌耐热核酸酶基因nuc是最常用的特异性靶基因,在金黄色葡萄球菌的临床分离株中高度保守,广泛用于金黄色葡萄球菌核酸鉴定的特异性靶点[17-18]。为此,本研究针对副溶血弧菌与金黄色葡萄球菌的这2种特异性基因设计引物,建立一种实时荧光LAMP同时检测副溶血弧菌与金黄色葡萄球菌的方法,能够实现在一次LAMP反应中同时快速、准确地检测2种食源性致病菌,为多重LAMP检测食源性致病菌的研究提供参考。
1 材料与方法
1.1 材料与试剂
目标及非目标菌株详情见表1。

表1 实验所用菌株Table 1 The bacterial strains used in this study
细菌基因组DNA快速抽提试剂盒(B518255)、溶菌酶、BstDNA聚合酶、10×ThermoPol缓冲液、MgCl2溶液、dNTP Mixture、灭菌双蒸水,上海生工(生物工程)股份有限公司;EveGreen(20×水溶液),翌圣生物科技(上海)有限公司。
1.2 仪器与设备
SW-CJ-1B超净工作台,苏州净化设备有限公司;Forma Class Ⅱ A2生物安全柜、Nano Drop 2000c超微量分光光度计,美国Thermo公司;高速冷冻离心机,德国Eppendorf股份有限公司;TP600梯度PCR仪,日本TaKaRa仪器有限公司;DYY-6C电泳仪,北京六一仪器厂;CFX 96 TouchTM荧光定量PCR仪、GelDoc XR凝胶成像仪,伯乐生命医学产品(上海)有限公司。
1.3 实验方法
1.3.1 菌株的培养
金黄色葡萄球菌在无菌条件下划线于Baird-Par- ker琼脂平板中,37 ℃下培养12 h,形成清晰的单菌落。挑取Baird-Parker琼脂平板上呈黑色或灰色且外围有透明圈的单菌落培养于TSB培养基中,37 ℃、150 r/min培养16 h;副溶血弧菌在无菌条件划线于TCBS琼脂培养基上,37 ℃培养12 h,挑取蓝绿色单菌落于含3%(质量分数)NaCl的TSB液体培养基中37 ℃、150 r/min培养16 h;其余菌株于TSB培养基中37 ℃,150 r/min活化16 h。
1.3.2 DNA模板的制备
根据细菌基因组DNA快速抽提试剂盒提取模板DNA,具体步骤按照试剂盒说明书进行,将提取后的DNA模板用超微量分光光度计测定其浓度,并于-20 ℃保存。
1.3.3 LAMP引物设计与合成
从GeneBank数据库公布的金黄色葡萄球菌(GenBank:V01281.1)和副溶血弧菌(GenBank: JX262976.1)的基因序列中,分别以nuc和blaCARB-17作为特异性靶基因,根据目的基因的保守区,利用Primer Premier 5.0软件(http://primerexplorer.jp/e/,Eiken Chemical Co.Ltd.)进行引物设计,采用NCBI Primer-blast工具(https://blast.ncbi.nlm.nih.gov/Blast.cgi,NCBI)确定引物并由生工生物工程(上海)股份有限公司合成,引物序列见表2。

表2 LAMP引物序列Table 2 Primer sequences of the LAMP
1.3.4 双重实时荧光LAMP方法的建立及条件优化
优化前双重实时荧光LAMPP反应体系(25 μL)包括:blaCARB-17-F3与blaCARB-17-B3各0.1 μmol/L,blaCARB-17-FIP与blaCARB-17-BIP各0.8 μmol/L,nuc-F3与nuc-B3各0.1 μmol/L,nuc-FIP与nuc-BIP各0.8 μmol/L,dNTPs 2.4 mmol/L,Mg2+6 mmol/L,BstDNA聚合酶12 U,10×Reation Buffer 2.5 μL,20×EvaGreen水溶液1 μL,副溶血弧菌及金黄色葡萄球菌DNA模板各1 μL,空白对照以等量ddH2O代替,补充无菌ddH2O至25 μL。
参考反应条件设置为:65 ℃ 1 min,共60个循环,每个循环结束时采集荧光信号;反应结束后80 ℃灭酶2 min;并对扩增产物进行熔解曲线分析,熔解曲线程序设置为:以0.1 ℃/5s速率由75 ℃升温至95 ℃,每升温0.1 ℃采集1次荧光信号,生成熔解曲线[19]。
分别对反应体系中的引物浓度比、dNTPs浓度、Mg2+浓度以及反应温度进行优化,其他条件保持不变,根据优化前的反应体系及反应条件进行实时荧光LAMP反应,通过Ct值及扩增产物荧光值确定适宜的反应条件[20-21]。具体参数设置见表3。
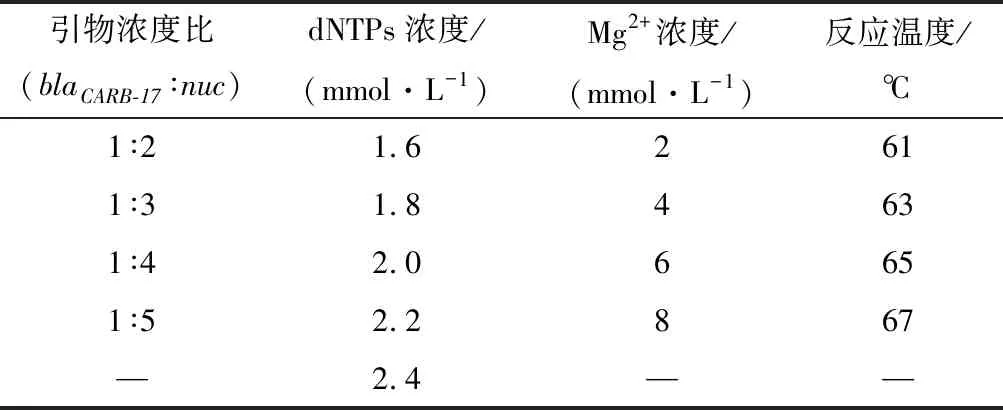
表3 双重实时荧光LAMP的反应条件优化Table 3 Optimization of the reaction conditions of the dual real-time LAMP
1.3.5 双重实时荧光LAMP特异性
分别以副溶血弧菌、金黄色葡萄球菌、副溶血弧菌及金黄色葡萄球菌、非目标菌株DNA为模板,按照优化后的反应条件进行实时荧光LAMP。荧光扩增曲线为“ S”型或类“ S”型则判定为阳性,扩增曲线为平的直线则判定为阴性。若呈现为阳性的扩增曲线,且扩增产物出现特征熔解峰的温度区间及特征熔解峰Tm值落在同一范围即可判定所建立的实时荧光LAMP方法特异性良好[22]。反应设置3个复孔,实验重复2次。
1.3.6 双重实时荧光LAMP灵敏度的评价
以超微量分光光度计测定DNA模板浓度,分别以10倍梯度稀释的副溶血弧菌、金黄色葡萄球菌及其混合DNA为模板,金黄色葡萄球菌DNA模板浓度为1.45×102~1.45×108copies/mL,副溶血弧菌DNA模板浓度为3.62×101~3.62×107copies/mL,以ddH2O作为空白对照,根据优化后的反应体系及条件进行实时荧光LAMP,同时进行双重PCR反应,通过比较评价双重实时荧光LAMP方法的灵敏度。双重PCR反应体系(25 μL)为:blaCARB-17-F3 0.4 μmol/L,blaCARB-17-B3 0.4 μmol/L,nuc-F3 0.4 μmol/L,nuc-B3 0.4 μmol/L,TaqPCR Master Mix 12.5 μL,副溶血弧菌及金黄色葡萄球菌DNA模板各1 μL,补充无菌ddH2O至25 μL。反应程序为:预变性95 ℃ 5 min;变性95 ℃ 30 s,退火60 ℃ 30 s,延伸72 ℃ 30 s,共35个循环;终延伸72 ℃ 5 min,反应结束后取3 μL扩增产物进行1%琼脂糖凝胶电泳。
1.3.7 双重实时荧光LAMP方法在人工模拟样品检测中的灵敏度
称取10 g经GB 4789.7 —2013及GB 4789.10—2016检测无副溶血弧菌及金黄色葡萄球菌污染的猪肉样品共7份,分别加入1 mL 10倍梯度稀释的副溶血弧菌与金黄色葡萄球菌菌悬液制备成不同浓度的人工污染样品,将人工污染样品加入至90 mL生理盐水后均质,除去大颗粒固体后吸取1 mL匀液按照1.3.2中的方法制备DNA模板,按照优化后的反应体系及条件进行检测。
1.3.8 数据处理
实验平行进行3次及以上,荧光定量PCR仪中导出LAMP反应扩增曲线和熔解曲线,利用Graph- Pad Prism8进行图像处理分析。
2 结果与分析
2.1 双重实时荧光LAMP方法的建立及条件优化
2.1.1 引物浓度的优化
我们研究发现当体系中blaCARB-17与nuc引物浓度比相同时,blaCARB-17扩增产物的荧光值远高于nuc扩增产物的荧光值,说明双重实时荧光LAMP反应中,相比于nuc基因,blaCARB-17基因具有扩增优势,因此需要进一步对blaCARB-17与nuc引物浓度比进行优化。由图1可知,随着nuc引物浓度增大,双重实时荧光LAMP反应的nuc扩增产物的荧光值增高,当blaCARB-17与nuc引物浓度比为1∶4时,两者的扩增产物的荧光值相当,分别为8×103、7×103RFU,因此确定blaCARB-17与nuc适宜的引物浓度比为1∶4。此外,无论两者引物浓度比为多少,blaCARB-17与nuc的特异性熔解峰出现的温度范围及Tm值均保持相对稳定,说明以blaCARB-17与nuc为靶基因的双重实时荧光LAMP方法可以有效地对副溶血弧菌及金黄色葡萄球菌同时进行检测。多重实时荧光LAMP反应体系中引物间的浓度配比十分重要,这是因为多重反应体系中存在着“优势扩增”现象,如果各组引物间浓度配比不合适可能导致体系中某一基因扩增量低,甚至不扩增[23]。
2.1.2 反应温度的优化
由图2可知,当反应温度为65 ℃时,双重实时荧光LAMP反应的Ct值最小,为28.37,此温度下的扩增产物荧光值约为3.0×104RFU;扩增产物荧光值最高对应的是61 ℃,为3.8×104RFU,略高于65 ℃下的荧光值,但其Ct值为33.20,高于65 ℃下反应的Ct值,因此选择65 ℃为适宜的反应温度,同时我们发现,反应温度对双重实时荧光LAMP的影响不大。

1-金黄色葡萄球菌nuc 扩增产物的特征熔解峰;2-副溶血弧菌blaCARB-17扩增产物的特征熔解峰;NTC-空白对照a-引物浓度比为1∶2的熔解曲线;b-引物浓度比为1∶3的熔解曲线;c-引物浓度比为1∶4的熔解曲线;d-引物浓度比为1∶5的熔解曲线图1 双重实时荧光LAMP引物浓度比的优化Fig.1 Optimization of concentration ratio of primers for dual real-time LAMP
a-61 ℃时的反应扩增曲线;b-63 ℃时的反应扩增曲线;c-65 ℃时的反应扩增曲线;d-67 ℃时的反应扩增曲线图2 双重实时荧光LAMP反应温度优化Fig.2 Optimization of temperature for dual real-time LAMP
2.1.3 dNTPs浓度的优化
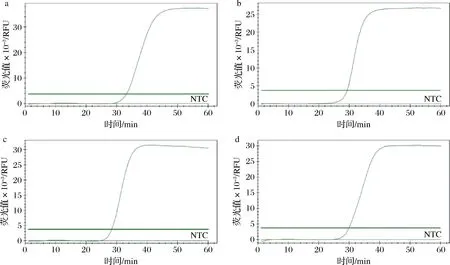
将dNTPs浓度分别设置为1.6、1.8、2.0、2.2、2.4 mmol/L,反应体系中其他成分浓度保持不变。如图3所示,当体系中dNTPs浓度为1.8 mmol/L时,扩增的Ct值最小,为29.69,扩增产物荧光值约为 2.0×104RFU,而其他dNTPs浓度扩增下Ct值均远大于该组,因此确定双重实时荧光LAMP的适宜dNTPs浓度为1.8 mmol/L。
2.1.4 Mg2+浓度的优化
由图4可知,当 Mg2+浓度为2 mmol/L时双重实时荧光LAMP反应不能正常进行,随着 Mg2+浓度的增加,反应的Ct值减小,当 Mg2+浓度为6 mmol/L时,扩增的Ct值最小,为26.43,扩增产物荧光值约为2.5×104RFU;而当 Mg2+浓度继续增加到8 mmol/L时,反应Ct值增加,为30.49,此时扩增产物荧光值约为2.1×104RFU。可见 Mg2+对LAMP反应是必需的,当 Mg2+浓度达到4 mmol/L时反应才能正常进行,而过高的 Mg2+浓度又会一定程度上抑制LAMP反应,双重实时荧光LAMP的适宜 Mg2+浓度为6 mmol/L。

1~5分别为dNTPs浓度为1.8、2.2、2.0、1.6、2.4 mmol/L时双重实时荧光LAMP的扩增曲线图3 双重实时荧光LAMP反应dNTPs浓度的优化Fig.3 Optimization of dNTPs concentration for dual real-time LAMP
2.2 双重实时荧光LAMP的特异性评价
以副溶血弧菌、金黄色葡萄球菌、两者混合DNA为模板进行双重实时荧光LAMP扩增,如图5所示,副溶血弧菌DNA的特征熔解峰温度区间为85~89 ℃,特征熔解峰的Tm值为88.0 ℃左右;金黄色葡萄球菌DNA的特征熔解峰温度区间出现在80~85 ℃,特征熔解峰的Tm值为83.2 ℃左右;两者混合DNA模板在双重实时荧光LAMP中,副溶血弧菌的特征熔解峰温度区间为86~90 ℃,特征熔解峰的Tm值为87~88 ℃左右,金黄色葡萄球菌的特征熔解峰温度区间出现在80~83 ℃,特征熔解峰的Tm值为81.8 ℃左右,与单重实时荧光LAMP相比,特征熔解峰温度区间及Tm值虽然稍有小幅度偏移,但仍能准确分辨副溶血弧菌及金黄色葡萄球菌,且其他非目标菌株均无扩增,说明双重实时荧光LAMP具有良好的特异性。
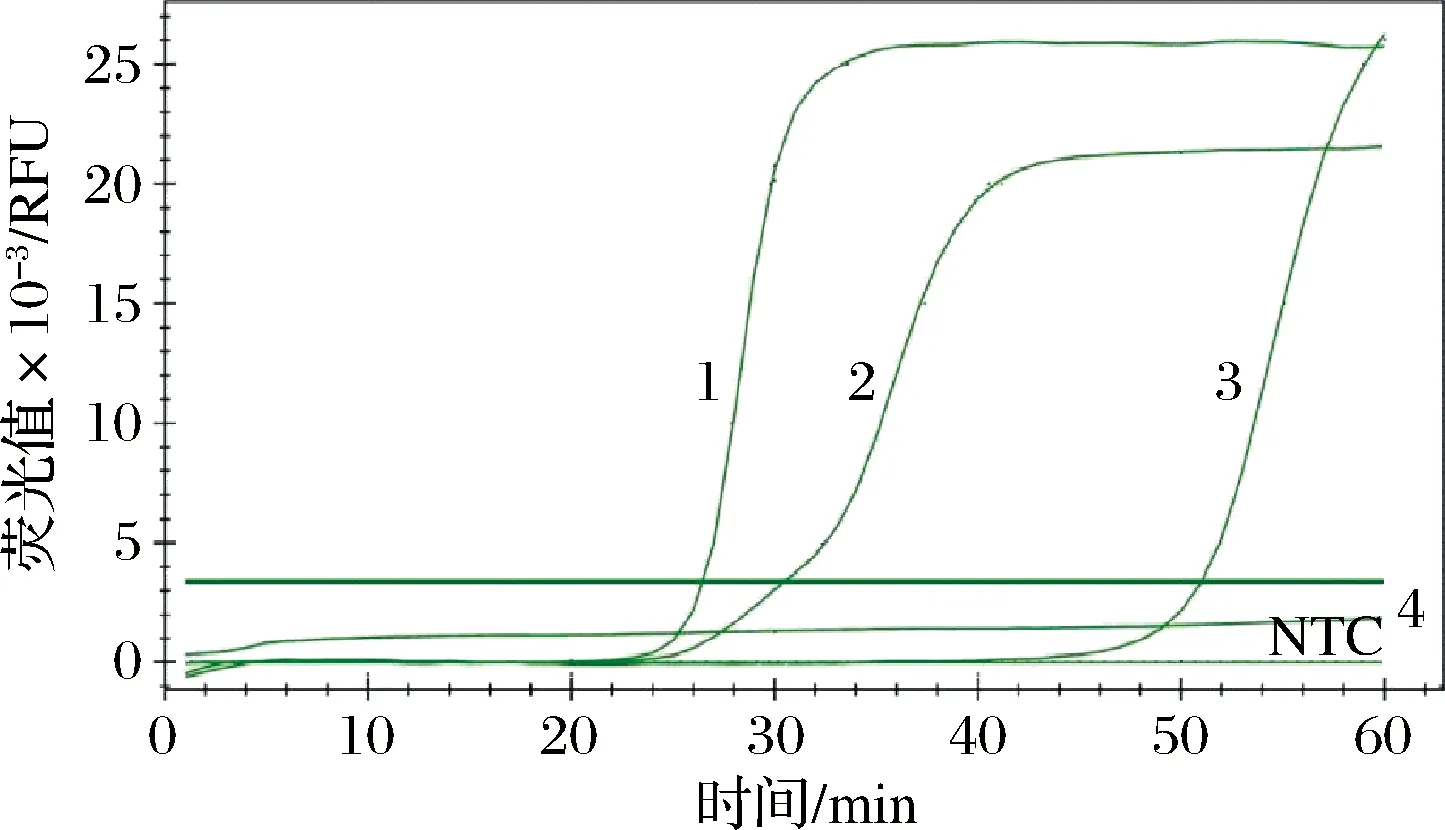
1~4分别为Mg2+浓度为6、8、4、2 mmol/L时双重实时荧光LAMP的扩增曲线图4 双重实时荧光LAMP反应Mg2+浓度的优化Fig.4 Optimization of Mg2+ concentration for dual real-time LAMP

a-副溶血弧菌DNA的熔解曲线;b-金黄色葡萄球菌DNA的熔解曲线;c-2种菌混合DNA的熔解曲线图5 双重实时荧光LAMP反应的特异性Fig.5 The specificity of dual real-time LAMP
2.3 双重实时荧光LAMP的灵敏度分析
图6显示,在双重实时荧光LAMP反应中,有6个浓度的DNA混合模板呈“S”型扩增,而从图6-b中可以看到最低浓度混合DNA模板在80~84 ℃没有特征熔解峰,在86~90 ℃有特征熔解峰,即浓度为1.45×103copies/mL的金黄色葡萄球菌无法检出。因此,双重实时荧光LAMP对副溶血弧菌的检测限为3.62×102copies/mL,对金黄色葡萄球菌的检测限为1.45×104copies/mL。由图6-c可知,在双重PCR方法中,blaCARB-17的灵敏度为3.62×103copies/mL,而nuc的灵敏度为1.45×105copies/mL。相比于双重PCR方法,双重实时荧光LAMP对副溶血弧菌及金黄色葡萄球菌的检测限分别提高了10倍。
2.4 双重实时荧光LAMP方法在人工模拟样品检测中的灵敏度
对10倍梯度稀释的副溶血弧菌(1.2×101~1.2×107CFU/mL)及金黄色葡萄球菌(2.8×101~ 2.8×107CFU/mL)样品提取DNA模板后进行双重实时荧光LAMP反应,结果如图7所示,浓度为103CFU/mL的模板均呈“ S”型曲线扩增,浓度为1.2×102及1.2×101CFU/mL的模板无扩增(图7-a)。浓度为103CFU/mL的模板在80~83 ℃无熔解峰,而86~90 ℃有熔解峰(图7-b)。因此,双重实时荧光LAMP在人工模拟样品中对副溶血弧菌的最低检测限为1.2×103CFU/mL,对金黄色葡萄球菌的最低检测限为2.8×104CFU/mL。

1~7依次对应混合DNA模板浓度,即金黄色葡萄球菌(1.45×102~1.45×108 copies/mL)及副溶血弧菌(3.62×101~3.62×107 copies/mL);M-DNA Marker(100~2 000 bp);N-空白对照;293 bp大小的扩增片段为nuc扩增片段,189 bp大小的扩增片段为blaCARB-17的扩增片段;a-梯度稀释的两菌混合DNA的反应扩增曲线;b-梯度稀释的两菌混合DNA的反应熔解曲线;c-双重PCR产物凝胶电泳图图6 双重实时荧光LAMP及双重PCR的灵敏度Fig.6 The sensitivities of dual real-time LAMP and dual PCR
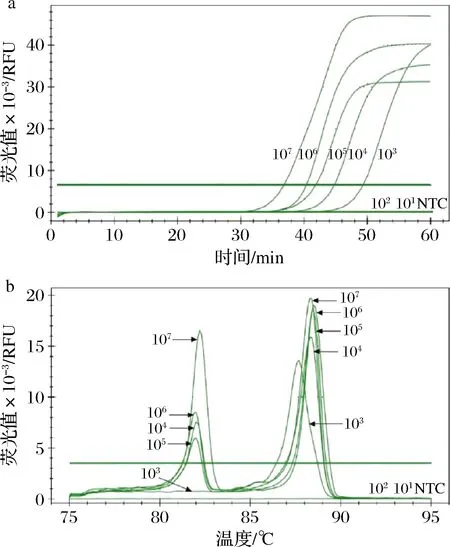
a-扩增曲线;b-熔解曲线图7 双重实时荧光LAMP在人工模拟样品检测中的灵敏度Fig.7 The sensitivity of dual real-time LAMP for the detection of the spiked samples
3 讨论与结论
副溶血弧菌与金黄色葡萄球是2种重要的食源性致病菌,近年来,不少学者分别研究了检测副溶血弧菌和金黄色葡萄球菌的LAMP方法,WANG等[24]建立了以nuc及mecA为靶基因的金黄色葡萄球菌及耐甲氧西林金黄色葡萄球菌的LAMP检测方法,并与PCR方法进行了比较,LAMP方法对nuc及mecA的检测灵敏度分别为1.47、14.7 pg/μL,而PCR方法的灵敏度分别为14.7、147 pg/μL,LAMP方法的检测限均比PCR方法高10倍。ZHONG等[25]建立了一种将叠氮溴化丙锭与实时LAMP相结合的方法,以定量检测副溶血性弧菌,该方法不仅特异性好、灵敏度高,而且可以快速地区分副溶血弧菌的活细胞和死细胞。
为了进一步缩短检测时间,提高检测效率,国内外许多学者开始思考如何在一个反应中检测多个靶基因,目前研究较多的是多重PCR和多重qPCR。例如WARD等[26]建立了副溶血性弧菌特异性基因tlh以及3个毒力基因tdh、trh和orf8的多重PCR方法,以区分致病性和非致病性副溶血性弧菌。PCR形成的是单一大小的扩增产物,但LAMP反应的最终扩增产物是不同大小的茎环DNA组成的混合物,因此如何将LAMP运用到多目的基因检测中一直是亟需解决的一个重大问题。姜侃等[27]探究了三重LAMP检测沙门氏菌、金黄色葡萄球菌及单增李斯特氏菌的可行性,通过以目标菌、非目标菌及混合DNA为模板进行扩增,利用电泳的方法进行结果判定,该方法虽然显示出良好的特异性,但无法判定扩增条带属于何种食源性致病菌,仅适用于某种或几种食源性致病菌的初筛。WANG等[28]针对副溶血弧菌toxR基因和创伤弧菌rpoS基因建立了多重实时荧光定量LAMP,但该方法需要利用限制性核酸内切酶进行酶切,使得操作更加繁琐。
本研究建立了一种能够同时检测金黄色葡萄球菌和副溶血弧菌的双重实时荧光LAMP方法,对影响LAMP反应的主要条件进行了优化,确定了副溶血弧菌和金黄色葡萄球菌最佳引物浓度比为1∶4,Mg2+的最适浓度为6 mmol/L,dNTPs的最佳反应浓度为2.4 mmol/L,最适宜的反应温度为65 ℃。该方法通过熔解曲线特征熔解峰的温度区间及其Tm值来区分副溶血性弧菌和金黄色葡萄球菌,实现了能够在一个反应管中同时检测2种致病菌,既缩短检测时间,也提高了检测效率,结果表明该方法特异性强,对副溶血弧菌及金黄色葡萄球菌的检测限分别为3.62×102、1.45×104copies/mL,灵敏度较好。
我们在研究中发现,引物浓度比和 Mg2+的影响较大,这可能是因为在多重反应体系中加入8条引物,导致一方存在优势扩增现象,通过优化引物浓度比可以明显改善。 Mg2+浓度通过影响BstDNA聚合酶的活性而作用于催化反应,在研究中低浓度的Mg2+导致不扩增,Mg2+浓度过高导致反应效率变低,也会导致体系的不稳定[29]。LAMP方法简单方便,可特异性识别非特异性扩增产物,但由于LAMP反应体系存在多套引物,不可避免地产生引物间互相干扰等问题,而且Tm值差异的区分能力有限,不太适合两重以上的扩增。未来我们可以将这种反应体系与微流控技术、芯片实验室、毛细管实验室等微型实验室技术结合,实现多重LAMP微型化和自动化,使LAMP技术具有更高的可靠性和更好的应用前景。

