基于不同近红外建模软件定量分析新鲜羊肉营养成分
康景,姚海博,梁婷,唐德富,年芳,2*
1(甘肃农业大学 动物科学技术学院,甘肃 兰州,730070)2(甘肃农业大学 理学院,甘肃 兰州,730070)
随着居民生活水平的提高,人们在注重肉制品口感风味的同时,也越来越重视其营养价值及质量安全。羊肉肉质鲜美细腻,营养价值高,是可食用肉品中重要的红肉来源,因具有“低脂、低胆固醇、高蛋白”的特点受到广大消费者的喜爱与青睐[1]。一般而言,羊肉营养价值的高低及品质的优劣取决于其中所含营养物质的多少,如:水分、蛋白质、脂肪、挥发性脂肪酸等,这些物质的含量会影响羊肉的营养价值、感官品质及口感风味[2]。因此,准确检测出羊肉各营养成分的含量是肉品检测行业中一项重要的工作。传统的检测方法如:干燥法(水分)、凯氏定氮法(粗蛋白)、索氏抽提法(粗脂肪)、炭化灼烧法(粗灰分)等,不仅费时耗力,难以实现大量样品的快速检测,并且还会产生大量的实验室废弃物,容易对环境造成污染和破坏。因此,提出一种方便快捷的检测方法将对肉品检测行业及科研工作领域产生重要意义。近红外光谱(near-infrared reflectance spectroscopy, NIRS)检测技术作为21世纪以来日趋成熟的检测技术,具有快速、高效、无损、环保的特点,且在制备样品简单的同时又可评估多种肉制品的特性,因此在肉品检测领域具有十分广阔的应用前景[3]。
NIRS检测技术是近年来发展最为迅速的光谱分析检测技术之一,根据其对不同待测样品中有机含氢基团的倍频及合频的吸收,扫描得到不同的近红外光谱,可即时反映被测样品化学组分及物理特性等信息[4]。目前,NIRS技术已在农业、牧业、食品、化工和制药等各个领域均取得了显著进展[5],在肉类检测行业也有多方面的报道,如掺假检测[6]、品质评价[7]、分级评定[8]、化学成分分析[9]、品种鉴别[10]及产地溯源[11]等,这为肉品检测及加工行业提供了一种快速高效的测定方法和手段。本研究利用NIRS技术,应用WINISI III与Foss Calibrator 2种定标软件对新鲜羊肉中的6种营养成分[水分(moisture,MT)、粗脂肪(ether extract,EE)、粗蛋白(crude pro- tein,CP)、葡萄糖(glucose,Glu)、粗灰分(crude ash,Ash)及总磷(phosphorus,P)]进行定量建模,探究其可行性,以期对羊肉营养价值进行快速、准确地评定。
1 材料与方法
1.1 样品采集与制备
于2019年12月至2020年10月在甘肃省武威市民勤县中天羊业有限公司采集样品共203份,包括湖羊后腿样品98份、滩羊背最长肌55份、澳×湖杂交羊(澳洲美利奴羊×湖羊)后腿样品12份、杜泊羊后腿样品38份。试验羊只饲养于甘肃省武威市民勤县中天羊业股份有限公司养殖场,按国际标准方法进行屠宰。采集的样品真空包装,保存以备近红外光谱仪扫描和化学分析使用。羊肉样品进行近红外光谱采集前,需将样品进行预处理。具体处理方法如下:剔除肉块表面的筋膜和脂肪后放入绞肉机绞碎成肉糜,再将磨碎后的肉糜放入样品杯,压实待测。
1.2 仪器与设备
AL104型分析天平,上海梅特勒-托利多仪器有限公司;DHG-9070A型电热恒温鼓风干燥箱,上海齐欣科学仪器有限公司;KT8400型全自动凯氏定氮仪,福斯华(北京)科贸有限公司;TM-3012P型陶瓷纤维马弗炉,北京盈安美诚科学仪器有限公司;XT151型自动脂肪分析仪,美国ANKOM公司。
1.3 实验方法
1.3.1 羊肉营养成分测定
MT含量按GB 5009.3—2016《食品安全国家标准 食品中水分的测定》标准中的干燥法进行测定;EE含量按GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》标准中的抽提法进行测定;CP含量按GB 5009.5—2016《食品安全国家标准食品中蛋白质的测定》标准中的凯氏定氮法进行测定;Glu含量按葡萄糖氧化酶法使用Glu试剂盒(南京建成生物研究所,A154-1-1)测定;Ash含量按GB 5009.4—2016《食品安全国家标准 食品中灰分的测定》标准中的灼烧法进行测定;P含量按GB 5009.87—2016《食品安全国家标准 食品中磷的测定》标准中的钒钼黄-分光光度法进行测定。
1.3.2 羊肉近红外分析
1.3.2.1 羊肉NIRS图的采集
使用FoodScan TM2近红外分析仪(FOSS,丹麦)扫描样品进行光谱采集,收集光谱范围为400~1 100 nm,数据间隔为0.5 nm,测样方式为透射,仪器类型为光栅扫描型,仪器工作时环境温度要求为20~25 ℃左右。将经过预处理后的样本肉糜装入样品杯中,每个样品均需重复装样3次,并扫描3次。图1为203份羊肉样品的原始光谱图,取自每份样品扫描3次之后的平均光谱。由图1可看出每份样品的光谱信息趋势基本一致,但略有不同。图2与图3分别为原始光谱经过一阶导数处理与二阶导数处理后的光谱图,由图2和图3可看出原始光谱经过导数处理(一阶导数、二阶导数)之后特征谱峰均增多,这是由于导数处理具有消除光谱中冗余的背景信息以及提高分辨率的作用[12]。
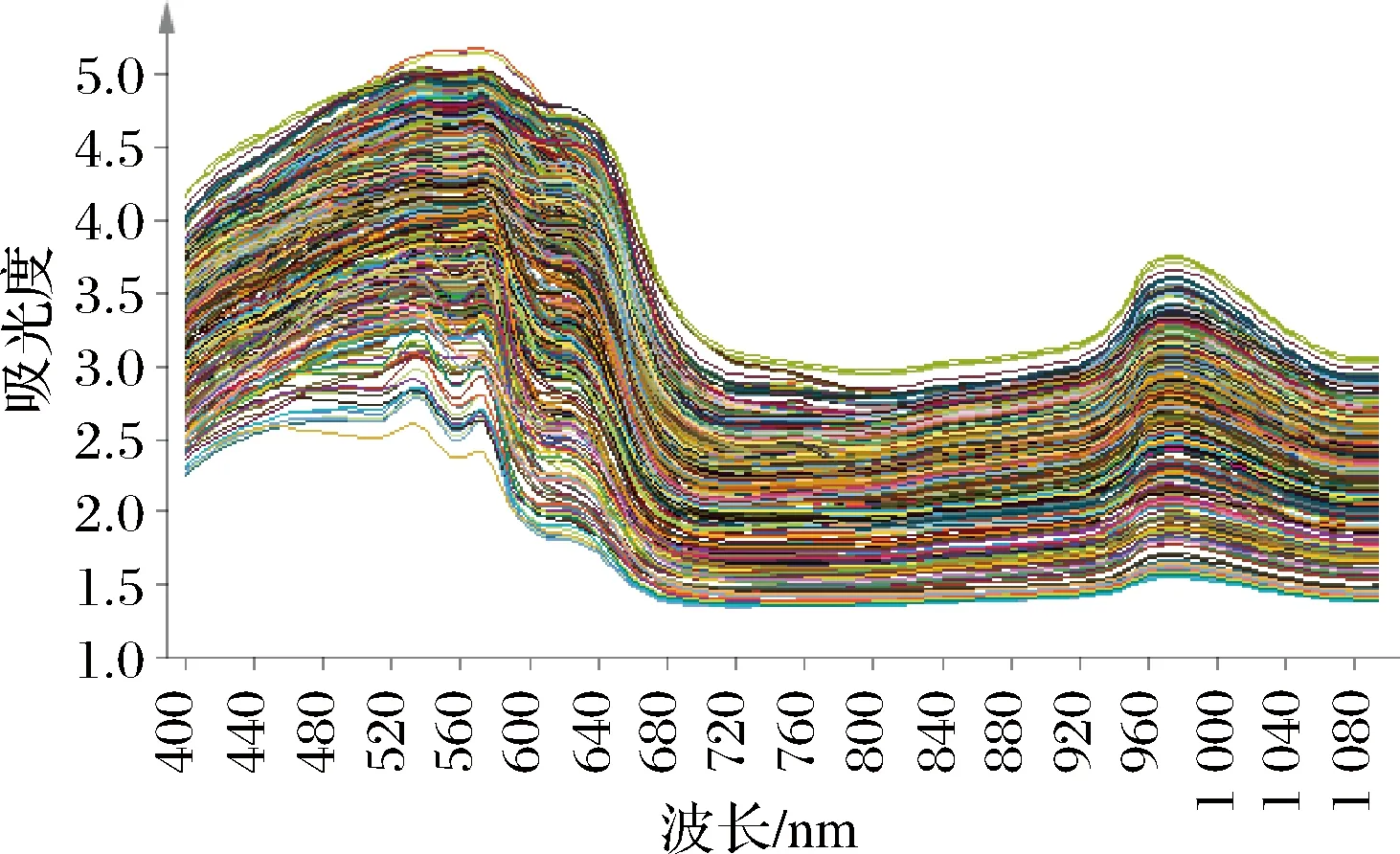
图1 203份羊肉样品原始光谱图Fig.1 The original near infrared spectrum of 203 mutton samples
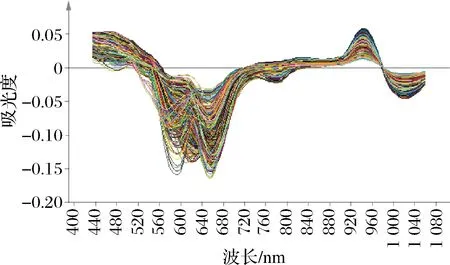
图2 203份羊肉样品一阶导数处理光谱图Fig.2 First derivative of near infrared spectrum of 203 mutton samples
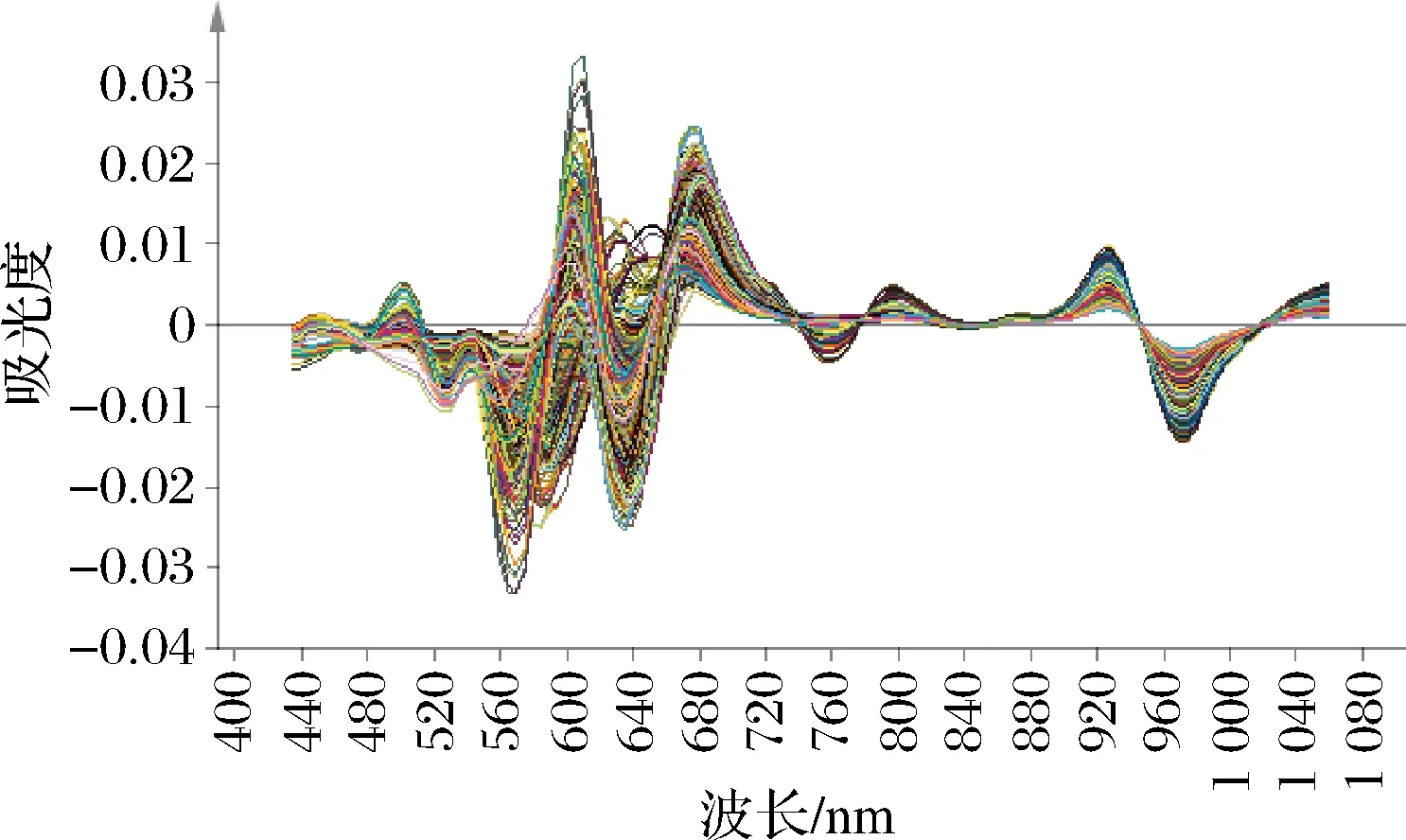
图3 203份羊肉样品二阶导数处理光谱图Fig.3 Second derivative of near infrared spectrum of 203 mutton samples
1.3.2.2 两种定标软件建模参数及建模过程的异同
采用WINISI III软件建立定标模型时,以改良偏最小二乘法(modified partial least squared,MPLS)为回归方法,将NIRS结合化学实测值建立定标模型,而利用Foss Calibrator软件建立定标模型时,是以偏最小二乘法(partial least squared,PLS)为回归方法,将NIRS结合化学实测值建立定标模型。实际上,PLS与MPLS都是采用主成分分析定标建模的回归技术,MPLS是在PLS的基础上进行改进和扩展的一种算法,相比于PLS,MPLS在每次循环运算后会对数据进行归一化处理,并且会对残余变量进行残余变量标准化处理,可达到二次优化的效果。2个建模软件划分样品时均按4∶1划分为定标集(N≈160)与验证集(N≈40)。WINISI III定标软件剔除异常值时由全局距离(global distance, GH≥3)和“T”值(T>2.5)自动剔除,而Foss Calibrator定标软件需要在软件判别出异常值后再手动进行剔除。为消除与光谱信息无关的干扰因素(如:噪声、环境温度与湿度、杂散光等)导致光谱基线发生漂移,WINISI III软件建模时采用0阶微分(导数0,间隔0,平滑1,平滑1)、1阶微分(导数1,间隔4,平滑4,平滑1)、2阶微分(导数2,间隔4,平滑4,平滑1)共3种导数处理方式与7种散射校正方法(None、SNV and Detrend、SND only、Detrend only、Standard MSC、Weighted MSC、Inverse MSC)相结合,共计21种方式对原始光谱进行处理。Foss Calibrator软件建立的校正模型仅采用SNV only方法处理原始光谱。使用WINISI III软件建立的定标模型,其定标结果根据定标标准误差(standard error of calibration,SEC)、交互验证标准误差(standard error of cross validation,SECV)、交互验证决定系数(1 minus the variance ration,1-VR)选择出最优的处理组合,当定标集的SEC与SECV越小、1-VR越接近于1时,证明模型越可靠。Foss Calibrator软件建立的定标模型,其结果由定标分析误差[root mean square error of calibration,RMSEP(cal)]、交互验证分析误差[root mean square error of cross-verification,RMSEP(cross)]决定,RMSEP(cal)与RMSEP(cross)越小,证明模型效果越好。定标模型建立后,还需选择部分独立样本作为验证集(N≈40)进一步验证模型的优劣。使用WINISI III软件建模的外部验证结果需要根据预测决定系数(coefficient of determination for validation,RSQ)与外部验证相对分析误差(ratio of performance to deviation for validation,RPD)进一步验证模型的稳健性,只有经过验证的模型才能准确对未知样品进行评估。当RSQ越接近于1,RPD(ratio of stand- ard deviation of the validation set to standard error of prediction,RPD=SDv/SEP)越大时,证明该模型的可靠性越好。当0.26≤RSQ≤0.49,表明所建立的预测模型效果差,不可在实际生产中应用;当0.50≤RSQ≤0.64,表明所建立的模型预测效果一般,不能准确预测样本的化学组分及物理性质,但可用于大量样本的粗略筛选;当0.66≤RSQ≤0.81,表明所建立的模型具有良好的预测能力,可在实际生产中应用;当0.83≤RSQ≤0.90,表明所建立的模型预测能力很好,可在某些领域中达到精确预测的效果[13]。Foss Calibrator软件的验证结果需要根据验证分析误差[root mean square error of validation,RMSEP(val)]、决定系数R2、RPD进一步验证模型的稳健性,当RMAEP越小;R2越接近于1、RPD越大时、证明模型的效果越好。
2 结果与分析
2.1 羊肉各营养成分实验室分析
表1为采用WINISI III软件定标的各营养成分化学实测值。由表1可知,羊肉定标集MT、EE、CP、Glu、Ash、P的含量范围分别为68.78%~76.67%、2.11%~7.81%、21.52%~26.03%、0.15%~2.97%、1.44%~3.13%、0.93%~1.37%,平均含量分别为:72.63%、3.54%、23.55%、0.96%、1.88%、1.12%。验证集MT、EE、CP、Glu、Ash、P的含量范围分别为67.25%~75.97%、1.92%~7.43%、20.92%~25.95%、0.17%~2.72%、1.49%~2.47%、0.90%~1.32%,平均含量分别为72.69%、3.60%、23.59%、0.96%、1.86%、1.12%。
表2为采用Foss Calibrator软件定标的各营养成分化学实测值。由表2可知,MT、EE、CP、Glu、Ash、P的含量范围分别为67.25%~76.61%、1.92%~7.81%、20.92%~26.03%、0.17%~2.49%、1.10%~2.20%、0.90%~1.37%,平均含量分别为:72.63%、3.60%、23.54%、0.93%、1.35%、1.12%。
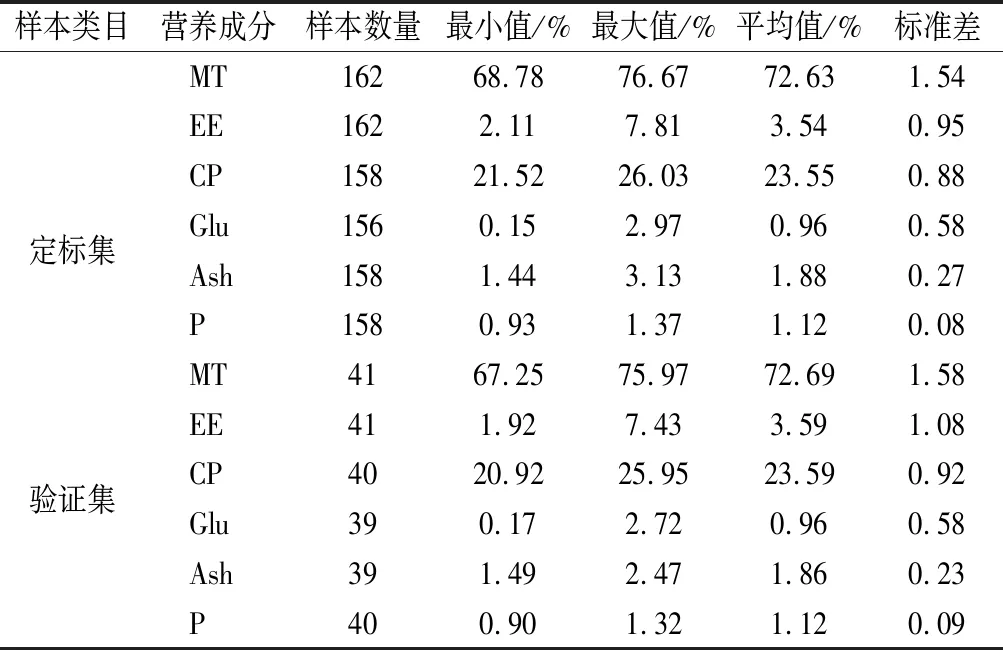
表1 羊肉样品定标集和验证集各营养成分含量(WINISI III)Table 1 Nutritional component contents of calibration and validation set of mutton samples(WINISI III)
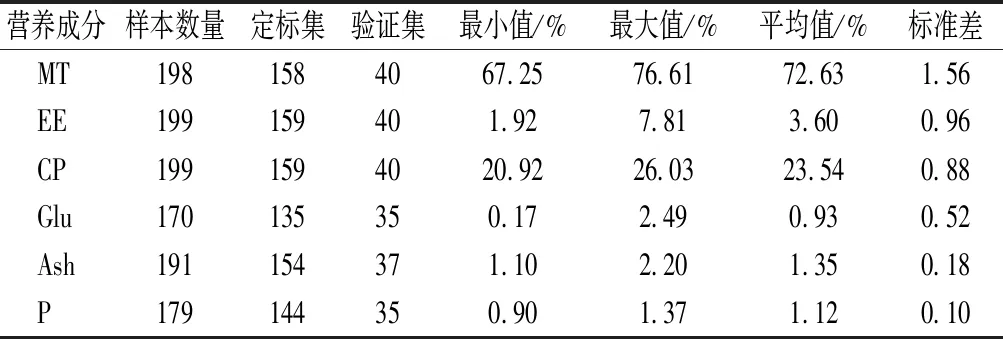
表2 羊肉样品定标集和验证集各营养成分含量(Foss Calibrator)Table 2 Nutritional component contents of calibration and validation set of mutton samples(Foss Calibrator)
2.2 羊肉各营养成分定标模型的建立及评价
使用WINISI III与Foss Calibrator定标软件分别建立羊肉6种营养成分的NIRS模型,并对模型的可靠性进行比较。
WINISI III软件定标及验证结果如表3所示。由表3可知,WINISI III软件以MPLS为回归方法,对羊肉6种营养成分以3种导数结合7种去散射方法,共计21种方式分别对光谱进行处理。舍弃400~800 nm 可见光区后,最终选择在波段780~1 100 nm处定标(近红外短波区)。以最小的SECV与最大的1-VR为筛选标准,选择出最优的处理组合。由表3可知,MT、EE、CP、Glu、Ash、P的最优组合分别为None与2,4,4,1、Standard MSC与2,4,4,1、SNV only与1,4,4,1、Standard MSC与1,4,4,1、Standard MSC与0,0,1,1、SNV and Detrend与2,4,4,1。各营养成分所对应的SECV和1-VR值分别如下:MT为0.54与0.86、EE为0.29与0.91、CP为0.30与0.82、Glu为0.17与0.57、Ash为0.10与0.58、P为0.04与0.44。校正模型建立后,选择独立的样品作为验证集(N≈40)对各营养成分的模型进行验证。MT、EE、CP、Glu、Ash、P这6种营养成分的最优模型外部验证RSQ和RPD分别为0.83与2.47、0.90与3.60、0.81与2.79、0.54与3.05、0.54与1.91、0.45与1.80。
Foss Calibrator软件定标及验证结果如表4所示。由表4可知,Foss Calibrator软件以PLS为回归方法,采用标准正常化方法SNV only对光谱进行预处理,舍弃400~800 nm可见光区后,最终选择在波段800~1 099.5 nm处定标(近红外短波区)。各营养成分所对应的RMSEP(cal)和RMSEP(cross)分别为0.537与0.631、0.301与0.326、0.353与0.468、0.16 0与0.127、0.159与0.179、0.087与0.086。校正模型建立后,选择独立的样品作为验证集(N≈40)对各营养成分的模型进行验证。MT、EE、CP、Glu、Ash、P这6种营养成分的RMSEP(val)和R2分别为0.628与0.84、0.310与0.87、0.352与0.83、0.177与0.53、0.154与0.51、0.091与0.33。
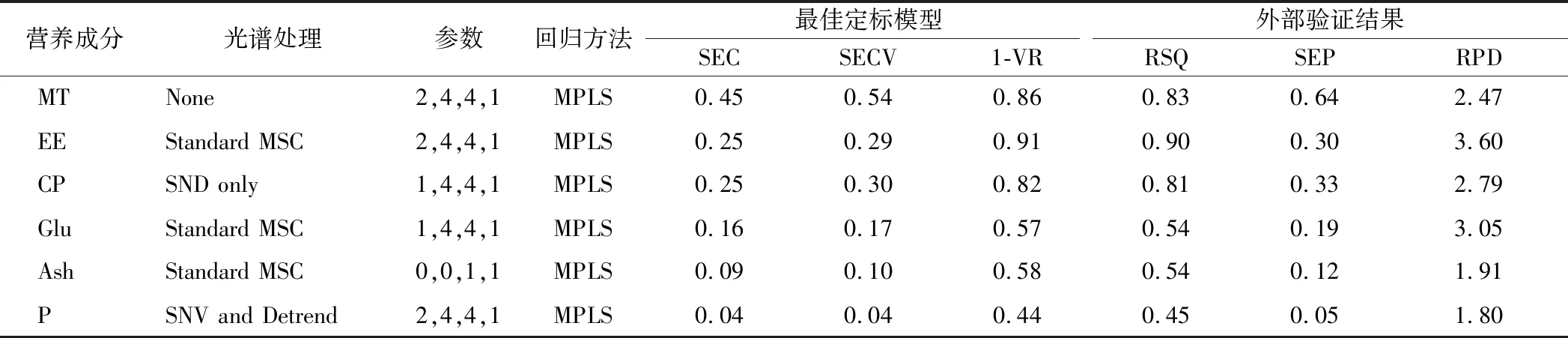
表3 羊肉样品各个营养成分的定标模型及外部验证结果(WINISI III)Table 3 NIRS calibration models and external validation results for nutrition components of mutton samples(WINISI III)

表4 羊肉样品各个营养成分的定标模型及验证结果(Foss Calibrator)Table 4 NIR calibration models and external validation results for nutrition components of mutton samples(Foss Calibrator)
2.3 羊肉各营养成分的化学实测值与预测值的相关性
采用WINISI III软件定标的羊肉各营养成分化学测定值和预测值之间的相关性如图4所示。由图4可知,MT、EE、CP化学分析值和预测值的相关性较好,RSQ分别为0.83、0.90、0.81;Glu和Ash化学测定值和预测值的相关性一般,RSQ均为0.54;P化学测定值和预测值的相关性较差,RSQ为0.45。
采用Foss Calibrator软件定标的羊肉各营养成分化学测定值和预测值之间的相关性如图5所示。由图5可知,MT、EE、CP化学测定值和预测值的相关性较好,R2分别为0.84、0.87、0.83;Glu和Ash化学测定值和预测值的相关性一般,R2分别为0.53、0.51;P化学测定值和预测值的相关性较差,R2仅为0.33。
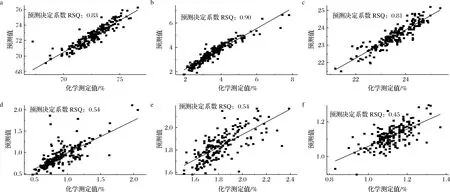
a-MT;b-EE;c-CP;d-Glu;e-Ash;f-P图4 MT、EE、CP、Glu、Ash、P含量预测值与实测值的相关性(WINISI III)Fig.4 Correlation between predicted value and actual value of MT, EE, CP, Glu, Ash, P contents(WINISI III)
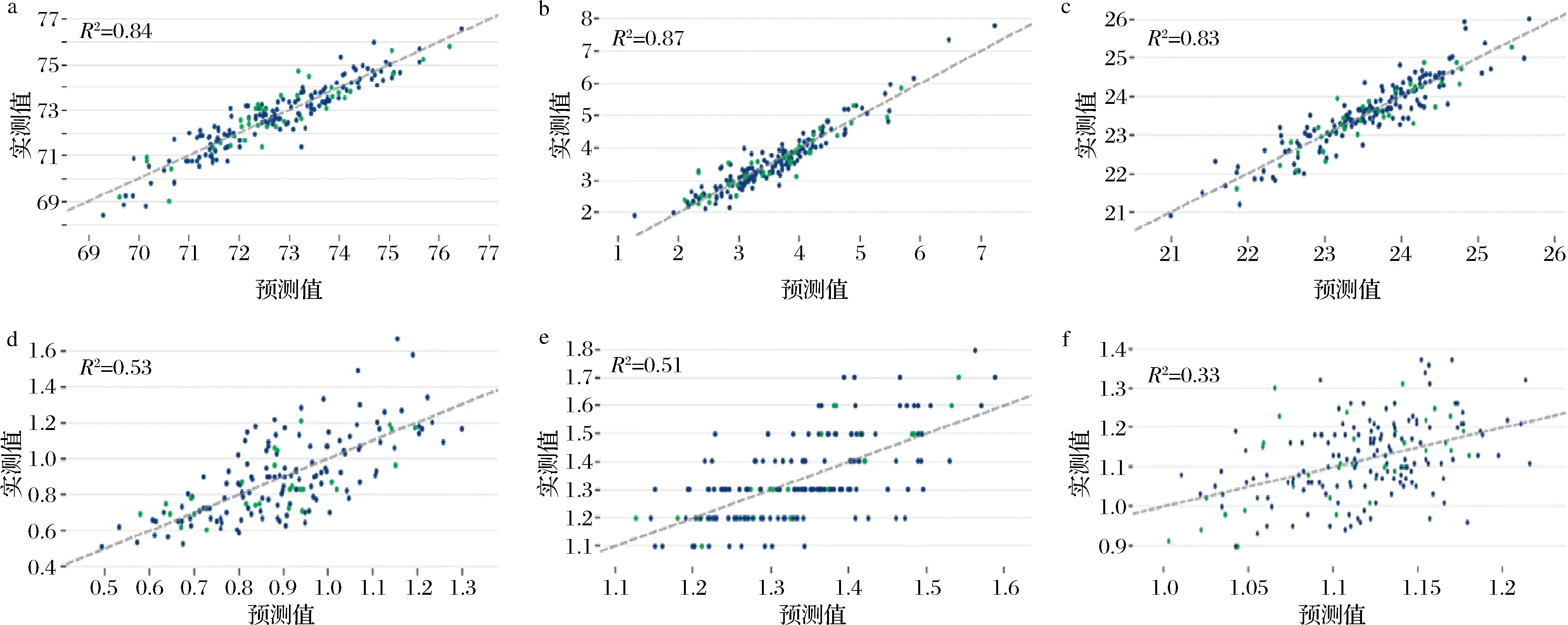
a-MT;b-EE;c-CP;d-Glu;e-Ash;f-P图5 MT、EE、CP、Glu、Ash、P含量预测值与实测值的相关性(Foss Calibrator)Fig.5 Correlation between predicted value and actual value of MT, EE, CP, Glu, Ash, P contents(Foss Calibrator)
3 讨论
近20年来,国内外大量学者利用近红外光谱技术准确、快速地预测了各类动物肉中的营养成分。如:GIARETTA等[14]利用NIRS技术对新鲜羊肉与冷冻干燥羊肉的化学成分(MT、Fat、CP、Ash)进行了分析,结果表明,除Ash预测模型精度较低外(R2=0.60),其余各模型精度均较高(R2:0.89~0.97),可在实际检测过程中应用。 TEIXEIRA 等[15]利用NIR技术成功建立了山羊背最长肌中MT、Fat、CP、Ash的预测模型(R2≥0.83)。这些研究所建立的定标模型可以快速准确地预测羊肉营养成分,这对于快速高效评估羊肉品质具有重要意义。
本试验所建立的羊肉6种营养成分的定标模型中EE的模型最佳,这与PULLANAGARI等[16]对羊肉中的研究结果一致。不同研究者对MT建立的NIRS模型的准确度存在较大差异,本研究建立的MT预测模型较好,与KAMRUZZAMAN等[17]在羊肉中的研究结果一致。但BRØNDUM等[18]在猪肉中的研究结果较差,这是由于鲜肉中的水分含量易随环境和时间的改变而发生较大变化,MT的建模结果较差可能与扫描肉样和测定水分是否即时、实验室测定的准确程度等有很大关系。CP的预测效果也较好,仅次于MT,这与赵文英等[19]在猪、牛、羊肉中的研究结论均一致,但也有研究学者对CP建立的NIRS预测模型结果显示较差,如RIPOLL等[20]对均质羊肉CP的预测校正决定系数只达到0.11。分析原因,可能与化学实测的准确度及建模方法有关,RIPOLL等采用的是主成分回归法进行建模,这与本研究及其他学者采用的MPLS及PLS建模方式存在较大差异。Glu与Ash的模型效果一般,不能替代常规化学检测方法,但可用于大量样品的粗略筛选和分析。这与GIARETTA等[14]与PRIETO等[21]对牛肉中研究结果一致,这是由于Ash作为肉品经高温灼烧后残留的无机盐和氧化物,近红外光不能与其相互作用,虽可通过检测与无机物相结合的有机物或螯合物的成分,使扫描到的NIRS图有所变化,进而获得灰分或无机物的含量[22-23],但在使用传统方法炭化灼烧时会有部分无氮浸出物损失溢出,这使得光谱信息并不能与化学实测含量准确匹配,因此,这种间接建立的模型预测效果一般。P的NIRS定标模型的结果较差,不能在实际生产中应用,这是由于P属于矿物质元素,不含氢基团,其在NIRS区内无吸收,与NIRS反映的有机物结构结合较差[24],无法建立较为准确的近红外预测模型。
4 结论
本研究利用NIRS技术建立了新鲜羊肉6种营养成分(MT、EE、CP、Glu、Ash、P)的预测模型,使用WI- NISI III(MPLS)与Foss Calibrator(PLS)2个定标软件对其分别定标,2个定标结果均显示:MT、EE、CP的预测模型效果很好,可应用于实际生产中精确预测;Glu、Ash的预测模型效果一般,不能完全替代常规分析,但可用于大量样品的粗略筛选和分析,模型还需进一步优化;P的预测模型效果较差,不能在实际生产中应用。
通过比较WINISI III与Foss Calibrator定标软件在建立NIRS模型中的过程及结果可知,2种建模软件各有优缺点,WINISI III软件关于定标及验证的评价指标更加全面完善,但操作相对繁琐;而Foss Calibrator软件关于定标及验证的评价指标较少,但操作简单易学。如上所述,更加建议采用WINISI III软件及MPLS回归方法建立NIRS定量模型。

