中高温大曲在制曲过程中微生物区系演替特征及功能研究
刘慧,涂璇,3*,吕育财,3,任立伟,3,周超,周翰林,陈萍,谭光讯,杨博,龚大春,3
1(湖北省生物酵素工程技术研究中心(三峡大学),湖北 宜昌,443002)2(三峡大学 生物与制药学院,湖北 宜昌,443002) 3(中国轻工业功能酵母重点实验室(三峡大学),湖北 宜昌,443002)4(湖北稻花香酒业股份有限公司,湖北 宜昌,443112)
酒曲作为白酒酿造过程中的糖化发酵剂,是白酒发酵的源动力。白酒酒曲种类丰富多样,根据制曲工艺的不同[1],酒曲可分为大曲、小曲、麸曲、麦曲及红曲五大类,其中大曲应用最为广泛。浓香型白酒酿造主要采用中高温大曲,依靠自然界带入的各种野生菌在曲坯上富集生长,以获得各种有益于发酵的微生物,起着糖化、产酒精以及产风味物质的作用,是影响白酒产量、品质、香型与风格的重要因素[2]。
白酒发酵是一个极其复杂的生物学过程,涉及到不同微生物的生长代谢以及种群数量的动态变化,其演替过程一直是限制对白酒酿造进行科学控制的关键瓶颈之一。应用于大曲微生物研究的技术主要有传统平板分离[3]、BIOLOG微平板分析[4]和聚合酶链反应-变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient gel electrophoresis,PCR-DGGE)[5]等,但传统的平板分离技术只能对大曲中的可培养菌种进行研究。BIOLOG 技术依赖于群体的生理活性,对于生长较慢的微生物不适用。PCR-DGGE 技术只能分离低于500 bp 的较小片段,准确率低。以上技术的应用存在一定的局限性,不能全面地描述酒曲微生物群落多样性[6]。高通量测序技术成本低、稳定性高、可读量和质量高,是目前评估微生物多样性的有力工具[7],在菌群分析中,该技术能快速、准确的解析微生物菌群结构。YANG等[8]采用高通量测序技术分析大曲发酵过程中的优势微生物,获得优势真菌16种,优势细菌18种,为进一步研究大曲制备过程中功能微生物奠定了基础。陈申习等[9]和沈毅等[10]分别利用Illu- mina Miseq和Illumina HiSeq高通量测序技术分析出高温大曲中Rhizopus、Aspergillus、Candida、Ther-moascus、Pantoea、Thermoactinomyces、Kroppenstedtia和Lactococcus作为主要优势菌属。
制曲过程中大曲微生物区系的组成及变化不仅决定曲块中物质和能量代谢的走向,也决定了该香型白酒风格的形成。为全面了解浓香型白酒中高温大曲在培菌发酵期、后熟贮藏期间微生物群落的演替规律及其微生物组成与大曲各项理化、生化特征之间的相关性,本研究拟用Illumina Novaseq二代测序技术对大曲进行全面、系统的研究,揭示在制曲过程中起关键作用的微生物类群,为中高温大曲制作过程中大曲功能微生物结构组成以及科学制曲提供重要依据。
1 材料和方法
1.1 样品采集
本实验所取大曲样品来自某白酒公司制曲车间。样品包括制曲过程中所需的原料小麦、曲房稻草、曲房谷壳以及浓香型大曲培菌发酵期1、7、13、28 d、后熟贮藏期59、346、399 d在内的11个样品。采取三点取样法,将同一时间的样品混合均匀,每个样品分为2份,-80 ℃保存用于高通量测序,-20 ℃保存用于理化和生化特征测定。本实验所使用的大曲样品及样品信息见表1。
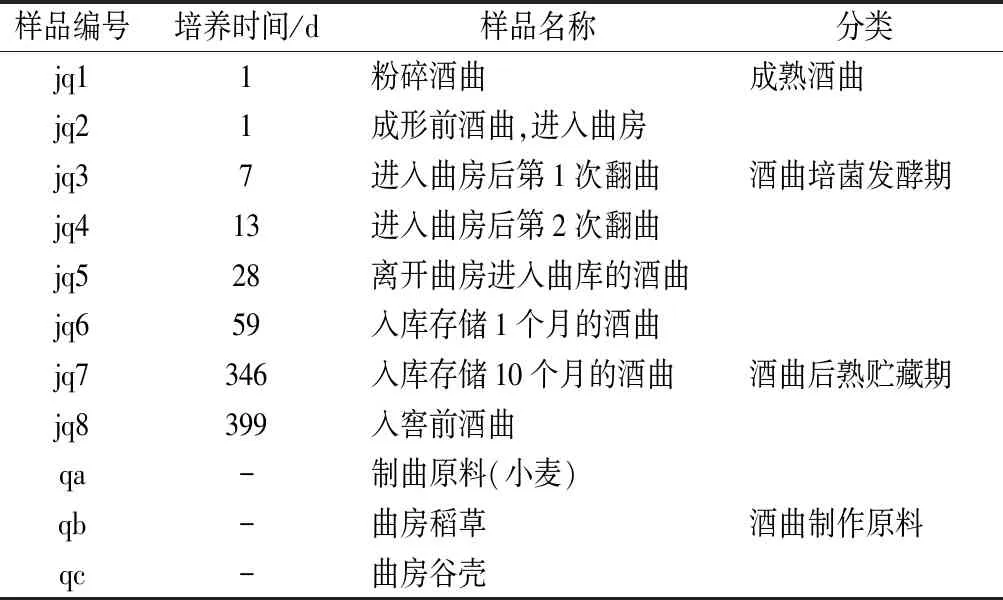
表1 实验所使用大曲样品信息表Table 1 Basic information of Daqu samples used in the experiment
1.2 大曲样品理化及生化特征测定
测定大曲样品在制作过程中不同时间段的理化、生化特征。理化特征测定包括温度、含水量、pH值、还原糖含量、淀粉含量;生化特征测定包括糖化力、液化力、酯化力、发酵力、蛋白酶活力。温度测定参照温度计法,含水量测定参照烘干法[11],pH值测定参照酸度计法[12];还原糖含量测定参照二硝基水杨酸(dinitrosalicylic acid,DNS)法[13];淀粉含量、糖化力、液化力、酯化力、发酵力测定参照QB/T 4257—2011《酿酒大曲通用分析方法》[14]。蛋白酶活力测定参照SB/T 10317—1999 《福林酚法》[15]。
1.3 大曲微生物菌群分析
基于Illumina Nova平台的测序由天津诺禾致源科技有限公司完成。真菌采用ITS-rDNA上的ITS2可变区进行扩增、细菌采用16S rRNA上的V3~V4区进行扩增,构建小片段文库,进行双末端测序(Paired-end)。
采用FLASH软件[16]对测序原始数据进行拼接,将低质量的序列利用QIIME软件[17]进行过滤,去除嵌合体,得到最终有效序列。利用Uparse软件[18]对样本进行聚类,97%一致性(Identity)将序列聚类成为操作分类单元(operational taxonomic units,OTUs),将OTUs中出现频数最高的序列选取为代表性序列。利用Mothur方法与SILVA138的SSUrRNA数据库[19]对OTU进行分类学注释。利用QIIME软件[17]对样品进行多样性分析。使用R软件进行稀释曲线绘制、主坐标分析(principal coordinate analysis,PCoA)、样本聚类分析、相关性分析等。
原始数据已上传至NCBI数据库(SRA PRJ- NA790492、PRJNA790489)。
2 结果与分析
2.1 大曲样品理化及生化特征分析
大曲的理化和生化特征是评价酒曲品质的重要指标,大曲在制备过程中,从原料到成曲,其理化特征和生化特征都发生显著变化,这些特征是决定白酒酿造启动的关键因素。大曲制作过程中理化特征和生化特征测定结果如表2所示。大曲发酵的理化、生化特征随培养时间和培养环境的变化而变化。温度是影响大曲微生物数量和种类的重要因素。在大曲制作过程中,曲房的温度和曲块温度均呈现先上升后下降趋势。从第1天开始曲块进入曲房进行堆积,通过铺稻草及关门窗等保温措施,保证微生物生长,随后其生理代谢活动开始频繁,大曲品温迅速增加。在大曲入房7 d时,大曲温度可达到60 ℃,即最高品温。为了避免烧曲,会对曲房进行通风和翻曲处理,7~28 d 期间曲房的温度和大曲品温逐渐下降。在该过程中,大曲水分随微生物发酵的进行而逐渐降低。pH先增高后降低,其主要是微生物通过生长代谢产生有机酸,发酵13 d时pH达到最高值6.69,发酵13 d后,pH下降到6.1左右。还原糖含量在发酵期间逐渐增大,淀粉含量逐渐减少,28 d时还原糖含量由第1天的49.99 mg/g上升至120.64 mg/g,淀粉含量由最初的614 mg/g降至332 mg/g,主要原因是微生物生长代谢将大量淀粉分解成为寡糖或还原糖等。28 d后大曲从曲房移入通风、干燥的曲库,进入后熟贮藏期,曲块温度继续下降逐渐接近室温,pH、含水量、淀粉含量、还原糖含量均逐渐下降达到相对稳定。
大曲的品温和水分为其发酵过程中微生物的生长繁殖与生理代谢提供了条件。大曲在发酵期间,丝状真菌、酵母菌和细菌等微生物大量生长繁殖。其中丝状真菌会产生多种酶系,如液化型淀粉酶和糖化酶,可将原料中的淀粉分解成寡糖和还原糖,致使大曲液化力和糖化力在28 d时分别增至0.27 U和582.00 U。酵母菌和细菌在可利用的还原糖进行生长的同时启动酒精发酵、酯化反应,致使发酵力于7 d时达较高水平,即1.60 U,酯化力于13 d达较高水平,即465.54 U。此外丝状真菌可产生蛋白酶分解蛋白质。在后熟期间(28~399 d),曲中营养物质在培菌期已大量消耗,此时霉菌、酵母菌和细菌数量大大降低,产酶量减少,各类酶活力迅速减弱直至稳定。

表2 中高温大曲制备过程中大曲理化、生化特征的测定Table 2 Physicochemical and biochemical properties of medium-high-temperature Daqu during the starter-making process
2.2 大曲微生物结构组成与动态演化分析
2.2.1 高通量测序结果及Alpha多样性分析
Alpha-diversity用于分析样品的微生物群落多样性[17]。利用Illumina Nova测序平台对ITS2和16S rRNA基因进行测序,分别得到大曲制备过程中不同时间的样品有效序列数、OTUs及Alpha多样性分析指数。如表3所示,这两项技术均表明获得了较为理想的序列总数,11个大曲样品共得到1 715个OTUs。样品覆盖率均>98%,表明该试验取样合理,测序结果能真实反映样本的实际情况。从多样性指数分析发现jq2微生物多样性和丰富度都较低,随着发酵的进行,环境中的微生物进入到曲块中,曲块的微生物多样性和丰富度逐渐增加,jq3微生物多样性和丰富度达到第1个高峰,jq5达到第2个高峰,之后由于底物的消耗以及外界环境的阻遏,多样性指数开始降低,最终趋于稳定。由此,可将jq2~jq3记为发酵前期,jq3~jq5记为发酵后期,jq5~jq8记为后熟期。
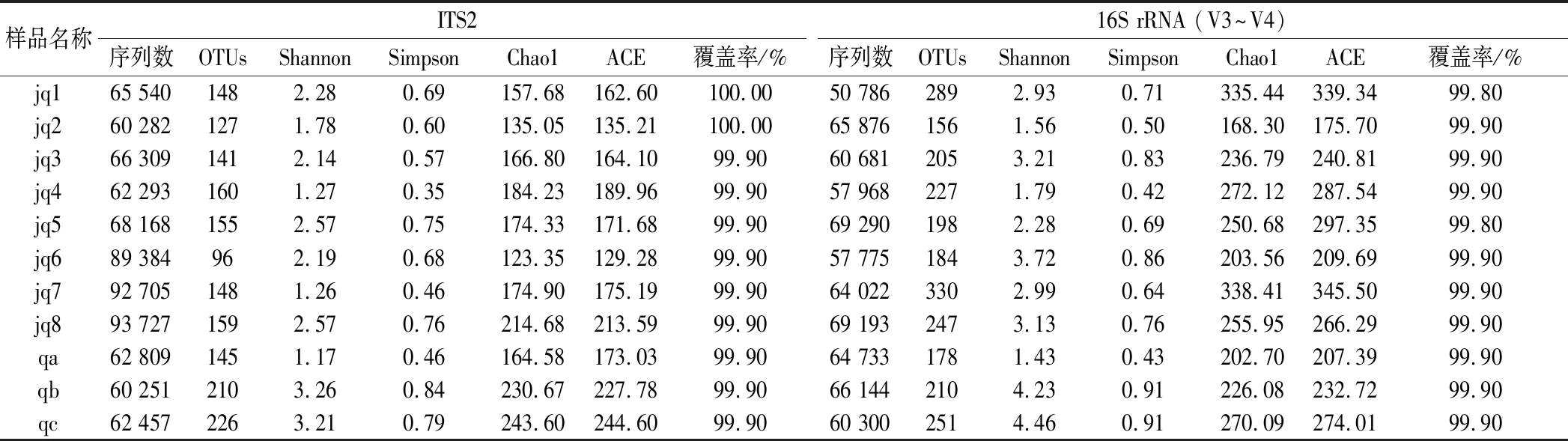
表3 中高温大曲制备过程中大曲中真菌和细菌的序列数量、操作分类单元和Alpha多样性指数分析Table 3 Sequence number, OTUs, and Alpha-diversity indices of fungi and bacteria in medium-high-temperature Daqu during the starter-making process
2.2.2 Beta多样性分析
Beta多样性用以分析不同样本间微生物群落组成的差异,结果如图1所示。可看出第一个主坐标轴(PCoA 1)在真菌和细菌群落差异的贡献值分别为67.07%和66.91%。由图1-a、图1-b可发现大曲jq2与qa相关性较强,在发酵过程中,随着大曲发酵时间的进行,样本在PCoA1上逐渐移动,真菌中与qb、qc距离较近,相关性较高,细菌中与qa相关性较强,后期大曲微生物均聚集在一起,结构趋于稳定。说明qa中的菌群对大曲初期微生物影响较大,而qb、qc菌群对发酵过程中大曲微生物影响较大。此外,可将样品分成两个聚类,其中jq2与qa为1个聚类,jq1、jq3~jq8与qb、qc为1个聚类(图1-c),推测qb、qc即稻草、谷壳对大曲微生物菌群有重要影响。

a-大曲真菌PCoA图;b-大曲细菌PCoA图;c-大曲微生物聚类树图1 中高温大曲菌群中真菌和细菌主坐标分析和聚类分析Fig.1 PCoA and cluster analysis of fungal and bacterial communities in medium-high-temperature Daqu
2.3 大曲制作过程中不同时间段微生物群落结构分析
对上述的OTUs序列进行物种注释,可展示物种组成及丰度信息(图2)。真菌和细菌分别注释到门水平的比例为81.04%、70.82%。将丰度<1%的合并为一类(others),大曲真菌群落获得8个门类、255个属。主要包括Ascomycota下的Issatchenkia(28.12%)、Thermoascus(16.16%)、Trichocladium(14.14%)、Aspergillus(6.44%),以及Mucoromycota下的Rhizopus(7.15%)、Rhizomucor(5.43%)。大曲细菌群落共分析得到10个门类、262个属。其中相对丰度较高的是Firmicutes下的Weissella(39.60%)、Lactobacillus(17.43%)、Bacillus(2.14%)。在大曲制作过程中,微生物种类不断增加,在粉碎小麦压成曲块时(jq2),曲中的Blumeria丰度较高,与qa(小麦)菌群结构相似,此时环境中的微生物还未进入曲块进行生长繁殖。大曲移入曲房进入培菌期间,由于曲房温度较为适宜,大曲微生物种类急剧增加,此时Issatchenkia、Thermoascus、Rhizopus、Rhizomucor、Weissella和Lacto-bacillus丰度升高。培菌期结束大曲移入曲库进入贮藏期,Aspergillus、Rhizopus、Thermoascus等丰度逐渐降低,Bacillus、Saccharopolyspora和Streptomyces丰度增大。贮藏期相对培菌期而言,微生物种类较少,这是由于曲库环境温度和湿度均明显降低,曲块营养物质被大量消耗且含水量较低,导致大量微生物死亡,最终使得大曲微生物菌群趋于相对稳定。
2.4 大曲制作过程中不同时间段微生物与理化特征相关性分析
对大曲制作过程中属水平微生物优势菌相对丰度与理化、生化特征之间进行相关性分析(图3)。发现温度是影响大曲微生物群落结构变化的最主要因素,其次是水分。温度与Thermoascus、Issatchenkia、Candida等大部分微生物丰度呈正相关,相关系数为0.14~0.90,与少部分菌群丰度呈现负相关。表明环境温度变化可影响曲块温度变化,从而影响大曲中菌群结构组成,使其功能发生改变。
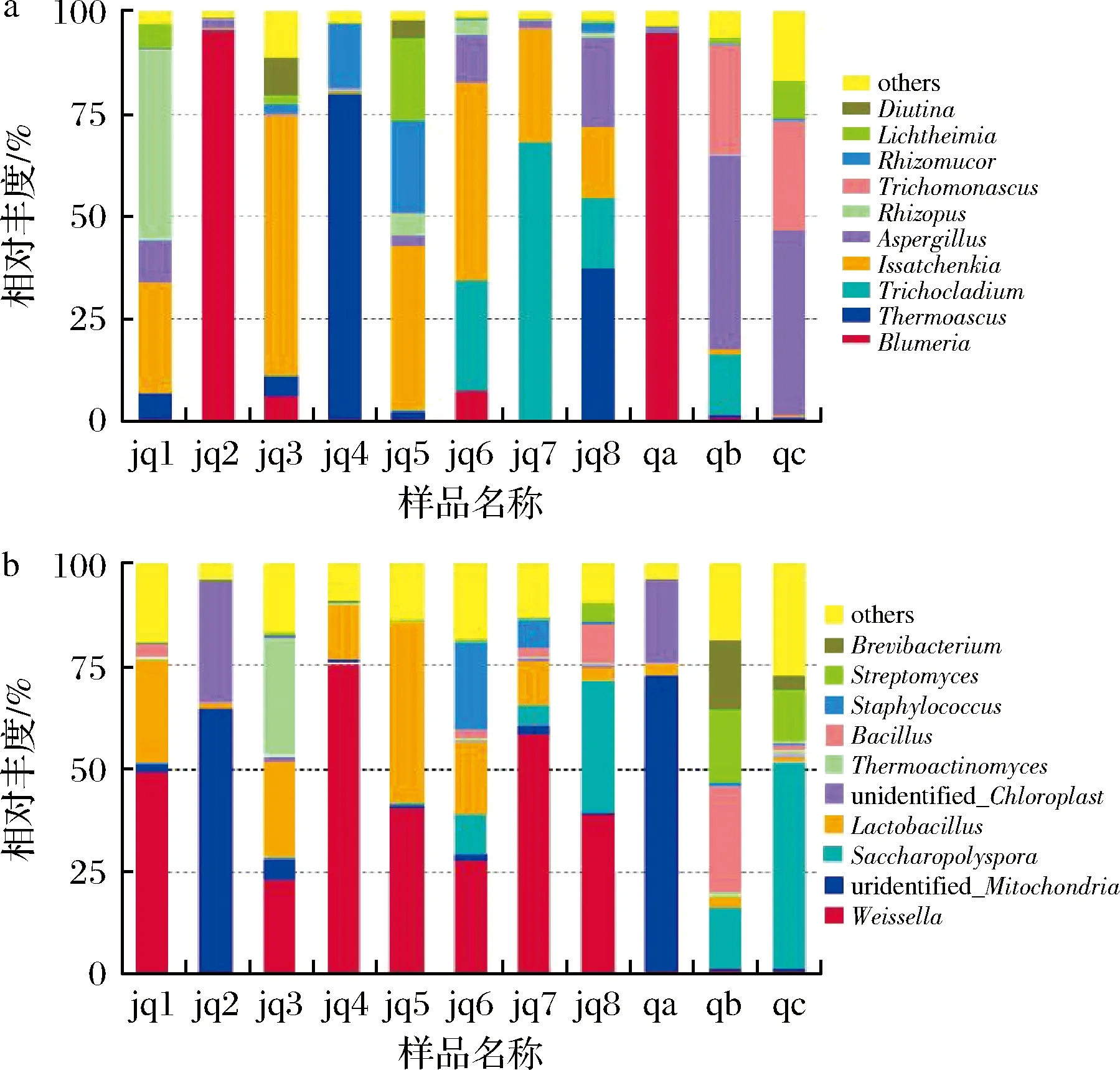
a-属水平大曲真菌群落;b-属水平大曲细菌群落图2 中高温大曲制作过程中真菌和细菌群落群落结构Fig.2 Structure of fungal and bacterial communities in medium-high-temperature Daqu during the starter-making process
糖化力、液化力等作为大曲的重要性质,决定大曲的品质。大曲的生化特征主要受Rhizopus、Rhizomucor、Weissella、Lactobacillus影响,该4种菌属与糖化力、液化力等呈正相关。其中Rhizopus与糖化力、液化力、酯化力和酸性蛋白酶活力呈正相关,相关系数均>0.6,其中与酸性蛋白酶活力相关系数达0.96;Rhizomucor与液化力、酯化力和中性蛋白酶活力相关系数均>0.6,与酯化力最为相关,其系数达0.71;Weissella与糖化力、液化力和酯化力相关系数为0.61~0.75;Lactobacillus与糖化力、液化力、发酵力和蛋白酶活力相关系数均>0.54,其中与发酵力相关系数高达0.75。此外,Issatchenkia仅与发酵力相关系数>0.6,与其余生化特征相关系数均<0.45。Aspergillus与各项理化、生化特征相关系数均<0.51,与发酵力和中性蛋白酶活力更是呈现负相关。说明Issatchen-kia与Aspergillus对大曲品质影响较小,影响大曲功能的关键微生物种属是Rhizopus、Rhizomucor、Weissella、Lactobacillus。
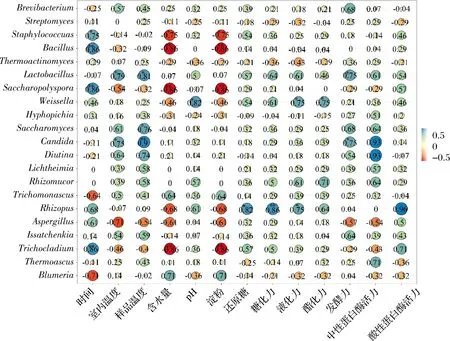
图3 中高温大曲制作过程中优势微生物与理化生化特征之间的相关性分析(属水平)Fig.3 Correlation analysis between dominant microbial taxa and physicochemical and biochemical properties of medium-high-temperature Daqu during the starter-making process (genus level)
3 结论与讨论
中国白酒历史悠久,种类多样,有典型的地域特色。各地白酒除原料和工艺存在差异外,参与酿造前期的酒曲微生物也随酒曲的种类以及地域环境不同而不同,是影响白酒品质与风味的重要因素。本研究通过高通量二代测序分析,发现在该大曲制作过程中,酒曲微生物主要来自曲房环境,真菌归属于8个门、255个属,细菌归属于10个门、262个属。主要优势真菌属为Issatchenkia、Thermoascus、Trichocladium、Aspergillus、Rhizopus、Rhizomucor,优势细菌属为Weissella和Lactobacillus,细菌群落的多样性相对于真菌更为丰富。谭崇尧等[20]对不同地域的浓香型白酒大曲进行分析,发现长江中游地区大曲优势真菌为Aspergillus、Thermoascus等,优势细菌为Lactobacillus、Pediococcus、Leucanostoc等;在西南地区,优势真菌包括Thermoascus、Aspergillus等,优势细菌包括Weissella、Lactobacillus、Bacillus等。不同地区或不同原料制得的浓香型中高温白酒大曲微生物群落结构既有共性之处,也有一定的特性,研究发现以Thermoascus、Aspergillus、Lactobacillus等为代表的菌属都是酒曲中的优势菌属,具有一定的普遍性。此外,本研究通过多样性和菌群结构分析,大曲发酵期间出现的Issatch-enkia、Thermoascus、Rhizopus、Trichocladium、Lichtheim-ia、Weissella、Brevibacterium在qb、qc中存在,由此可推断曲房中的稻草和谷壳是大曲微生物的主要来源,对大曲微生物类群组成影响较大。
中国传统食品发酵是一个复杂的多菌种自然发酵过程,也是一个相对稳定又动态变化的微生态系统。本研究通过相关性分析揭示了该大曲中微生物结构组成与功能之间的关系,并了解大曲中不同微生物对大曲发酵性能的影响程度。在大曲发酵过程中,温度是影响微生物菌群结构的主要环境因子,因此控制曲房温度极为重要。此外,影响大曲功能的主要微生物是Rhizopus、Rhizomucor、Weissella、Lactobacillus。虽然Issatchenkia和Aspergillus在菌群数量占有优势,但其与大曲理化、生化特征相关性不显著,说明功能微生物与其种群数量并不完全一一对应。贾云等[21]通过相关性分析也发现豆瓣酱中的Aspergillus、Bacillus、Weissella等主要与酶活性呈正相关,而细菌群落中丰度最高的Staphylococcus与酶活性却呈负相关。由此可见,种群数量优势的菌功能并不一定强,发挥优势功能的菌在大曲中的丰度不一定是最高。利用二代测序技术结合相关性分析,能全面有效地了解大曲制作过程中微生物群落演替规律和影响大曲功能的关键因素,对科学制曲具有重要的的指导意义。

