基于高分辨MRI的颈动脉粥样硬化患者发生缺血性脑卒中风险预警模型的构建
张彩霞,马媛媛,崔二平,宋蕊楠,张丽丽,杨震,孙文静
沧州市人民医院 a. 神经内科;b. 检验科;c. 核磁室,河北 沧州 061000
引言
颈动脉粥样硬化是一种发生于颈动脉的血管粥样硬化病变,继而出现斑块内出血、斑块破裂脱落等,引起缺血性脑卒中。数据显示[1],颈动脉粥样硬化与脑卒中发生密切相关,其发生率为15%~20%。研究表明,评估受累血管是综合性评估脑卒中患者的重要部分,对评估患者危险程度以及指导治疗均具有重要意义[2]。高分辨率MRI作为一种临床常规检查手段,可更清晰地了解病灶位置以及性质,将高分辨率MRI用于血管壁检查可较好地确定血管壁斑块位置以及稳定性[3]。Derksen等[4]研究指出,动脉可通过负性或正性重构改变稳定的几何结构参与动脉粥样硬化发展过程,颈动脉血管壁变化与缺血性事件密切相关。基于此,本研究通过随访颈动脉粥样硬化患者,统计缺血性脑卒中事件发生率,并采用高分辨率MRI测量缺血性脑卒中患者与非脑卒中患者颈动脉斑块,分析二者的差异,明确缺血性脑卒中发生的危险因素,并建立风险预测模型及验证评分模型效能,以期为临床提供参考。
1 资料与方法
1.1 基本资料
本研究经沧州市人民医院伦理委员会审核批准,收集沧州市人民医院2019年1月至2022年3月经B超筛选颈动脉粥样硬化患者80例,纳入标准:① 经彩色多普勒超声检查显示至少一侧颈动脉存在斑块或者管壁增厚,且最大管壁厚度超过1.5 mm;② 年龄>18岁;③ 患者病历资料完整;④ 患者或家属知情同意并签署知情同意书。排除标准:① 合并其他系统肿瘤、心肝肾等重要器官疾病者;② 伴有颅内动脉血管严重狭窄、大动脉炎者;③ 伴有蛛网膜下腔出血、动静脉畸形、脑实质出血等出血性脑卒中患者;④ 合并风湿性心脏病、感染性心内膜炎、扩张性心肌病者。
1.2 方法
1.2.1 检查方法
采用Siemens 3.0 T超导MR成像系统、8-NV头颈联合线圈检查,患者取仰卧位,将其头颈部固定于线圈内后连接高压注射器,行颈部血管3D-TOF扫描后经MIP与MPR重建观察患者颈动脉狭窄处。于颈动脉狭窄处行COR位3D-T1WI平扫、TRS位PDW相扫描、TRE位T2WI扫描,经CEMRA蒙片扫描,注射对比剂后于透视状态下观察,当主动脉弓上3支血管显示时立即启动3D扫描,行3D-T1WI增强扫描。并将MRI检查数据输入软件处理工作站,图像放大2~3倍,选取管壁最厚处为病变层面,选取病变近心端或远心端正常血管为参考层面,手动勾画血管腔与血管壁轮廓,获取相应的管腔面积与血管面积。计算重构指数(Remodeling Index,RI)、管壁标准化指数(Normalized Wall Index,NWI)、 偏 心 指 数(Eccentricity Index,EI)。以距离病变最狭窄处10 mm以内正常且无分支开口的血管为参考血管,测定近远端参考血管的外弹力膜横截面面积(External Elastic Membrane-Cross Sectional Area,EEM-CSA),计算冠状动脉的RI。RI=冠状动脉病变处EEM-CSA/近远端参考血管EEM-CSA的平均值。相关定义:RI>1.05,提示正性重构;RI<0.95,提示负性重构;0.95≤RI≤1.05,提示无重构。NWI=血管壁面积/血管总面积。EI=(最大管壁厚度-最小管壁厚度)/最大管壁厚度,EI≤0.5为偏心斑块,EI>0.5为向心斑块。
1.2.2 随访与分组
对上述经高分辨率MRI检查的患者通过电话、门诊、病房巡视等方式随访60 d,了解是否发生脑卒中目标事件,并进行颅脑MRI复查。并以此进行分组,将发生脑卒中患者纳为缺血性脑卒中组,未发生脑卒中患者纳为非脑卒中组,收集两组患者性别、年龄、血压、吸烟、合并高血脂、糖尿病等临床资料。同时确定颈动脉狭窄程度,记录内脂质坏死核心(Lipid Rich Necotic Core,LRNC)、斑块内出血(Intra-Plaque Hemorrhage,IPH)、纤维帽破裂(Fibrous Cap Rupture,FCR)情况。
1.3 统计学分析
采用SPSS 19.0进行统计处理,计数资料采用n(%)表示,比较采用χ2检验;计量资料以±s表示,组间比较采取独立样本t检验。采用多因素Logistic回归模型分析缺血性脑卒中组脑卒中发生的危险因素并建立预测模型,采用受试者工作特征(Receiver Operating Characteristic,ROC)曲线评估其风险预测模型预测脑卒中发生的效能,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者一般资料比较
80例患者随访结束后有15例(18.75%)发生脑卒中,将此部分患者纳入缺血性脑卒中组,其余65例纳入非脑卒中组。两组患者在年龄、性别、收缩压、舒张压、吸烟、合并高同型半胱氨酸血症等方面差异无统计学意义(P>0.05);在合并高血脂、糖尿病方面差异有统计学意义(P<0.05),见表 1。
表1 两组患者一般资料比较[±s,n(%)]

表1 两组患者一般资料比较[±s,n(%)]
参数 非脑卒中组(n=65)缺血性脑卒中组(n=15) t/χ2值 P值年龄/岁 56.89±7.54 58.64±7.56 0.810 0.421性别(男/女) 37/18 9/6 0.268 0.605收缩压/mmHg 142.08±10.95 141.96±10.41 0.039 0.969舒张压/mmHg 83.51±10.29 84.29±10.36 0.264 0.792吸烟 21(41.54) 7(46.67) 1.105 0.293合并高血脂 17(26.15) 8(53.33) 4.191 0.041合并糖尿病 16(24.62) 8(53.33) 4.786 0.029合并高同型半胱氨酸血症 6(9.23) 1(6.67) 0.100 0.751
2.2 两组患者斑块负荷参数比较
缺血性脑卒中组患者颈总动脉的RI、管壁厚度、NWI,颈内动脉的RI、管壁厚度,均显著高于非脑卒中组,差异有统计学意义(P<0.05),见表2。
表2 斑块负荷参数比较(±s)
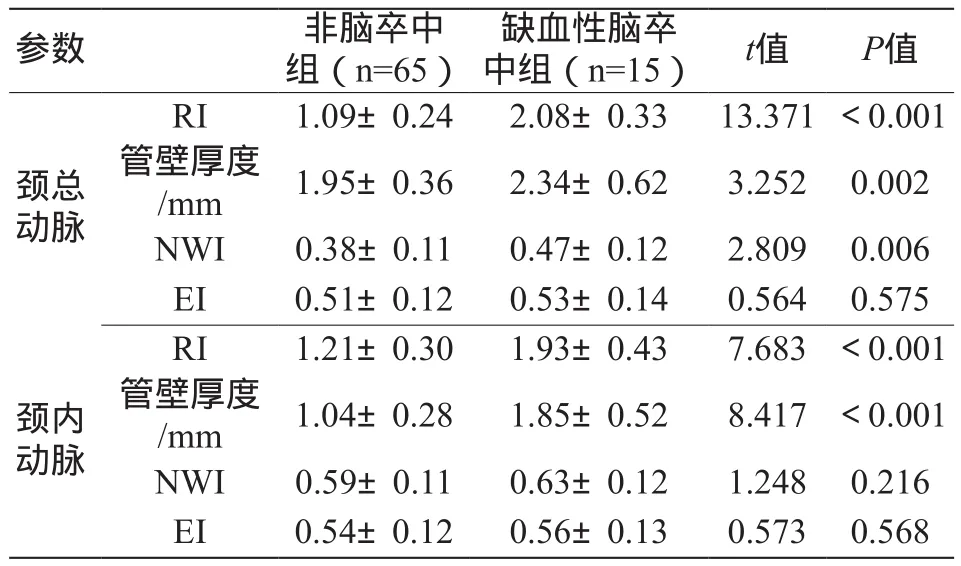
表2 斑块负荷参数比较(±s)
注:RI为重构指数;NWI为管壁标准化指数;EI为偏心指数。
参数 非脑卒中组(n=65)缺血性脑卒中组(n=15) t值 P值颈总动脉RI 1.09±0.24 2.08±0.33 13.371 <0.001管壁厚度/mm 1.95±0.36 2.34±0.62 3.252 0.002 NWI 0.38±0.11 0.47±0.12 2.809 0.006 EI 0.51±0.12 0.53±0.14 0.564 0.575 RI 1.21±0.30 1.93±0.43 7.683 <0.001管壁厚度/mm 1.04±0.28 1.85±0.52 8.417 <0.001 NWI 0.59±0.11 0.63±0.12 1.248 0.216 EI 0.54±0.12 0.56±0.13 0.573 0.568颈内动脉
2.3 两组患者实验室指标、斑块负荷比较
缺血性脑卒中组患者低密度脂蛋白胆固醇(Low-Density Lipoprotein Cholesterol,LDL-C)、总胆固醇(Total Cholesterol,TC)、IPH、LRNC、FCR 均显著高于非脑卒中组,且差异有统计学意义(P<0.05),见表3。
表3 实验室指标、斑块负荷指标[±s,n(%)]
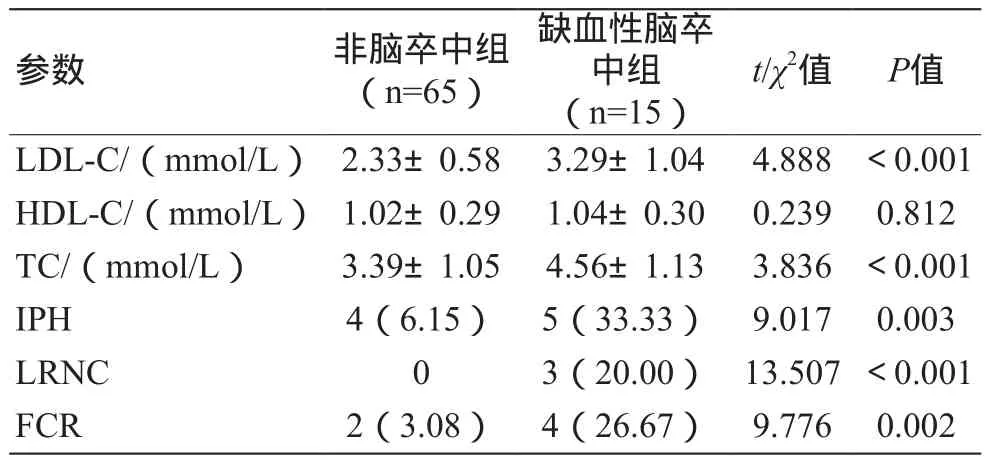
表3 实验室指标、斑块负荷指标[±s,n(%)]
注:LDL-C为低密度脂蛋白胆固醇;HDL-C为高密度脂蛋白胆固醇;TC为总胆固醇;IPH为斑块内出血;LRNC为内脂质坏死核心;FCR为纤维帽破裂。
t/χ2值 P值LDL-C/(mmol/L) 2.33±0.58 3.29±1.04 4.888 <0.001 HDL-C/(mmol/L) 1.02±0.29 1.04±0.30 0.239 0.812 TC/(mmol/L) 3.39±1.05 4.56±1.13 3.836 <0.001 IPH 4(6.15) 5(33.33) 9.017 0.003 LRNC 0 3(20.00) 13.507<0.001 FCR 2(3.08) 4(26.67) 9.776 0.002参数 非脑卒中组(n=65)缺血性脑卒中组(n=15)
2.4 颈动脉粥样硬化患者缺血性脑卒中发生危险因素Logistic回归分析
以单因素中有统计学差异的变量作为自变量,以缺血性脑卒中发生情况(发生=1,未发生=0)作为因变量,同时纳入糖尿病、高血脂作为矫正混杂因素进行多因素Logistic回归分析,结果显示LRNC、FCR、颈总动脉的NWI和RI是颈动脉粥样硬化患者发生缺血性脑卒中的危险因素(P<0.05),见表4。
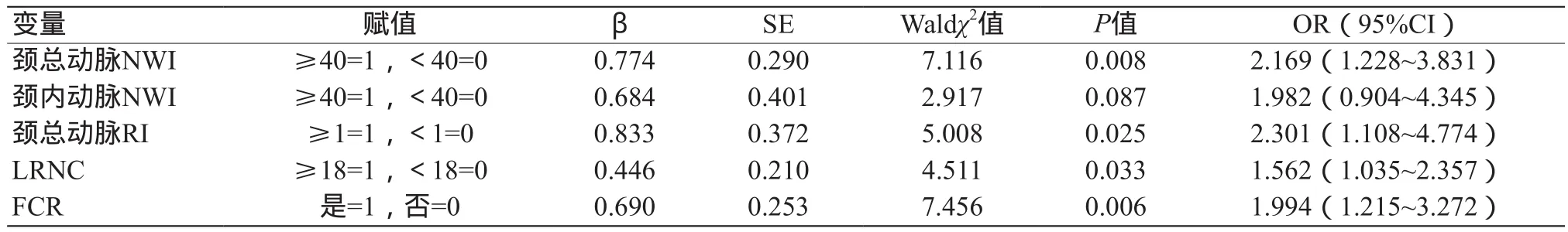
表4 颈动脉粥样硬化脑卒中发生相关MRI危险因素Logistic回归分析
2.5 基于多因素Logistic回归分析的评分模型
根据多因素Logistic回归分析结果构建颈动脉粥样硬化患者缺血性脑卒中发生的预测方程:Logit(P)=-1.743+0.774×(颈总动脉NWI>75)+0.833×(颈总动脉RI>1)+0.446×(合并LRNC)+0.690×(合并FCR)。根据预测方程,各影响因素对应的回归系数除以模型中最小回归系数并四舍五入后取整数值,得到评分模型的评分体系:颈总动脉NWI>75=2分,RI>1=2分,合并LRNC=1分,合并FCR=1分,总分0~6分。同时,颈动脉粥样硬化患者脑卒中发生的预测概率=1/{1+exp[-(β0+总分×βm)]},其中β0为常数项,βm为回归模型中最小的回归系数。颈动脉粥样硬化患者缺血性脑卒中发生率随评分的升高而升高,评分越高,脑卒中发生风险越大(表5)。
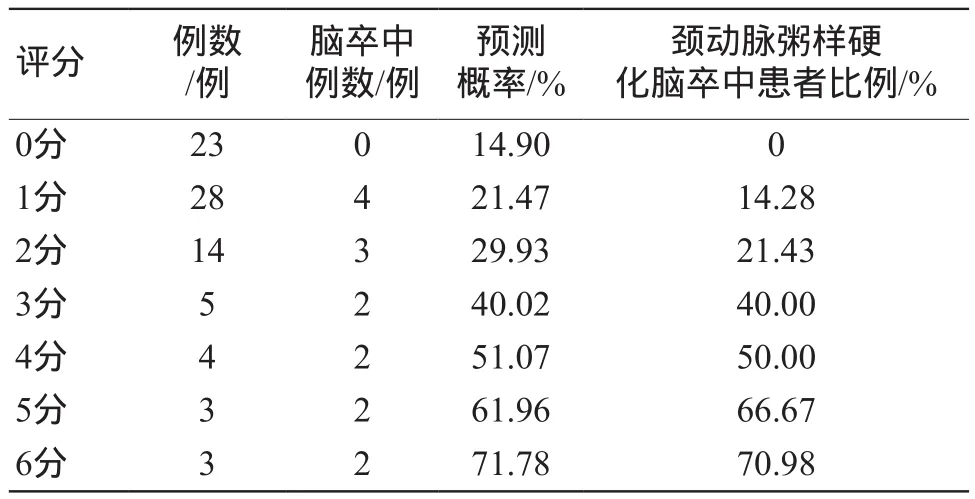
表5 评分模型对颈动脉粥样硬化脑卒中发生的预测概率分布
2.6 评分模型预测效能验证分析
绘制评分模型预测缺血性脑卒中发生的ROC曲线,对基于缺血性脑卒中多因素Logistic回归分析建立的评分模型进行预测效能的评价,结果显示:当评分模型为4分时,ROC曲线下面积为0.886(95%CI:0.791~0.893),敏感度和特异性分别为86.94%和89.12%(图1)。

图1 基于评分模型预测效能的ROC曲线
3 讨论与结论
张丽等[5]研究指出,颈动脉粥样硬化是缺血性脑卒中发生的危险因素之一,由于颈动脉处出现狭窄病变后造成脑血流减少,致使动脉粥样硬化斑块破裂、脱落形成微血栓,引发脑卒中。其中动脉斑块的不稳定性是造成斑块破裂以及血栓形成的重要原因[6-7]。目前诊断动脉粥样硬化的影像学技术较多,其中超声、CT容易受到皮肤、钙化声影、血流以及呼吸运动等因素的影响[8],同时缺乏对斑块成分的量化诊断。高分辨率MRI因其良好的空间分辨率,可较为准确地显示与评价斑块的组织学成分、形态特征,且重复性较高,具有较好的临床使用价值。
本研究经60 d随访结果显示,80例颈动脉粥样硬化患者中有15例出现脑卒中目标事件,发生率为18.75%,这一结果与既往研究相似[9]。缺血性脑卒中组颈总动脉RI、管壁厚度、NWI均显著高于非脑卒中组,颈内动脉RI、管壁厚度显著高于非脑卒中组,提示颈动脉粥样硬化患者动脉RI、血管壁增厚可能参与了脑卒中的发生,同时对预测脑缺血事件发生风险具有潜在意义。颈动脉粥样硬化性管腔狭窄与几何重构密切相关,扩张性重构弥补了斑块增长对原本狭窄管腔的影响,但扩张性重构的斑块需要更大的脂质核心与巨噬细胞,而这两种特征又与斑块不稳定有关[10]。高分辨率MRI是目前测量颈动脉斑块负荷以及评估斑块成分的有效手段之一,可准确地测量管壁厚度、NWI、RI等斑块负荷,同时图像质量较高,受呼吸以及运动伪影的影响较小[10]。同时Mournet等[11]也研究证实,高分辨率MRI可通过大纵向范围覆盖与各向同性高空间分辨率成像系列扫描患者颈动脉,准确地显示斑块形态,测量精度较高,在血管壁中应用前景广阔。
本研究通过比较缺血性脑卒中患者与非脑卒中患者临床资料以及MRI检查数据,结果显示两组患者在合并高血脂、糖尿病、LDL-C、TC、IPH、LRNC、FCR及颈总动脉的NWI、RI方面差异有统计学意义。高血压与糖尿病在血流动力学以及斑块稳定性改变中发挥着重要作用,进而诱发缺血性疾病发生,是诱发脑卒中发生的常见危险因素[12-14]。FCR会造成IPH,而IPH进一步刺激引起LRNC,LRNC增大促使斑块负荷增加,进而促使斑块表面破裂风险增加,诱发脑卒中事件发生[15]。将上述存在差异的危险因素进一步采用Logistic回归分析,结果显示,在矫正糖尿病和高血压等混杂因素后,LRNC、FCR及颈总动脉NWI、RI等MRI参数仍是颈动脉粥样硬化患者发生脑卒中的危险因素。NWI是血管壁面积占血管总面积比值,动脉粥样硬化病变早期基于血管壁外界的代偿性扩张,斑块负荷增加,但管腔的截面积在较长时间内保持不变[16],这种保证供血量的保护机制可持续到管腔严重扩张,或者斑块占管腔面积的40%[17],可见仅测量管腔狭窄程度有时无法检测出动脉粥样硬化性病变,同时测量管腔形态学以及成分的变化十分重要。高分辨率MRI测量后可获取颈动脉管壁与斑块图像,通过多层面连续观察与长轴位成像对颈动脉粥样硬化病变做出整体且直观的评价[18]。颈动脉粥样硬化与缺血性脑卒中密切相关,而斑块不稳定性与血栓形成是脑卒中发生的重要原因,检测颈动脉狭窄程度只是预测缺血性脑卒中事件发生的一项指标,应从预防疾病角度出发,通过检测颈动脉结合血液生化指标,综合评估缺血性脑卒中发生的危险因素。高分辨率MRI可评估斑块是否为易损斑块,还可显示斑块成分以及负荷、斑块稳定性等信息,有利于确定后续治疗方案。
本研究根据多因素Logistic回归分析结果构建颈动脉粥样硬化患者缺血性脑卒中发生的预测方程:-1.743+0.774×(颈总动脉 NWI>75)+0.833×(颈总动脉 RI>1)+0.446×(合并LRNC)+0.690×(合并FCR)。根据预测方程中各因素对应的回归系数除以模型中最小回归系数得到评分模型的评分体系,并根据公式计算出颈动脉粥样硬化患者缺血性脑卒中发生的预测概率。颈动脉粥样硬化患者缺血性脑卒中发生率随评分的升高而升高,评分越高患者缺血性脑卒中发生风险越大。绘制评分模型预测缺血性脑卒中发生的ROC曲线,对基于缺血性脑卒中多因素Logistic回归分析建立的评分模型进行预测效能的评价,结果显示,当评分模型为4分时,ROC曲线下面积为0.886(95%CI:0.791~0.893),敏感度和特异性分别为86.94%和89.12%,提示该评分模型具有较高的预测价值。
本研究还存在以下局限性:① 样本量偏小,尚未开展前瞻性大型临床研究;② 未对不同病情影响开展研究,未来将进一步扩展研究,以期获得更佳的临床参考。
综上所述,LRNC、FCR及颈总动脉NWI、RI等MRI参数是颈动脉粥样硬化患者发生脑卒中的危险因素,基于高分辨率MRI检查,本研究成功建立了颈动脉粥样硬化患者缺血性脑卒中发生的风险预测模型,具有良好的预测价值。

