基于MRI影像组学预测宫颈鳞癌中、低分化的临床价值
党俊明,朱超华,黄慧娴,陆合明
1. 广西中医药大学 瑞康临床医学院,广西 南宁 530000;2. 广西壮族自治区人民医院 放疗科,广西 南宁 530000
引言
目前,宫颈癌的死亡率约占女性恶性肿瘤死亡总数的8%[1],而鳞状细胞癌约占宫颈癌所有病理类型的80%[2],鳞癌按照病理学可分级为高分化鳞癌、中分化鳞癌及低分化鳞癌。临床上不同组织学分化患者的预后和肿瘤异质性相关,尤其低分化鳞癌易发生局部浸润和远处转移,严重影响患者预后[3],因此,及早明确鳞癌的组织病理学分化,对制定治疗方案和预后评估具有重要意义。现阶段,组织学分化的标准诊断方法是对肿瘤样本进行组织病理学分析,宫颈癌病理取材方式多样,但多数具有侵入性和创伤性,患者不易接受,且取材标本局限不能反映肿瘤组织所有情况。MRI图像具有较高的软组织分辨率及多方位成像等特点,可反映肿瘤整体信息。近年来,基于影像组学特征反映肿瘤异质性的实验探讨被广泛报道:杨易等[4]基于T2WI图像筛选11个最优影像组学特征,构建的预测模型在训练集和验证集中的拟合优度均较优,曲线下面积(Area Under Curve,AUC)均为0.80,决策曲线分析显示阈值取0.10~1.00时,组学模型的净收益较大,对预测宫颈鳞癌的早、晚临床分期具有较高价值;Liu等[5]基于T2抑脂序列和对比增强 T1加权序列图像提取的组学特征,构建回归和决策树模型显示:两者的AUC值分别为 0.777 和 0.750,可有效用于预测区分宫颈腺癌和鳞癌。但目前关于MRI影像组学对宫颈鳞癌高、中、低病理学分化的研究报道较少,本研究旨在探讨基于宫颈鳞癌患者治疗前MRI -T2W1序列图像,定量分析鳞癌的影像组学特征参数差异,筛选预测宫颈鳞癌病理学中、低分化的相关特征。
1 资料与方法
1.1 一般资料
本研究回顾性分析2018年6月——2021年2月广西壮族自治区人民医院临床肿瘤中心接受治疗的宫颈鳞癌患者72例,根据病理学分级:中分化患者40例,低分化患者32例。中分化患者年龄38~73岁,中位年龄55.80岁,KPS(Karnofsky)评分均值为82.45分,国际妇产科学联合会(The International Federation of Gynecology and Obstetrics,FIGO)分期Ⅱ期28例,FIGO分期Ⅲ期12例;低分化患者年龄36~79岁,中位年龄54.50岁,KPS评分均值为83.10分,FIGO分期Ⅱ期14例,FIGO分期Ⅲ期18例,两组一般资料比较,差异无统计学意义(P>0.05)。入组患者治疗前均在我院进行MRI扫描。纳入标准:① 经组织病理学诊断为宫颈鳞癌患者;② FIGO分期为ⅡA~ⅢC期患者;③ 初治为宫颈鳞癌未手术的患者;④ 年龄18~80岁;⑤ KPS评分在70分以上;⑥ 确诊前后及临床治疗中具有完整的影像学资料的患者。排除标准:① 已接受治疗后的患者;② 影像学图像质量不佳或缺失的患者;③ 合并其他恶性肿瘤者或患有危重疾病患者;④ 已发生远处转移的患者。本研究已经过广西壮族自治区人民医院伦理委员会的批准(编号:KY-LW-2021-8)。
1.2 MRI图像获取及大体肿瘤靶区勾画
入组患者的MRI图像均由西门子3.0 T磁共振获取。扫描时患者膀胱保持适度充盈,在平静呼吸状态下行盆腔MRI断面扫描,采用T1序列、T2序列及弥散加权成像(Diffusion Weighted Image,DWI)序列,经三维重建后行多层、多幅、快速成像。获取以上序列的清晰图像,并导入MIM系统,由2位高年资影像诊断医师共同决定在T2WI图像分割勾画大体肿瘤靶区(Gross Tumor Volume,GTV),并将其设置为感兴趣区域(Region of Interest,ROI),见图1。
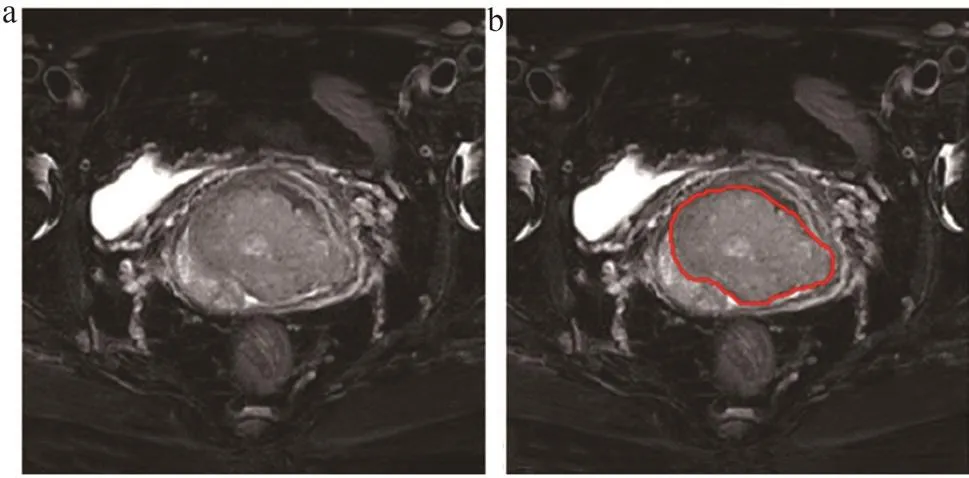
图1 肿瘤靶区勾画前后对比图
1.3 影像组学特征提取
实验中,使用IBEX工具箱[6]提取肿瘤GTV的影像组学特征,所提取的特征包括:纹理特征如灰度共生矩阵(Gray Level Cooccurrence Matrix,GLCM)、灰度游程矩阵(Gray Level Run Length Matrix,GLRLM)、邻域灰度差异(Neighbor Intensity Difference,NID)、一阶灰度统计特征如灰度强度(Intensity Direct,ID)、灰度直方图(Intensity Histogram)和形状特征(Shape)6组682个特征,见图2。
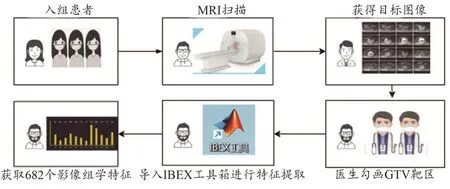
图2 影像组学特征提取示意图
1.4 统计学分析
采用Python3.7的工具包“SciPy”对提取的组学特征进行独立性检验,Levene检验用于检测方差齐性,方差齐性选用两独立样本t检验,方差不齐则选用Welch’s t检验检验,LASSO算法用于特征降维。Pearson相关用于分析筛选组学特征与组织病理学分级之间的相关性,特征参数绘制接受者操作特性(Receiver Operating Characteristic,ROC)曲线,计算ROC AUC。统计学认为0.5≤AUC<0.7具有较低的置信度,0.7≤AUC<0.9具有一定的置信度,AUC≥0.9具有较高的置信度。对预测指标进行ROC分析并计算YOUDEN指数,找出预测指标的最佳阈值、敏感性和特异性。采用SPSS 25.0软件进行统计学分析,P<0.05为差异有统计学意义。
2 结果
2.1 影像特征差异性比较
实验中共提取有效的组学特征682个,经过t检验筛选,136个特征在组间具有差异性,使用LASSO降维,最终保留23个有统计学意义的组学特征。分别为GLCM中的逆方差(Inverse Variance)4个、相关(Correlation)4个、相关信息测度(Information Measure Corr2)1个、最大概率(Max Probability)6个;GLRLM中的低灰度游程因子(Low Gray Level Run Empha)1个,短游程低灰度因子(Short Run Low Gray Level Empha)1个;灰度(Intensity Direct)中的局部最小熵(Local Entropy Min)1个、能量(Energy)1个,集群阴影(Cluster Shade)4个。具体特征分布见表1。

表1 23个有统计学意义的特征
2.2 相关性分析
Pearson相关分析结果表明, 23个差异性有统计学意义的特征中,有8个特征与宫颈鳞癌病理学分级表现出较强的相关性;其中有5个特征(135_4相关、333_4相关、0_1最大概率、90短游程灰度因子、333低灰度游程因子)与鳞癌的中分化相关,相关系数r值分别为0.439、0.457、0.474、0.527、0.443,对应P值分别为0.004、0.002、0.002、0.000、0.003;有3个特征(90_1逆方差、2_1相关、333_7相关信息测度)与鳞癌的低分化相关,相关系数r值分别为0.507、0.450、0.441,对应P值分别为0.001、0.003、0.004。这些特征和鳞癌中、低分化病理学分级呈正相关,即特征值越大,预测对应病理分级的准确度越高,相关系数r值和P值详见表2,宫颈中、低分化鳞癌T2WI图像及对应的病理学图片见图3~4。
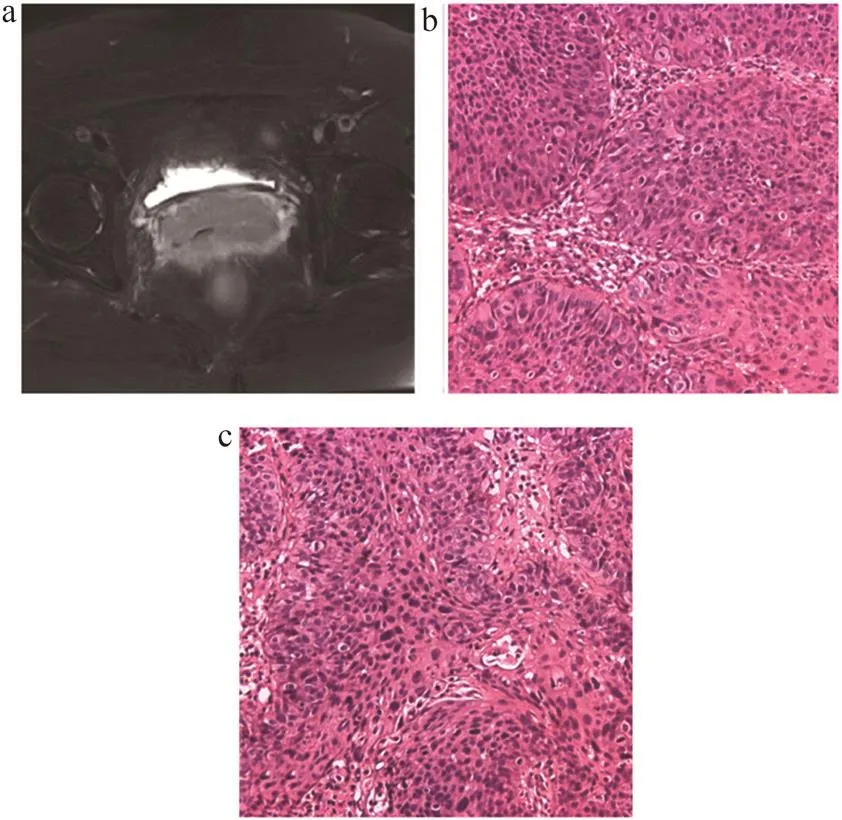
图3 宫颈中分化鳞癌T2WI图像及对应的病理学图片

图4 宫颈低分化鳞癌T2WI图像及对应的病理学图片
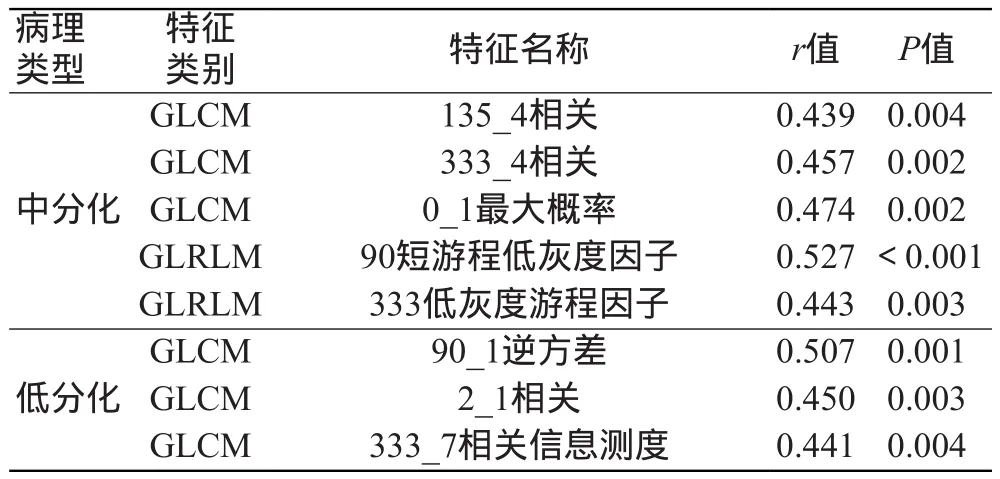
表2 影像组学特征与鳞癌病理分级的中、低分化相关性
2.3 ROC曲线分析
经ROC曲线分析,与鳞癌病理学分级具有相关性的8个特征均具有一定的预测价值,其ROC AUC值均大于0.7。与中分化病理类型相关的5个特征(135_4相关、333_4相关、0_1最大概率、90短游程低灰度因子、333低灰度游程因子)ROC AUC分别为0.769、0.808、0.775、0.772、0.739;与低分化病理类型相关的3个特征(90_1逆方差、2_1相关、333_7相关信息测度)ROC AUC分别为0.819、0.828、0.778。其中333_4 相关(333_4Correlation)特征参数和2_1相关(2_1Correlation)特征参数分别在中分化和低分化类型中表现出最佳预测性能,ROC曲线见图5~6。

图5 5个影像组学特征参数鉴别鳞癌中分化的ROC曲线
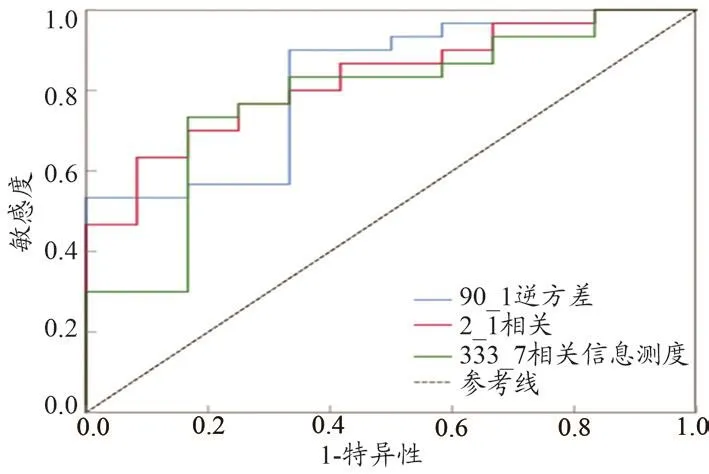
图6 3个影像组学特征参数鉴别鳞癌低分化的ROC曲线
2.4 特征参数的最佳阈值
特征参数的AUC值统计结果如表3显示,通过ROC曲线分析计算各个坐标的YOUDEN指数,根据最大YOUDEN数值分析特征的最佳阈值及敏感性和特异性,与鳞癌中分化病理学分级相关特征的敏感性、特异性最大值分别为0.667、0.933;与鳞癌低分化病理学分级相关特征的敏感性、特异性最大值分别为0.900、0.917。

表3 ROC曲线分析的AUC值、敏感性、特异性、最佳阈值、P值和95%置信区间
3 讨论与结论
从CT、MRI 或PET-CT等医学影像中高通量地提取组学特征并将其转化为数据,利用计算机语言等工具对数据进行量化,可全面地描绘病变的细微特征,客观地反映肿瘤的异质性,从而为肿瘤的分型分级提供更多可能[7-8]。近年来,基于MRI图像应用于肿瘤分型分级的组学研究较多,李薇等[9]基于脂肪抑制 T2WI、动态增强T1WI二者联合序列的影像组学特征构建组学预测模型,有效预测了 Luminal A型、Luminal B 型、HER-2 过表达型和TN 型乳腺癌分子分型,ROC AUC分别为 0.820、0.808、0.900、0.837。杨椿雪等[10]基于轴位和矢状位T1WI增强图像,应用SMOTE技术建立的影像组学综合模型的预测性能最优,其ROC AUC、敏感性、特异性、准确度分别为0.982、0.900、1.000和 0.963,可用于术前脑膜瘤病理分级预测。
MRI因其优越的软组织对比度在临床运用越来越广泛,在宫颈癌诊疗中MRI的应用也较常见,尤其T2WI序列的MRI图像在宫颈组织中具有较好的软组织对比度和分辨率,结合横断位、矢状位图像能清晰显示宫颈异常信号,肌质环呈低信号及病灶略呈高信号,并可提供详细的肿瘤解剖特征,客观反映病灶的真实情况,是影像组学研究宫颈肿瘤的最佳序列[11]。而DWI功能成像可以提供良好的肿瘤清晰度,有助于识别宫颈肿瘤和正常组织,可用于检测宫颈早期病变和评估肿瘤分型分级[12]。T2WI和DWI是诊断序列功能成像的主要手段,二者结合更有助于明确病灶范围和形态,以及准确勾画GTV并进行重复分析[13]。
Wu等[14]基于T2WI及DWI多参数影像组学特征评估宫颈鳞癌的肿瘤分化程度和淋巴结转移情况,结果发现,功能图显示出比解剖图像更好的分辨率,结合多序列MR图像的影像组学模型可以区分中分化和低分化的宫颈鳞癌,AUC值为0.802,灵敏度和特异度分别为76.5%和73.3%。李笑然等[15]基于MR多序列的影像组学模型预测宫颈鳞癌组织分型角化型与非角化型的研究中,T1、T2、T2抑脂及联合多序列模型的ROC曲线AUC值分别为0.718、0.705、0.756和0.863,其中以联合模型预测效果最佳;预测非角化型鳞癌的 AUC值为0.860,准确率为0.720。对比以上基于MRI影像组学评估宫颈癌分型分级的研究,本研究通过分析基于T2WI影像组学参数特征与宫颈鳞癌的中、低分化相关性,探讨预测病理学分级的潜在临床价值。
本研究以T2WI图像作为影像组学特征的提取来源,图像选材均是位于宫颈部位的浸润性病变,要求病灶均>0.5 cm,宫颈以外的病灶如转移淋巴结等未纳入图像特征筛选,运用IBEX工具箱共获取每个宫颈癌病例的682个影像组学数据参数,经过t检验、LASSO特征降维、Pearson相关分析,最终得出8个与鳞癌病理学分级相关的组学数据特征,其中GLCM、GLRLM中的5个特征与鳞癌中分化病理学分级相关,相关系数r值分别为0.439、0.457、0.474、0.527、0.443,ROC AUC 值 分 别 为 0.769、0.808、0.775、0.772、0.739。GLCM中的3个特征与鳞癌低分化病理学分级相关,相关系数r值分别为0.507、0.450、0.441,ROC AUC值分别为0.819、0.828、0.778。在这组数据中,对应MRI图像呈高信号,宫颈鳞癌的中、低分化病理学分级与病灶的信号具有相关性,本研究中的组学特征与宫颈鳞癌中、低分化的相关系数为0.439~0.527,二者存在相关性。
恶性肿瘤的生物学异质性与影像的纹理特征有一定的相关性,基于此,CT或MRI 影像组学的纹理特征可用于评估肿瘤的异质性[16-17],Tixier等[18]认为基于影像组学提取的特征主要是2类,即一阶特征和纹理特征,其中,一阶特征与ROI内的灰度级频率有关,反映强度直方图整体信息;纹理特征描述同质性区域特征,反映肿瘤的异质性。而肿瘤异质性往往在图像灰度变化上体现,GLRLM是用以计算特定方向图像纹理的粗糙程度特征,GLCM则是描述灰度空间相关纹理特征的常用方法。在T2WI模型诸多纹理特征中,GLCM被提及的重复性较高[19],说明其在区分良恶性肿瘤等异质性方面具有较高的鉴别能力。与常规参数相比,这些影像组学特征可以消除采样偏差,准确反映肿瘤异质性和亚区域环境,并可鉴别宫颈癌的肿瘤分级,且具有稳定性和可重复性。对应本研究最终筛选出的8个有效组学特征,均属于纹理特征中的GLCM和GLRLM,与以往的研究结论基本一致。
Fiset等[20]对 MRI 影像组学特征的观察者间变异性进行评估,结果显示MRI比 CT 具有更好的稳定性和重复性。可见基于MRI影像组学的方法来评估和预测宫颈癌病理组织分型分级对临床决策有积极意义。在临床诊疗中宫颈癌病理组织学上主要为鳞癌,腺癌为15%~20%。一般认为宫颈腺癌较鳞癌预后差[2-3],然而肿瘤低分化病理学分级,在宫颈鳞癌及腺癌中均是影响预后的不良因素,低分化能否作为辅助治疗的指征仍存在一定争议。但Zhang 等[21]认为可以考虑作为早期术后辅助化疗的指征。
作为一种新型生物标志物,影像组学分析已成为一种常用的通过图像评估肿瘤异质性的定量方法,并在乳腺癌、肺癌、胶质母细胞瘤和肾癌等癌种中得到验证[22-23]。本研究具体探讨了基于MRI-T2WI影像组学特征与宫颈鳞癌中、低分化的相关性,并对患者的病理分级进行相关预测。然而实验过程也存在一定的局限:① 所有数据是在同一特定类型的MR扫描仪获得的,有可能导致数据选择存在偏倚;② GTV皆为人工手动勾画,很难避免主观认知因素对ROI产生的影响,这可能会降低提取特征的准确性;③ 本实验的样本量较少,虽然结果表明宫颈鳞癌的病理分级与影像组学特征存在一定的相关性,但仍需进一步扩大样本量,以保证提取特征数据的稳定性。
综上所述,利用MRI-T2WI图像的影像组学特征,有助于区分宫颈鳞癌的中、低分化病理学分级,可作为临床治疗前判断肿瘤异质性的一种无创、有价值的辅助方法。

