外周血T淋巴细胞亚群水平对胃癌辅助化疗患者预后的影响
刘阳 渊全 孙永臣
(商丘市第一人民医院肿瘤放疗二病区,河南 商丘 476000)
胃癌是我国最常见的恶性肿瘤之一 ,在我国其发病率居各类肿瘤的首位,可发生于任何年龄,早期症状常不明显,随着病情的进展,胃部症状渐转明显,出现上腹部疼痛,食欲不振、消瘦,体重减轻和贫血等,严重威胁人民身体健康的疾病[1]。根治术是目前治疗胃癌(Gastric cancer,GC)较为有效的方案,但手术无法完全切除肉眼看不到的微小病灶,且部分患者术后复发、转移风险较高,因而根治术后多需进行全身辅助性化疗,进一步消灭微小病灶,以此改善患者预后[1]。但是化疗药物杀死肿瘤细胞的同时也可对周围正常组织造成一定破坏,导致部分患者对化疗药物耐受性低,加速病情进展,故关注其预后情况具有必要性。机体的免疫功能与GC病情进展、治疗效果及预后等均密切相关[2]。而外周血T淋巴细胞亚群是目前反映机体功能较为敏感的指标,由此推测,通过检测外周血T淋巴细胞亚群水平可一定程度上反映GC患者辅助化疗预后情况[3]。鉴于此,本研究旨在分析外周血T淋巴细胞亚群水平在GC辅助化疗患者中表达,并与其预后的关系。
1 资料与方法
1.1 一般资料
经医学伦理委员会审核并批准,病例来源于2018年11月至2020年11月商丘市第一人民医院收治的100例GC患者。纳入标准:GC参照《内科学(第9版)》[4]诊断,胃镜、病理等相关检查确诊;TNM分期为Ⅱ~Ⅲ期;均行FOLFOX4化疗方案辅助化疗治疗;均具有可评价的实体病灶;凝血功能检查均正常。排除标准:合并胃部严重出血的患者;近半年进行根除幽门螺杆菌治疗、化疗以及免疫治疗的患者;伴有结核病的患者;伴有自身免疫性疾病的患者;生活无法自理的患者。患者均知晓本次研究,并签署同意书。
1.2 方法
1.2.1 外周血T淋巴细胞亚群水平检测
辅助化疗前,于清晨7点至10点取患者空腹≥8 h的肘静脉血4 mL,采用EDTA-2K 抗凝,以3000 r•min-1离心10 min,离心半径为13.5 cm,取去上层清液,采用流式细胞仪(美国BD Accuri C6 Plus)检测患者外周血T淋巴细胞亚群水平,包括CD3+、CD4+、CD8+、CD4+/CD8+。
1.2.2 短期预后评估及分组
化疗3个周期结束后,参照RECIST实体瘤[5]评估疗效:完全缓解(Complete remission,CR):肿瘤病灶消失>4周;部分缓解(Partial remission,PR):靶病灶缩小≥30 %>4周;疾病进展(progression disease,PD):靶病灶增大≥20 %或发现新病灶;疾病稳定(stable disease,SD):介于PR、PD之间。
以化疗3个周期的疗效作为短于预后评估指标,将患者分为预后良好组(CR+PR+SD)和预后不良组(PD)。
1.2.3 基线资料收集
收集对比预后不良组和预后良好组患者的性别、年龄、病变部位、术前病理类型、术前临床分期、CD3+、CD4+、CD8+、CD4+/CD8+等基线资料。
1.3 观察指标
(1)分析比较预后良好组和预后不良组患者外周血T淋巴细胞亚群水平;(2)采用Logistic回归分析外周血T淋巴细胞亚群各指标与患者预后的关系;(3)采用绘制受试者工作曲线(Receiver operating characteristic,ROC)验证各指标预测患者预后的价值。
1.4 统计学方法
2 结果
2.1 胃癌的预后情况
经评估,预后良好为68例(CR、PR、SD分别为20例、26例、22例),占68.00 %;预后不良32例(PD 32例),占32.00 %。
2.2 不同预后胃癌患者基线资料比较
较预后良好组,预后不良组外周血CD3+、CD4+、CD4+/CD8+水平较低,CD8+水平较高(P<0.05);对比2组其他资料,差异无统计学意义(P>0.05)。见表1。
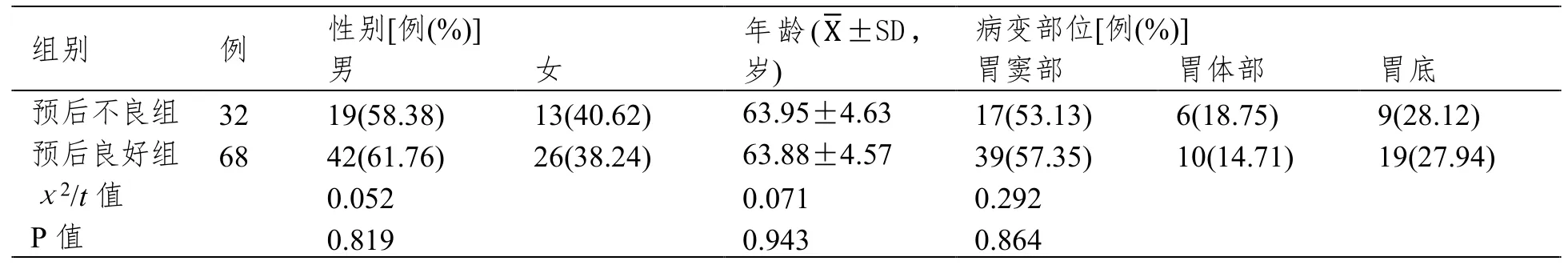
表1 不同预后患者基线资料比较
2.3 外周血T淋巴细胞亚群水平对GC辅助化疗患者短期预后的影响
将化疗前外周血CD3+、CD4+、CD8+、CD4+/CD8+为自变量,预后为因变量,设置预后不良=1,预后良好=0,Logistic分析显示,外周血CD3+、CD4+、 CD4+/CD8+低水平,CD8+高水平可增加GC辅助化疗患者预后不良的风险(P<0.05)。见表2。
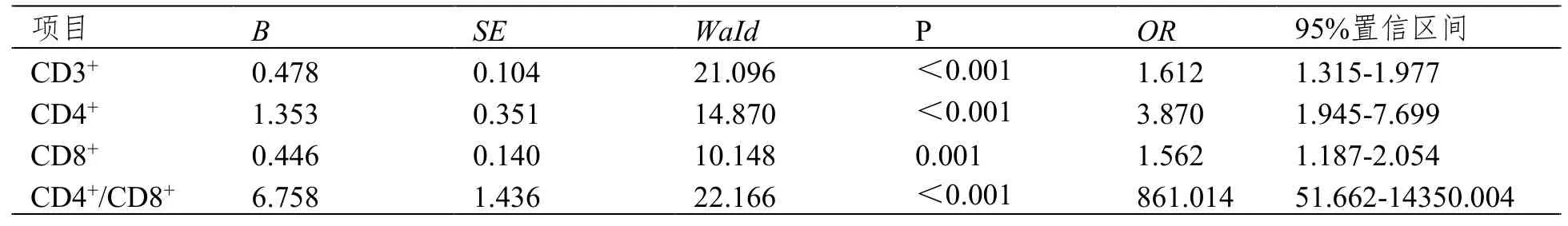
表2 外周血T淋巴细胞亚群水平对GC辅助化疗患者短期预后的影响分析
2.4 外周血T淋巴细胞亚群水平预测GC辅助化疗患者短期预后的价值
绘制ROC曲线显示:CD3+、CD4+、CD8+、CD4+/CD8+水平预测GC辅助化疗患者短期预后不良的AUC分别为0.825、0.857、0.858、0.871,均具有一定的预测价值。
见表3、图1。

图1 外周血CD3+、CD4+、CD8+、CD4+/CD8+水平预测GC辅助化疗患者短期预后的ROC曲线

续表1

表3 CD3+、CD4+、CD8+、CD4+/CD8+水平预测GC患者预后效能
3 讨论
目前,Ohue Y等[6]研究已证实,免疫系统既可抑制肿瘤生长,也可促进肿瘤的进展,。两者的关系较为密切。因而可根据机体免疫水平的变化初步评估GC患者预后情况。袁赵等[7]发现,GC根治术后运用FOLFOX4化疗方案治疗无效(即PD)为11.11 %。本研究中,32例患者预后不良(即PD),占32.00 %,高于上述研究,可能与本研究选择的样本量较多有关。均提示了部分GC辅助化疗患者预后不佳,需尽早进行干预。本研究中不同预后患者CD3+、CD4+、CD8+、CD4+/CD8+水平具有统计学差异,预后不良患者CD3+、CD4+、CD4+/CD8+降低,CD8+升高,初步提示外周血T淋巴细胞亚群水平与GC辅助化疗患者预后具有一定的关系,且在预后不良患者中外周血CD3+、CD4+、CD4+/CD8+呈低水平,CD8+呈高水平。分析其原因可能是,CD3+代表总T细胞,CD4+属于辅助性T细胞,参与免疫应答的各个阶段,具有抗肿瘤作用[8]。而CD8+属于抑制性T细胞,CD8+水平增加时,利于肿瘤的生长,且当肿瘤进展时,CD8+细胞含量增加,利于肿瘤生长。因而GC患者病情进展时CD3+、CD4+水平降低,CD8+水平升高[9]。而CD4+与CD8+之间的平衡可有效维持机体免疫环境的稳定,故CD4+/CD8+比值可更好反映机体的免疫功能变化,其比值降低时提示患者存在“免疫抑制”,可使肿瘤不断恶化,因而导致患者预后相对较差[10]。本研究进一步经Logistic回归分析发现,外周血CD3+、CD4+、CD4+/CD8+低水平,CD8+高水平可增加GC辅助化疗患者预后不良的风险,再次证实了外周血T淋巴细胞亚群水平与GC辅助化疗患者预后密切相关。分析其原因可能是,相关研究发现,肿瘤病情越严重,T淋巴细胞受抑制越明显[11]。此外,本研究绘制ROC曲线显示:CD3+、CD4+、CD8+、CD4+/CD8+水平预测GC辅助化疗患者短期预后不良的AUC分别为0.825、0.857、0.858、0.871,均具有一定的预测价值。因而临床工作者可通过检测外周血T淋巴细胞亚群(CD3+、CD4+、CD8+、CD4+/CD8+)水平预测GC辅助化疗患者短期预后情况,以此指导临床干预。但是化疗可杀伤正常组织细胞,导致机体免疫功能受到抑制。本研究未对化疗后的外周血T淋巴细胞亚群水平进行探讨,具有一定的局限性,未来可进一步完善。
综上所述,外周血T淋巴细胞亚群水平可影响GC辅助化疗患者预后情况,外周血CD3+、CD4+、CD8+、CD4+/CD8+低水平,CD8+高水平可增加GC辅助化疗患者预后不良风险。

